
- •Термохимия
- •Описание устройства калориметра
- •Определение постоянной калориметра
- •Обработка результатов калориметрических измерений и проведение расчетов
- •Определение теплоты растворения соли в воде
- •Определение теплоты реакции нейтрализации
- •Определение теплоты образования кристаллогидрата
- •Химическое равновесие
- •Определение констант равновесия реакции комплексообразования
- •Определение константы устойчивости
- •Результаты измерений оптической плотности
- •Изучение зависимости константы устойчивости комплекса от температуры
- •Температурная зависимость константы устойчивости
- •Влияние температуры на равновесие в системе жидкость - пар
- •Порядок работы на установке
- •Зависимость температуры кипения жидкости от давления
- •Обработка экспериментальных данных
- •Электрохимия растворов электролитов
- •Электропроводность растворов электролитов
- •Порядок работы на кондуктометре «Эксперт-002»
- •Определение константы сосуда
- •Определение константы диссоциации органической кислоты
Определение теплоты образования кристаллогидрата
Цель работы: Экспериментально определить теплоты растворенияCuSO45H2Oи безводной солиCuSO4
Реактивы: дистиллированная вода, безводныйCuSO4иCuSO45H2O.
Оборудование: Работу можно выполнять на любой из установок, технические весы, мерные колбы на 50, 100 и 250 мл.
Порядок выполнения работы:
Для определения теплоты образования кристаллогидрата проводятся определения теплот растворения безводной соли и ее кристаллогидрата так, как описано в разделе I.5.
Запишите по стадиям процесс растворения веществ, начиная с реакции образования кристаллогидрата из безводной соли. Сравните исходные и конечные состояния. Вычислите теплоту образования кристаллогидрата используя закон Гесса.
При проведении эксперимента количества безводной соли и кристаллогидрата задаются преподавателем. Результаты измерений также заносятся в табл.I.2. Порядок выполнения работы такой же, как и при определении теплоты растворения соли в воде.
К защите работы необходимо:
- по графику определить изменение температуры при растворении кристаллогидрата, рассчитать его концентрацию и интегральную теплоту растворения
- графическим методом определить изменение температуры при растворении безводной соли, ее концентрацию и интегральную теплоту растворения
- по полученным данным рассчитать теплоту реакции образования кристаллогидрата и сравнить полученные данные со справочными значениями (см. справочник Табл.33 стр.48).
- рассчитать абсолютные и относительные ошибки и объяснить их источники
По завершении работы все приборы должны быть выключены. Рабочее место приведено в порядок.
Таблица I.2
Химическое равновесие
Определение констант равновесия реакции комплексообразования
Цель работы:определение констант равновесия реакции комплексообразования в растворе, изучение зависимости ее от температуры и определение термодинамических характеристик реакции комплексообразования.
Реактивы:дистиллированная вода, раствор Co(SCN)20,001 г/мл , раствор KSCN 0,05 г/мл, ацетон,
Оборудование:фотоэлектрический спектрофотометр, мерные колбы на 25 мл, пипетки, кюветы, термостат,
Порядок выполнения работы:
Многие металлы образуют в растворах комплексные ионы, прочность которых характеризуют константой устойчивости. В случае образования моноядерного комплекса уравнение реакции имеет вид
Мх++nR-MR![]()
где М - металл-комплексообразователь,
R - лиганд,
n - число лигандов в комплексном ионе.
Константа равновесия KC, называемая в данном случае также константой устойчивости комплексаn, равна:
![]() (II.0)
(II.0)
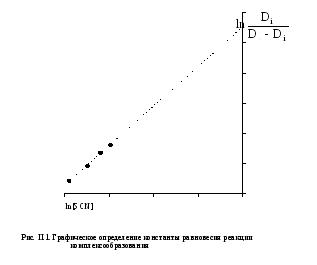
Для определения константы устойчивости мало прочных комплексов можно применить графический метод Бента и Френча. После логарифмирования обеих частей уравнения (II.1) получим следующее выражение:
![]() (II.2)
(II.2)
Последнее уравнение может быть
представлено прямой при использовании
в качестве переменных
![]()
![]() и
и
![]() ,
как показано нарис.II.1.
,
как показано нарис.II.1.
В этом случае отрезок, отсекаемый прямой на оси ординат, равен lnn, что позволяет вычислить константу устойчивости.
Равновесие реакции комплексообразования исследуют на примере реакции кобальта (II) с тиоцианатом в водно-ацетоновых растворах:
Co2+ + 4SCN-
Co(SCN)![]()
Комплексный ион Co(SCN)![]() образуется в заметных количествах при
большом избытке тиоционат-ионов в
растворе. Этот комплексный ион окрашен
в голубой цвет, поэтому для определения
его концентрации можно измерять
оптическую плотность раствора с помощью
фотоэлектрического спектрофотометра.
образуется в заметных количествах при
большом избытке тиоционат-ионов в
растворе. Этот комплексный ион окрашен
в голубой цвет, поэтому для определения
его концентрации можно измерять
оптическую плотность раствора с помощью
фотоэлектрического спектрофотометра.
Спектрофотометрический метод анализа основан на избирательном поглощении излучения определенной длины волны раствором.
При обработке результатов измерений используют закон Бугера-Ламберта-Бера
![]() (II.0)
(II.0)
где оптическая плотность
![]() ,
,
I0- интенсивность падающего потока излучения,
I-интенсивность потока излучения, прошедшего через вещество,
l- толщина поглощающего слоя,
с - концентрация,
- коэффициент погашения, основная характеристика поглощения света раствором при данной длине волны.
При с=1 моль/л и l=1см=D,
т.е. коэффициент поглощения - это
оптическая плотность раствора с
концентрацией 1 моль/л, помещенного в
кювету сl=1 см. ДляCo(SCN)![]() при длине волны 620 нм коэффициент
погашениясоставляет
1,9.103л/(моль.см).
при длине волны 620 нм коэффициент
погашениясоставляет
1,9.103л/(моль.см).
В практической работе измеряют оптические
плотности растворов Di,
пропорциональные концентрациям
комплексного ионаCo(SCN)![]() ,
и оптическую плотностьD0раствора, в котором весь металл связан
в комплекс. При обработке опытных данных
используют уравнение (II.2)
в следующей форме:
,
и оптическую плотностьD0раствора, в котором весь металл связан
в комплекс. При обработке опытных данных
используют уравнение (II.2)
в следующей форме:
![]() ,
(II.0)
,
(II.0)
где n=4. Для расчета константы
устойчивости следует построить график
с использованием переменных![]() по оси ординат иln[R-]
по оси абсцисс (см.рис.II.1).
При построении графика следует учитывать,
что лиганд во всех опытах берется в
избытке поэтому частичное связывание
лиганда в ионах комплекса практически
не уменьшает величину [R-].
по оси ординат иln[R-]
по оси абсцисс (см.рис.II.1).
При построении графика следует учитывать,
что лиганд во всех опытах берется в
избытке поэтому частичное связывание
лиганда в ионах комплекса практически
не уменьшает величину [R-].
Константы устойчивости зависят от температуры, поэтому спектрофотометрические измерения проводят с использованием термостатированных кювет.
