
- •Глава 1. Обеспечение надежной работы магистральных трубопроводов на этапе их проектирования
- •1.1. Резервирование мт
- •1.1.1. Резервирование пропускной способности
- •1.1.2. Резервирование линейной части
- •1.1.3. Резервирование насосного оборудования
- •1.2. Деление магистральных трубопроводов на эксплуатационные участки
- •1.3. Защита трубопроводов от перегрузок по давлению 1.3.1. Причины возникновения перегрузок по давлению
- •1.3.2. Средства и методы защиты трубопроводов от перегрузок по давлению [71
- •1.4. Защита трубопроводов от коррозии 1.4.1. Классификация коррозионных процессов
- •1Спгги(ту)
- •1.4Л. Причины и механизм коррозии трубопроводов
- •1.4.3. Защитные покрытия для трубопроводов
- •1.4.4. Электрохимическая защита трубопроводов от коррозии
- •Защита от блуждающих токов Механизм наведения блуждающих токов на подземные металлические сооружения и их разрушения
- •1.5. Закрепление трубопроводов на проектных отметках
- •1.5.1. Способы берегоукрепления в створах подводных переходов
- •1.5.2. Предупреждение всплытия трубопроводов
- •Закрепление трубопроводов утяжеляющими железобетонными и чугунными пригрузами
- •1.6. Применение системы автоматизации и телемеханизации технологических процессов
- •Глава 2. Надежность действующих магистральных трубопроводов
- •2.1. Основные понятия теории надежности
- •2.2. Современное техническое состояние магистральных трубопроводов [3]
- •2.2.1. Линейная часть мт
- •2.2.2. Нефтеперекачивающие станции
- •2.2.3. Резервуары
- •Глава 3. Определение технического состояния магистральных нефте- и нефтепродуктопроводов [12,13]
- •3.1. Диагностика линейной части мт
- •3.1.1. Диагностика состояния стенок труб и арматуры
- •3.1.2. Диагностика напряженно-деформированного состояния линейной части трубопровода
- •3.1.4. Контроль состояния изоляционных покрытий трубопроводов
- •Глава 4. Профилактическое обслуживание магистральных трубопроводов
- •4.1. Стратегии технического обслуживания и ремонта
- •4.2.5. Недостатки системы ппр по наработке
- •4.2.6. Основные направления совершенствования системы ппр по наработке
- •Глава 5. Ремонт линейной части и резервуаров
- •5.1.1. Последовательность и содержание работ при ремонте мт с подъемом и укладкой его на лежки в траншее
- •Обеспечение надежности магистральных трубопроводов
1Спгги(ту)
CuSO.,
|CuSO,
1.4Л. Причины и механизм коррозии трубопроводов
Основной причиной коррозии металла трубопроводов является термодинамическая неустойчивость металлов.
Подавляющее большинство металлов в земной коре находится в связанном состоянии в виде окислов, солей и других соединений. Причина этого явления состоит в термодинамической неустойчивости металлов.
Согласно второму закону термодинамики, любая система стремится перейти из состояния с большей энергией в состояние с меньшей энергией.
Так, шар, помещенный на наклонную поверхность, скатывается по' ней. Почему? Потому, что в верхней точке он обладает запасом потенциальной энергии. Скатываясь вниз, шар ее теряет и в результате приходит в более устойчивое состояние.
Другой пример. Пусть имеется электрическое поле. Если совершить внешнюю работу и внести в это поле положительно заряженную частицу, то она приобретет некоторую потенциальную энергию. Этой энергией частица будет обладать до тех пор пока мы ее удерживаем в данной точке поля. Но стоит перестать ее удерживать, как частица самопроизвольно перейдет в положение, где будет обладать наименьшей энергией - положительный заряд ее оттолкнет.
Почему сливаются капли воды или пузырьки газа? Потому, что после их слияния энергия, затрачиваемая на формирование единой капли (пузырька), меньше, чем сумма аналогичных величин для исходных капель (пузырьков).
Аналогично и вещества стремятся перейти в такое состояние, при котором их внутренняя энергия будет иметь наименьшее значение.
Энергия, которой обладают вещества, называется химической энергией.
Она создается движением электронов на электронных орбитах атомов и молекул. При определенных условиях химическая энергия может превращаться в другие виды энергии, совершать работу (например, работу образования химических соединений).
Применительно к веществам 2-й закон термодинамики звучит так: самопроизвольно совершаются только такие химические превращения, в результате которых образуются вещества с меньшей химической энергией. Практически для всех металлов (кроме золота) при образовании окислов, солей и т. д. это правило выполняется. Поэтому окисление металлов, т. е. их коррозия, в естественных условиях процесс неизбежный.
Практически круговорот металла в природе выглядит так. Металлургическая промышленность, затрачивая большое количество энергии, осуществляет восстановление металлов из руд в свободное состояние, то есть переводит их на более высокий энергетический уровень. Однако когда этот металл уже в виде какой-то конструкции подвергается действию окислителей (кислорода), он самопроизвольно переходит в более стабильное окисленное состояние.
Влияние неоднородности состава металла
Для строительства трубопроводов и резервуаров применяют малоуглеродистые и низколегированные стали. Кроме железа, они содержат углерод (до 2 %), легирующие примеси (хром, никель, марганец, медь) и примеси, которые невозможно полностью удалить в металлургическом процессе (сера, фосфор, кислород, азот, водород). Неоднородный состав сталей благоприятствует возникновению коррозионных пар в соответствующей среде.
Влияние неоднородности условий на поверхность металла
Для возникновения тока при электрохимической коррозии металла необходимо наличие катодной и анодной зон. В анодной зоне протекает реакция окисления, заключающаяся в потере металлом своих электронов и образованием ион-атомов.
Me -» Меп++ п ■ е
Переходя в раствор электролита, ион-атомы металла вызывают его постепенное разрушение - коррозию.
В катодной зоне протекает реакция восстановления - присоединения свободных электронов каким-либо веществом, называемым деполяризатором. Если роль деполяризатора играют ионы водорода
2Н+ + 2е->2Н-»Н2, то такая реакция называется реакцией водородной деполяризации. Если же деполяризатором выступает кислород
О2+ 4Н++ 4е —>2Н20 - в кислой среде, О2+ 2Н2О + 4е 4(ОН)" - в щелочной среде, то такая реакция называется реакцией кислородной деполяризации.
Из рассмотрения механизма электрохимической коррозии следует, что интенсивность процесса зависит от скорости образования ион-атомов металла (и свободных электронов), а также наличия кислорода и воды. Учитывая, что на скорость образования ион-атомов влияет температура, концентрация раствора электролита и другие внешние условия, можно сделать заключение, что если на поверхности одного и того же металла создать различные условия, то одна часть его поверхности станет анодом по отношению к другой.
Примеры образования гальванических элементов из одного металла приведены на рис. 1.4.
В первом случае анодом является электрод, помещенный в подогретый электролит. Эго связано с тем, что в подогретом электролите растворение металла происходит более интенсивно. Аналогичная картина наблюдается и в слабоконцентрированном растворе собственной соли по сравнению с концентрированным раствором этой соли. Наконец, при подаче к одному из электродов воздуха на нем облегчается протекание реакции кислородной деполяризации, характерной для катода.
К образованию коррозионных элементов на поверхности трубопроводов приводит различный доступ кислорода к разным участкам его поверхности, разная влажность грунта, неоднородность микроструктуры металла. Примеры возникновения коррозионных элементов приведены на рис. 1.5.
![]()
царапина
сварной
шов
![]()
-рг-пт—П?,

Ог
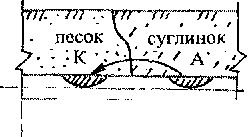
Прокладка
под насыпью автодороги
-'-■:
—. • u / /
1Щ/
1Н1П
i'l !lj
(SB
A
^
Пересечение грунтов Разное удаление участков разной плотности сечения трубы от поверхности грунта ;
Рис. 1.5. Примеры возникновения коррозионных элементов на трубопроводе в
результате различия условий на поверхности металла А - анодная зона, К - катодная зона
стрелки указывают направление движения ион-атомов металла
Влияние состава транспортируемой среды
Нефти представляют собой смесь различных углеводородов с неуглеводородными компонентами (спирты, фенолы, соединения серы, кислорода и др.). Если предельные и непредельные углеводороды совершенно инертны к металлам, то неуглеводородные компоненты вступают с металлом в химическую реакцию. Особенно опасны сернистые соединения (элементарная сера, сероводород, меркаптаны), которые являются причиной от 3 до 20% случаев коррозионного повреждения внутренней поверхности трубопроводов. Сернистые соединения нефти попадают при ее переработке и в нефтепродукты.
Широкое применение методов заводнения нефтяных пластов с целью поддержания пластового давления и интенсификации добычи нефти приводит к значительному обводнению продукции скважин. Несмотря на то, что в процессе подготовки нефти на промыслах осуществляется ее обезвоживание и обессодивание, определенное количество минерализованной воды попадает в магистральные трубопроводы и в резервуары, что приводит к их внутренней коррозии.
На ряде месторождений (например, на полуострове Мангышлак) вода, применяемая для заводнения пластов, оказалась заражена сульфатвосстанав- ливающими бактериями (СВБ). С водой они попадают и на объекты трубопроводного транспорта.
Продуктом деятельности СВБ является сероводород, вызывающий разрушение внутренней поверхности металлических сооружений.
Большую опасность в коррозионном отношении представляют также органические кислоты, образующиеся в результате окисления углеводородной и неуг- леводородной составляющих товарных топлив при их хранении и применении.
Таким образом, нефть и нефтепродукты в той или иной мере являются коррозионноактивными.
Подводя итоги вышесказанному, можно сделать неутешительный вывод, что коррозия трубопроводов - процесс неизбежный. Однако человек, ипоруженный знанием механизма коррозии, может затормозить его таким образом, чтобы обеспечить сохранение работоспособности трубопроводов в течение достаточно длительного времени.
