
Химия тест
.doc-
Гомогенная реакция, которые идут в какой-нибудь одной фазе – газовой или жидкой.NO2(г) + CO(г) = NO(г) + CO2(г);
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O. Гетерогенная между газообразным веществом и раствором, раствором и тв. веществом, между тв. и газообразным веществами. Метод получения водорода из металлического цинка и разбавленной серной кислоты:
Zn(тв)
+ H2SO4(р-р)
= H2(г)
+ ZnSO4(р-р).
Скорость химической реакции зависит
от природы реагирующих веществ, условий
протекания реакции: концентрации, t
,катализаторов. Закон действующих масс
– скорость хим. Реакции пропорциональна
произведению концентрации реагирующих
веществ.
![]() :
А и В конц. Вещества (моль/л).
:
А и В конц. Вещества (моль/л).
-
В реакциях обмена участвуют соли, кислоты, основания. Многие диссоциируются на ионы, следовательно реакции происходя между ионами.
3 Ca(NO3)2 + 2 Na3PO4 --> Ca3(PO4)2↓ + 6 NaNO3 Полное: 3Ca(2+) + 6NO3(1-) + 6Na(1+) + 2PO4(3-) --> Ca3(PO4)2↓ + 6Na(1+) + 6NO3(1-) Сокращенное:3Ca(2+) + 2PO4(3-) --> Ca3(PO4)2↓
-
Атом-электрон, протон, нейтрон; мельчайшая частица химического элемента, носитель всех его химических свойств
-
Термохи́мия — определение и изучение тепловых эффектов реакций, установление их взаимосвязей с различнымифизико-хим. Параметрами, измерение теплоёмкостей веществ.
Терм. уравнения - ур, в которых около символов хим. соединений указываются агрегатные состояния этих соединений. Энтальпия- функция состояния:Нпрямой=-Нобратной. Тф. Зак. Гесса- тепловой эффект энтальпии хим.реакции зависит от начального и конечного состояния веществ, и не зависит от промежуточных стадий процесса.
-
При́нцип Па́ули — которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.Тф.
-
Энергия Гиббса-это величина, показывающая изменение энергии в ходе химической реакции,это термодинамический потенциал следующего вида:
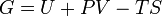
-
Полярная:+- ; Неполярная: нет катиона и аниона, О2, N2, Cl2
-
Обратимые реакции протекают не до конца. Ле Шателье— если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия, то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.N2 + 3H2 ⇄ 2NH3 + Q синтез аммиака, тепловой эффект в стандартных условиях составляет +92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта.
-
Длина — расстояние между ядрами хим.связанных атомов. Энергия равна работе, которую необходимо затратить, чтобы разделить молекулу на две части и удалить их друг от друга на бесконечное расстояние. Полярность(+,-).Насыщаемость – свойство атомов образовывать строго определенное число ковалентных связей. Направленность – связь образуется в направлении максимального перекрытия электронных облаков образующих связь различают: σ и π
-
Энтропия S-это мера вероятности состояния хим.системы,=логарифму, которыми может быть реализовано данное макро состояние: S=Rlnw. S-меря беспорядка в системе.
-
Правило Вант – Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно эмпирическому правилу Вант- Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2 – 4 раза
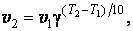
-
sp, sp2, sp3, sp3d2 гибридизации вершины в многограннике, описывающем геометрию химической частицы, равноценны, и поэтому кратные связи и неподеленные пары электронов могут занимать любые из них.
-
-это результат электростатического взаймод противопол заряжен ионов.
Все ионные соед в тв.состовляющие образуют кристалл решетку в котором каждый ион окружен ионами противопол знака при этом все свзяи данного иона кристалл можно рассмотреть как единую молекулу
сильные металлы реагируют с активными неметаллическими элементами; электроны переходят от одного атома к другому; возникшие ионы обладают стабильной конфигурацией внешних оболочек; между противоположно заряженными частицами возникает электростатическое притяжение.
-
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы независимо от их концентрации в растворе:соли, неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI;основания, образованные щелочными металлами (LiOH, NaOH, KOH ) и щелочно-земельными металлами (Ca(OH)2, Sr(OH)2, Ba(OH)2). Активность ионов-это условно эффективное концентрация иона в соотв с которой он действует в растворы:A=f*c; a=активность, C=концентрация
Коэффициент активности отношение активности данного компонента раствора к его концентрации:![]()
-
Электролиз — это окислительно-восстановительный процесс.
электролиз водного раствора сульфата калия (K2SO4) с угольными электродами.
Следовательно, электролиз водного раствора сульфата калия сводится к электролизу воды, а количество растворенной соли остается неизменным.
-
Атом водорода соедин сильно электроотриц элемент способен к преобраз еще одной связи водородной .Наличие водород связей приводит к заметной полиризации воды, фтора, водорода.
Вещество с молекул структурой проявляется в межмолекул взаймодейств.
Силы межмолеку взаимодействии слабых сил приводящих и образов ковалентной связи но проявляются они на больших расстояниях.
-
)
Вода является слабым электролитом и диссоциирует по уравнению: H2O H+ + OH-. Выражение для константы диссоциации имеет вид: Кдис = [H+]рав [OH-]рав =1,8 10-16. В чистой воде [H+] [OH-] = 1 10-14 , тогда [H+] = [OH-] = 10-7 моль/л. В водных растворах кислот [H+] > [OH-] или [H+] > 7 моль/л, среда кислая.
-
Рассмотрим электролиз водного раствора бромида меди (CuBr2) с угольными электродами. Схема электролиза:
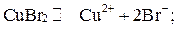

Суммарное уравнение:
![]() или
или![]()
-
Совокупность ОВР , которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), на аноде — окисление анионов и гидроксид-ионов, на катоде — восстановление катионов и ионов водорода. На аноде могут образовываться следующие продукты:а) при электролизе растворов, содержащих анионы F-, SО42- , NO3-, РO43-, ОН- выделяется кислород;б) при окислении анионов органических кислот происходит процесс: 2RCOO- - 2е → R-R + 2СО2.
-
ПР в ТФ.Раствор электр в насыщенном растворе при данном темпера есть величина постоянная и назыв произведе растворимости.
-
Амфотерность (двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов солей. Например, для гидроксида и оксида алюминия: а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O Al2О3 + 3H2SO4 = Al2(SO4)3 + 3H2O….б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O (в расплаве) Al2О3 + 2NaOH(т) = 2NaAlO2 + H2O (в расплаве)Взаимодействие с кислотными оксидами, кислотами и кислыми солями:2Cr(OH)3 + 3SO3 = Cr2(SO4)3 + 3H2O; Al(OH)3 + 3HBr = AlBr3 + 3H2O; Zn(OH)2+ 2NaHSO4 = ZnSO4 + Na2SO4 + 2H2O.
-
Соль, образованная катионом слабого основания и анионом слабой кислоты, подвергается гидролизу по катиону и по аниону.
-
ОВР - происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается
|
Cu |
+ |
HNO3 |
= |
Cu(NO3)2 |
+ |
NO |
+ |
H2O |
Реакции диспропорционирования происходят тогда, когда молекулы одного и того же вещества способны окислять и восстанавливать друг друга
|
HNO2 |
= |
HNO3 |
+ |
NO |
+ |
H2O |
Реакции внутримолекулярного окисления-восстановления происходят тогда, когда в молекуле соседствуют атомы-окислители и атомы-восстановители. Рассмотрим разложение бертолетовой соли KClO3 при нагревании:
|
KClO3 |
= |
KCl |
+ |
O2 |
-
Первая ступень гидролиза карбоната натрия протекает согласно уравнениюNа2СО…..Nа2СО3 + Н2О
 NаНСО3 +
NаОН, или в ионно-молекулярной форме:
CO32-+
Н2О
NаНСО3 +
NаОН, или в ионно-молекулярной форме:
CO32-+
Н2О  НСО3 - +
ОН-.
НСО3 - +
ОН-.
Образовавшаяся кислая соль в свою очередь подвергается гидролизу (вторая ступень гидролиза)
NаНСО3 +
Н2О ![]() Nа2СО3 +
NаОН, Или НСО3 - +
Н2О
Nа2СО3 +
NаОН, Или НСО3 - +
Н2О ![]() Nа2СО3 +
ОН-.
Nа2СО3 +
ОН-.
-
Электролиз -окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Электролиз расплавов солей
1)Катионы металлов восстанавливаются на катоде: К(-): Zn2+ + 2e- → Zn0; Na+ + 1e- → Na0
2)Анионы бескислородных кислот окисляются на аноде: А(+): 2Cl¯ - 2e-→Cl2
3)Анионы кислородсодержащих кислот образуют соответствующий кислотный оксид и кислород: А(+): 2SO42ˉ - 4e- → 2SO3 + O2
В водных растворах электролитов, кроме гидратированных катионов и анионов, присутствуют молекулы воды, которые также могут подвергаться электрохимическому окислению и восстановлению.
-
Концентрация-сколько вещества в растворе(n). Массовая доля (С%). Молярная концентрация (См) Моляльная концентрация (Cm)Молярная концентрация эквивалента (СN)Мольная доля (С). ФТ.
-
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спиновогоквантового числа электронов данного подслоя должно быть максимальным. ФТ.
-
Коррозия металлов - это процесс окисления, перехода металлов из чистого состояния в соединения, вследствие химического или электрохимического взаимодействия металла трубопровода с окружающей средой. два вида: сплошная - когда коррозионному разрушению в той или иной мере подвергалась вся незащищенная изоляцией поверхность металла; несплошная - когда на поверхности металла трубы участки, пораженные коррозией, чередуются с неповрежденными коррозией участками.
-
Sэл.-эл.с. у которых происходит заполнение последнего эн.уровня. Sподуровны – два первых эл. каждого периода или эл. гл. подгрупп 1-ой и 2-ой группы. Рэл.- у которых происходит заполнение последнего эн. уровня. Рподуровня- последние 6эл. каждого периода или эл. гл. подгрупп 3-ей 8-ой групп. Dэл.- у которых происходит заполнение 2-ого снаружи уровня. Dподуровня- эл. вставных декад (10) или эл. побочных подргупп. Fэл.- эл. у которых происходит заполнение 3-его снаружи уровня. Fподуровня- лантоноиды и актиноиды.
-
Электролитическая диссоациация-это процесс распада веществ на ионы при растворении или расплавлении. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды.
NaCl
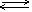 Na+ +
Cl-
Na+ +
Cl- -
Эквивалентом вещества считается такое его количество, которое соединяется с одним молем атомов Н или замещает то же количество атомов Н в хим. реакциях
Э оксида = М оксида / (Число атомов элемента х валентность элемента)
Э кислоты = М кислоты / Основность кислоты
Э основания = М основания / Кислотность основания
-
Слабые электролиты - вещества, частично диссоциирующие на ионы. Слабые электролиты не могут дать большой концентрации ионов в растворе. Степень эл. диссоциации зависит от температуры раствора. Если выразить равновесные концентрации через концентрацию слабого электролита и его степень диссоциации, то получим законо разбавления Оствальда.

-
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения ее свойств.
Коллигативные свойства растворов — это те свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
-
Схема электролиза расплава натрия:NaCl = Na+ + Cl-; Na + + e- = Na◦ 2Cl- - 2e- = Cl2
Суммарное уравнение реакции:2Na+ + 2Cl- электролиз 2 Na + Cl2; 2NaCl электролиз 2Na + Cl2
Расплав: СаСІ2 =Са2+ + 2СІ- К(-) Са2+ +2е=Са А(+) 2СІ- -2е=СІ2 СаСІ2 =Са +СІ2 Раствор: СаСІ2 =Са2+ + 2СІ- К(-) Са2+, Н2О 2Н2О+ 2е =Н2 + 2ОН- А(+) 2СІ- 2СІ- -2е=СІ2 СаСІ2 +2Н2О=Са(ОН)2 + Н2 + СІ2 KOH = K+ + OH– (–) Катод: K+ + 1e = Ko ¦х 4 (+) Анод: 4OH– – 4e = O2+ 2H2O ¦х 1 4K++ 4OH– = O2 + 2H2O+ 4K 4KOH > 4K + O2 + 2H2O
-
Ко́мплексные соединения— частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому). По природе лиганда:Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4
-
Стандартным электродным потенциалом называется потенциал, возникающий на границе металл - раствор при активности потенциалопределяющих ионов в растворе 1 моль/л и температуре 298 К. Ряд напряжений - это расположение металлов в порядке возрастания их стандартных электродных потенциалов. Уравнение Нернста.Значение электродного потенциала, возникающего на границе металл - раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Нернста:

-
В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная. Пример аквакатиона железа(II):
FeCl2кр +
6H2O
= [Fe(H2O)6]2![]() +
2Cl
+
2Cl![]() Электронная
формула атома железа – 1s22s22p63s23p64s23d6.
Электронная
формула атома железа – 1s22s22p63s23p64s23d6.
-
Химический источник тока— источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.Существует два основных вида источников тока: аккумулятор и гальванический элемент. Каждый из них является химическими источниками тока, потому что электрический ток в них вырабатывается благодаря происходящим в них химическим реакциям.Гальванический элемент — одноразовый источник тока, а аккумулятор подвергается многоразовой зарядке.
-
Степень окисления- это число электронов отданных или принятых от одного к другому. ФТ.
-
Применение электролиза для обработки поверхностей включает как катодные процессы гальванотехники (в машиностроении, приборостроении, авиационной, электротехнической, электронной промышленности), так и анодные процессы полировки, травления, размерной анодно-механической обработки, оксидирования металлических. Гальваностегия – это электроосаждение на поверхность металла другого металла, который прочно связывается с покрываемым металлом. Гальванопластика – получение путем электролиза точных, легко отделяемых металлических копий значительной толщины с различных как неметаллических, так и металлических предметов, называемых матрицами.
-
Размеры атомов и ионов. Вследствие волновой природы электрона * атом не имеет строго определенных границ. Радиусы атомов и ионов являются условными величинами. Их обычно вычисляют из межатомных расстояний, которые зависят не только от природы атомов. Энергия ионизации, энергия средства к электрону- в химических реакциях ядра атомов не подвергаются изменению, электронная же оболочка перестраивается, причем атомы способны превращаться в положительно и отрицательно заряженные ионы.
Электроотрицательность- эта величина характеризует способность атома в молекуле притягивать к себе связующие электроны.
-
Применение электрохимической защиты, которая позволяет снизить степень коррозионных процессов благодаря законам гальваники. Уменьшение агрессивной реакции производственной среды. Повышение химического сопротивления металлических материалов. Изолирование поверхности металлических конструкций от негативного атмосферного воздействия.
-
Электролизомназывают процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника тока через электролиты. Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:m = kQ, но Q =It
Второй
закон Фарадея:
массы различных веществ, выделенных
одним и тем же количеством электричества,
пропорциональных их химическим
эквивалентам (Мэ):![]()
-
Реакциями межмолекулярного окисления – восстановления называются окислительно-восстановительные реакции, окислитель и восстановитель в которых представлены молекулами разных веществ. Реакции диспропорционирования возможны, когда в исходном веществе элемент имеет промежуточную степень окисления.
-
Активация заключается в переходе молекул в такое состояние, в котором становится возможным химическое превращение. Разность среднего запаса энергии молекул в активном и неактивном состояних называется энергией активации. Активные молекулы – молекулы в активном состоянии, образующиеся из обычных молекул и способные реагировать
-
Гидролиз - реакции взаимодействия веществ с водой, приводящие к образованию слабодиссоциирующих веществ: слабых кислот или оснований, кислых или основных солей. Результат гидролиза можно расценивать как нарушение равновесия диссоциации H2O. 1.Соль, образованная слабой кислотой и сильным основанием. Уравнение гидролиза соли ацетата натрия вмолекулярной

2. Соль, образованная сильной кислотой и слабым основанием. Уравнение гидролиза соли хлорида аммония в молекулярной форме:
![]()
3. Соль, образованная слабой кислотой и слабым основанием. Уравнение гидролиза соли цианида аммония в молекулярной и ионной формах:
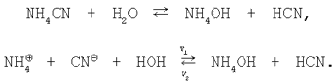
-
Процесс передачи электронов от одних веществ к другим, называют окислительно—восстановительными реакциями. Восстановители: многие металлы (магний, алюминий, цинк, железо);— аммиак NH3 и соли аммония (NH4Cl); — сероводород H2S и сульфиды (Na2S);— йодоводородная кислота HI, бромоводородная кислота HBr, соляная кислота HClи их соли (KI, NaBr, CaCl2);— тиосульфат натрия Na2S2O3;— сульфит натрия Na2SO3; — пероксид водорода H2O2;— многие органические вещества: спирты, альдегиды, карбоновые кислоты, углеводороды. Важнейшими окислителями являются:— азотная кислота HNO3 и нитраты (например, NaNO3);
-
Открытие Д. И. Менделеевым Периодического закона 1) металлические свойства ослабевают;2) неметаллические свойства усиливаются;3) с. о. в высших оксидах – увеличиваются с +1 до +8;4) с. о. в летучих водородных соединениях – с -4 до -1;5) оксиды от основных через амфотерные сменялись кислотными;6) гидроксиды от щелочей через амфотерные сменялись кислотами. Периодический закон: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов. Атом-ядро(р+,n0), електрон(е). Изотопы – разновидности атомов одного и того же химического элемента с одинаковым числом протонов и разным массовым числом.
-
Ковалентная неполярная связь образуется между атомами неметалла одного и того же хим. элемента. Такую связь имеют простые вещества, например О2; N2; C12. Ковалентная полярная связь образуется между атомами различных неметаллов.Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:
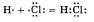 .
σ - связь значительно прочнее π-связи,
причём π-связь может быть только с
σ-связью, За счёт этой связи образуются
двойные и тройные кратные связи.
.
σ - связь значительно прочнее π-связи,
причём π-связь может быть только с
σ-связью, За счёт этой связи образуются
двойные и тройные кратные связи. -
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах. Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном в недиссоциированном состоянии (в молекулярной форме).К слабым электролитам относятся:1) неорганические кислоты (H2CO3, H2S, HNO2, H2SO3 , HCN, H3PO4, H2SiO3, HCNS, HСlO и др.);2) вода (H2O);3) гидроксид аммония (NH4OH);4) большинство органических кислот(например, уксусная CH3COOH, муравьиная HCOOH);5) нерастворимые и малорастворимые соли и гидроксиды некоторых металлов .Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация соляной кислоты (НСl) записывается следующим образом:HCl → H+ + Cl– .
-
Константы нестойкости комплексных ионов являются мерой их относительной устойчивости, подобно тому как константы диссоциации слабых электролитов являются мерой их относительной силы. Константа нестойкости комплексного иона характеризует прочность ( устойчивость) внутренней сферы комплексного соединения. В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
-
В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества. Взаимодействие с неметаллами -щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность: оксид образует только литий:4Li + O2 = 2Li2O,натрий образует пероксид:2Na + O2 = Na2O2.С галогенами все щелочные металлы образуют галогениды:2Na + Cl2 = 2NaCl.Взаимодействие с водой - все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:2M + 2H2O = 2MOH + H2.Взаимодействие с кислотами -щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой.
