
Лекция_АХ3
.pdf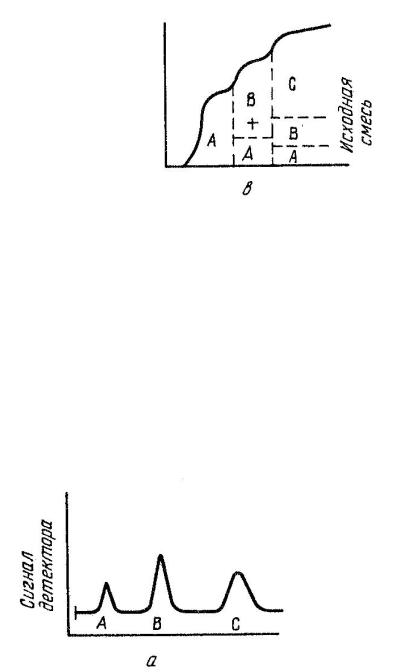
B соответствием с режимом ввода пробы в хроматографическую систему, различают:
І. Фронтальная хроматография – если растворенную смесь непрерывно вводят в хроматографическую колонку, то в чистом виде можно выделить только одно, наиболее слабо сорбирующее вещество (рис. 4.1). Все остальные выйдут из колонки в виде смеси. Из колонки сначала будет вытекать чистый растворитель, затем, когда сорбент насытится менее сорбируемым веществом А, оно появится в элюате. Когда сорбент насытится вторым, менее сорбируемым веществом В, элюат будет содержать оба эти вещества и т.д. Когда же сорбент будет полностью насыщен всеми компонентами смеси, состав элюата совпадет с составом раствора, вводимого в колонку.
Сигнал детектора
время
Рис. 4.1. Фронтальная хроматограмма (сорбируемость веществ увеличивается в ряду A < B < C
2. Элюентная – пробу вводят в поток подвижной фазы (элюента). Элюент (раствор или растворитель) обладает меньшей сорбируемостью, чем любое из разделяемых веществ. Затем в колонку вводят разделяемые вещества, растворенные в элюенте, и продолжают непрерывно пропускать элюент. При этом разделяемые вещества перемещаются вдоль колонки с разными скоростями в соответствии с их сорбируемостью. На выходе из колонки сначала появляется наименее сорбируемый компонент, затем следующий компонент и т.д. В этом случае хроматограмма представляет собой несколько пиков, имеющих форму гауссовой кривой(рис. 4.2).
время
Рис. 4.2. Элюентная хроматограмма (сорбируемость веществ увеличивается в ряду A < B < C

3. Вытеснителъная - после введения пробы и предварительного разделения слабоактивным элюентом состав элюента меняется таким образом, что он взаимодействует с неподвижной фазой сильнее каждого из компонентов анализируемой смеси. Т.е. сначала в колонку вводят небольшое количество раствора разделяемых веществ. Затем через колонку непрерывно пропускают раствор вещества (вытеснитель), обладающего большей сорбируемостью, чем любое из разделяемых веществ. По мере продвижения по колонке элюент вытесняет вещество С, которое в свою очередь вытесняет вещество В, и т.д. В результате анализируемая смесь перемещается впереди фронта вытеснителя и скорость движения веществ равна скорости движения вытеснителя. Разделяемые вещества и на колонке, и в элюате располагаются последовательно друг за другом. Каждый из компонентов выделяется в чистом виде, но не количественно, так как зоны компонентов не разделены промежутками чистого сорбента (рис. 4.3.).
Рис. 4.3. Вытеснительная хроматограмма (сорбируемость веществ увеличивается в ряду A < B < C
Наиболее распространен элюентный режим, который позволяет получить в чистом виде все компоненты пробы.
В любой хроматографической системе происходит обратимый переход молекул вещества А из подвижной фазы (ПФ) в неподвижную фазу (НФ)
Апф Ù Анф
Хроматографический процесс характеризуется зависимостью концентрации вещества в элюенте от времени хроматографирования (хроматограмма), которая характеризуется следующими параметрами (рис. 4.4):

Рис. 4.4. Параметры хроматограммы: tR – время удерживания
B процессе движения по колонке зона вещества вследствие диффузии размывается, что сказывается на ширине пиков. Ширина пиков определяется эффективностью хроматографической системы: в первом случае разделение двух веществ довольно селективно, но неэффективно; во втором случае – высокая эффективность и высокая селективность разделения.
Основными узлами хроматографов являются дозатор (система ввода пробы), хроматографическая колонка и детектор. Кроме того, в хроматографе имеются устройства для подачи газа-носителя или растворителя, для преобразования импульса детектора в соответствующий сигнал и некоторые другие.
Устройство газового хроматографа может быть представлено следующим образом (рис. 4.5):
1
2
6
3
4 |
5 |
Рис. 4.5. Блок-схема газового хроматографа:

1 – газовый шприц для ввода образца; 2 – мембрана; 3 – обходной клапан; 4 – баллон с газом-носителем; 5 – колонка; 6 – детектор
Газообразные и жидкие пробы обычно вводят с помощью специальных шприцев, прокалывая в месте ввода пробы каучуковую мембрану. В хроматографической колонке происходит разделение компонентов. Применяют прямые, спиральные и другие колонки длиной от 1–2 м и менее до нескольких десятков метров. Колонки бывают металлические, стеклянные, пластиковые. Колонок и детекторов может быть несколько. В газовой хроматографии в качестве адсорбентов используют оксид алюминия, силикагели, активированные угли, пористые полимеры на основе стирола, дивинилбензола и т.д. и синтетические цеолиты. Обязательно компьютер и банк хроматографических данных. Сейчас используют капиллярные колонки из плавленого кварца. Большое влияние на сорбируемость вещества оказывает температура, поэтому хроматографические колонки, как правило, термостатируются.
Приборы для жидкостной хроматографии имеют те же принципиальные узлы. На рис. 4.6 представлена схема хроматографа для высокоэффективной жидкостной хроматографии (ВЭЖХ).
4
3
5
6
2
1
Рис. 4.6. Жидкостный хроматограф для ВЭЖХ:
1 – подвижная фаза; 2 – фильтр; 3 – насос; 4 – термостат; 5 – колонка; 6 – детектор
Насос по определенной программе подает элюент в хроматографическую колонку. Для обеспечения высокой скорости анализа насосы создают давление до 40 МПа. Проба через специальное устройство (инжектор) вводится непосредственно в поток элюента После прохождения через хроматографическую колонку вещество детектируется проточным детектором.
РАССМОТРИМ НЕКОТОРЫЕ ВИДЫ ХРОМАТОГРАФИИ ПОДРОБНЕЕ
Жидкостная хроматография
Подвижная фаза – жидкость. B методе жидкостной хроматографии разделение чаще всего происходит при комнатной температуре. B отличие от газа, который выполняет только транспортную функцию и не сорбируется подвижной фазой, жидкая подвижная фаза - активный элюент, молекулы
которого могут сорбироваться на поверхности. При прохождении через колонку находящиеся в элюенте молекулы интересующего нас компонента должны вытеснить молекулы элюента с поверхностного слоя сорбента.
Селективность в жидкостной хроматографии, в отличии от газовой, определяется не одним, а двумя факторами – природой подвижной (элюент) и неподвижной фаз.
B стеклянную колонку длиной 1-2 м, заполненную сорбентом, вводят анализируемую пробу и пропускают элюент. Размер зерен сорбента 5-30 мкм. Для таких сорбентов необходимо принудительное нагнетание элюента через колонку. Этот метод называется высокоэффективная жидкостная хроматография (ВЭЖХ). Метод может использоваться для разделения молекул (твepдo-жидкocтная и жидкость-жидкостная хроматография), для разделения и определения ионов (ионообменная, ионная, ион-парная), для разделения макромолекул (эксклюзивная).
Адсорбционная хроматография
Неподвижная фаза должна удерживать разделяемые вещества. Подвижная фаза, т.е. растворитель, должна обеспечивать различную емкость колонки и эффективное разделение за приемлемое время.
Неподвижные фазы – это адсорбенты различных типов (полярные, неполярные, пористые носители). Это тонкодисперсные пористые материалы.
Полярные адсорбенты (SiO2, A12O3, оксиды металлов, флоросил). Все эти адсорбенты имеют на поверхности слабокислотные OH - группы, способные удерживать вещества с основными свойствами. Эти адсорбенты применяют для разделения неполярных соединений и соединений со средней полярностью. Недостаток полярных абсорбентов - высокая чувствительность к содержанию H2О в растворах, например, силоксановые группы −Si – O – Si – на поверхности SiO2 в присутствии воды переходят в силанольные ≡ Si – OH.
Неполярные адсорбенты - графитовая сажа, кизельгур, диатомит. Используют также сорбенты с привитыми неполярными фазами, например, силикагель с алкилсилильными группами от С2 до С22.
Кроме того, используют поверхностно-пористые носители – стеклянные шарики, покрытые тонким пористым слоем активного полярного или неполярного сорбента.
Подвижные фазы:
Подвижная фаза должна растворять анализируемую пробу, обладать малой вязкостью, должны быть инертной по отношению к материалам всех частей хроматографа.
Для SiO2 растворители – CC14, С6Н6, CHC13, диоксан, ацетонитрил. Применяют пропанол, изопропанол, этанол. Часто применяют не индивидуальный растворитель, а их смесь. Иногда применяют метод ступенчатого или градиентного элюирования, т.к. одна подвижная фаза в
качестве элюента может не разделить все компоненты пробы за приемлемое время.
Механизм удерживания чаще всего смешанный, т.е. удерживание происходит по адсорбционному, распределительному, эксклюзионному механизмам.
Распределительная хроматография
Метод распределительной или жидкость – жидкостной хроматографии основан на распределении вещества между двумя несмешивающимися жидкостями. Жидкая неподвижная фаза наносится на пористый инертный сорбент, как в газожидкостной хроматографии, и заполняют им разделительную колонку. При пропускании жидкой подвижной фазы через колонку смесь разделяется на компоненты за счет их различной растворимости в жидкой неподвижной фазе и в основном по тем же механизмам, что и в газожидкостной хроматографии.
Обычно полярный растворитель (H2О, спирт) фиксирован на твердом носителе – силикагеле SiO2, целлюлозе, диатомите, оксиде алюминия A12O3. Подвижной фазой в этом случае служат неполярные растворители - изооктан, С6Н6. Если неполярный растворитель зафиксирован на носителе, то в качестве подвижной фазы используют полярные растворители (воду, спирт, буферные растворы, сильные кислоты). Haнeceнные жидкие фазы имеют большой недостаток. Они быстро смываются подвижной жидкой фазой, особенно в ВЭЖХ, т.е. при повышенном давлении в колонке. Поэтому жидкие фазы прививают к носителю. Например, силикагель с привитыми нитрильными, аминными и другими группами или силикагель с привитыми алкилсилильными группами от С2 до С22.
Ионообменная, ионная хроматография
B основе ионообменной, ионной и ион-парной хроматографии лежит динамический процесс замещения ионов, связанных с неподвижной фазой, ионами элюента, поступающими в колонку.
Неподвижная фаза – ионообменники – поглощают из раствора электролита катионы или анионы, выделяя в раствор эквивалентное число других ионов с зарядом того же знака. Между катионообменником и раствором происходит обмен катионов, между анионообменником и раствором – обмен анионов.
Катионообменники (катиониты) – специально синтезированные полимерные нерастворимые в воде вещества, содержащие в своей структуре ионогенные группы: –SO3H , –COOH, –OH, –PO3H2, –AsO3H2.
Химические формулы катионитов схематически могут быть записаны как R–SO3H, R–SO3Na, где R – макромолекула. Можно записать эти
формулы еще проще: R–Н – катионит в Н-форме и R–Na – катионит в Naформе.
Реакции ионного обмена – обычные химические гетерогенные реакции:
R–Н + Na+ Ù R–Na + H+
Анионообменники (аниониты) содержат в своей структуре ионогенные группы основного характера :
–N(CH3)3+
=NH2+ ≡NH+
Их химические формулы могут быть изображены как RNH3OH и RNH3C1 (или R–OH, R–Cl).
Анионообменнуюреакциюможнозаписатьследующимобразом: R–OH + Cl– Ù R–Cl + OH–
Максимальное количество ионов, которые может связать ионообменник, определяет его емкость, которая совпадает с содержанием в ионообменнике ионогенных групп. Емкость относят к единицы массы или объема и обычно выражают в ммоль/1г сухого или набухшего ионообменника в H- или Cl-форме.
Набухание объясняется наличием в структуре ионообменников гидрофильных ионогенных групп. Чем больше плотность матрицы, тем меньше набухание ионообменника.
Селективность ионного обмена. Экспериментально установлены ряды сродства ионов по отношению к ионообменникам. Так, при низких концентрациях растворов на сильнокислотных катионитах ряды сорбируемости одно- и двухзарядных катионов выглядит так:
Cs+>Rb+>K+>Na+>Li+
Ba2+>Sr2+>Ca2+>Mg2+.
Для ионов с разными зарядами сорбируемость увеличивается с увеличением заряда:
Th4+ > Аl3+ > Ca2+ > Na+.
Ряды сродства установлены и для анионообменников. Например, для сильноосновного анионообменника сорбируемость анионов увеличивается в
ряду:
ClO4– > SCN– > I– > NO3– >Br– > Cl– > OH– > F–.
Подвижные фазы: чаще всего используют водные растворы, т.к. вода обладает прекрасными растворяющими и ионизирующими свойствами. Ha элюирующую силу подвижной фазы основное влияние оказывает рН , ионная сила, природа буферного раствора, содержание органического растворителя или поверхностно-активного вещества (ион-парная хроматография).
Для селективного элюирования поглощенных ионов можно использовать воду, буферные растворы, растворы минеральных и органических (фенол, лимонная, молочная, винная, щавелевая, ЭДТА) кислот.

Ионная хроматография
Это экспрессный метод определения органических и неорганических ионогенных соединений, сочетающий ионообменное разделение с высокочувствительным кондуктометричным детектированием. Такое детектирование возможно только при низкой фоновой электропроводности.
В основу метода положено: элюентное ионообменное разделение катионов или анионов на разделяющей колонке, заполненной ионообменником низкой емкости; подавление фонового сигнала элюента в подавляющей (компенсационной) колонке, заполненной ионообменником с высокой емкостью; кондуктометрическое детектирование ионов после разделения.
Разделяющая колонка:
с использованием в качестве элюента 0,001 М HCl и катионообменника RH происходит разделение катионов RH + MCl Ù RM + HCl
Подавляющая колонка: |
|
|
||
ROH |
+ |
HCl Ù RCl |
+ |
H2O (для элюента) |
анионообменник в OH-форме |
слабый электролит |
|||
ROH |
+ |
MCl Ù RCl |
+ |
MOH (для paздeляeмыx ионов) |
сильный электролит
B результате элюент преобразуется в воду (слабый электролит), а разделяемые ионы М+ кондуктометрически детектируются в виде гидроксидов (сильные электролиты).
На рис. 4.7 представлена хроматограмма разделения микроколичеств однозарядных катионов методом ионной хроматографии:
|
Na+ |
Li+ |
K+ |
|
NH4+ |
|
Rb+ |
0 |
16 t, мин |
Рис. 4.7. Хроматограмма смеси однозарядных катионов
Ионная хроматография – это метод определения анионов NO3–, F–, Cl–, AsO43–, PO43–, SeO42–.
Высокоэффективная жидкостная хроматография – универсальный метод, позволяющий автоматически разделять и определять сложные смеси органических и неорганических веществ, который отличает экспрессность и высокая чувствительность.
Газовая хроматография

Методом газовой хроматографии происходит разделения летучих соединений, отсюда необходимость термостатирования. Подвижная фаза - газ носитель (H2, He, N2, Ar, CO2), он протекает через неподвижную фазу, обладающую большой поверхностью. Газ – носитель не взаимодействует с разделяемыми веществами и неподвижной фазой. Процесс разделения основан на различии в летучести и растворимости разделяемых компонентов. Через хроматографическую колонку быстрее движется тот компонент, растворимость которого в неподвижной фазе меньше , а летучесть при данной температуре больше.
Газовая хроматография – серийный метод анализа органических соединений. Газовую хроматографию делят на газоадсорбционную и газожидкостную.
Плоскостная хроматография
К плоскостной хроматографии относятся бумажная и тонкослойная хроматография. Бумажная хроматография: в качестве носителя неподвижной фазы, например воды, используют целлюлозное волокно бумаги. Тонкослойная хроматография: неподвижная фаза представляет из себя различные сорбенты (оксид алюминия, силикагель, целлюлоза), нанесенные на пластинку тонким слоем. В обоих методах используют хроматографические системы жидкость – твердый сорбент, жидкость – жидкость – твердый сорбент. Подвижная фаза – различные растворители и их смеси, органические и неорганические кислоты.
В 2 – 3 см от края пластинки на стартовую линию наносят пробу анализируемой жидкости и край пластинки погружают в растворитель, который действует как подвижная фаза жидкостной адсорбционной хроматографии. Под действием капиллярных сил растворитель движется вдоль слоя сорбента и с разной скоростью переносит компоненты смеси, что приводит к их пространственному разделению. Разделяемые компоненты на пластинке или на полоске бумаги образуют отдельные зоны (пятна), как это показано на рис. 4.11:
3 |
2 |
4 |
|
||
|
1 |
|
Рис. 4.11. Схема плоскостной хроматографии:

а) на линию старта нанесены растворы индивидуальных веществ, соответствующих предполагаемым компонентам смеси («свидетели»), а также раствор анализируемой смеси; b) после развития хроматограммы
1 – подвижная фаза; 2 – проведенная карандашом линия старта; 3 – анализируемый раствор и растворы «свидетелей», которые капают на линию старта; 4 – фронт растворителя
Положение зон (пятен) на пластинке или полоске бумаги характеризует индекс Rf – относительная скорость перемещения.
R f = Ll ,
где l – смещение зоны вещества относительно линии старта, L – смещение фронта растворителя.
Величина Rf зависит от природы носителя (бумага, активность и природа сорбента), качества и природы растворителя, способа нанесения пробы, детектирования. Чем больше различие в величинах Rf разделяемых веществ, тем лучше их разделение. Величина Rf изменяется от нуля до единицы. Полное разделение двух веществ методом плоскостной хроматографии происходит, если R f1 − R f2 = ∆R f ≥ 0,05 для бумажной и ∆R f ≥ 0,1 для
тонкослойной хроматографии.
Для идентификации используется величина Rf при условии хроматографирования в одинаковых условиях. Количественный анализ – зону (пятно) вырезают и анализируемое вещество вымывают из слоя сорбента и полученный раствор анализируют каким-либо методом.
1. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2 кн. – М.: Химия, 1990.
– Кн.1. – С. 158-199. – Кн.2. – С. 542-631.
2. . Пономарев В.Д. Аналитическая химия. В 2-х частях. – М.: Высшая школа, 1982. – Ч.1. – С. 125-149. – Ч.2. – С. 261-277 3. Харитонов Ю.Я. Аналитическая химия.
Аналитика. В 2-х книгах. – М.: Высшая школа, 2001. – Кн.1. – С. 233-286. – Кн.2. – С. 402-435.
4.Основы аналитической химии. В 2-х книгах/ Под ред. Ю.А.Золотова. – М.:
Высш.шк., 2004. – Кн.1. – С. 204-348.
5.Васильев В.П. Аналитическая химия. В 2-х книгах. – М.: Дрофа, 2002. –
Кн. 1. – С. 268-272. – Кн.2. – С. 277-342.
