
75 группа 2 вариант / Химия / fischem
.pdf1).Если в жидкости растворено какое-либо вещество, то количество молекул растворителя на границе раздела фаз (раствор-пар) будет меньше, чем у чистого растворителя, поэтому и давление насыщенного пара растворителя над раствором окажется ниже, чем над чистым растворителем. Понижение давления пара тем больше, чем выше концентрация раствора.
Закон Рауля: относительное понижение давления пара растворителя равно отношению числа молей растворенного вещества к сумме молей растворителя и растворенного вещества:
p0 |
− p0 |
= |
|
|
n |
, |
(3.3) |
2 |
1 |
|
|
1 |
|||
|
p0 |
n |
2 |
+ n |
|||
|
|
|
|
||||
|
2 |
|
|
1 |
|
|
где р02 –давление пара над чистым растворителем, р1 – давление пара растворителя над раствором, n1 – число молей растворенного вещества, n2 – число молей растворителя. Т.к. n1/(n1+n2) – мольная доля, закон Рауля можно сформулировать: относительное понижение давление пара растворителя равно мольной доле растворенного вещества.
2).Понижение температуры замерзания растворов связано с понижением давления пара над раствором по сравнению с чистым растворителем. Жидкость замерзает при той температуре, когда давление пара над ней равно давлению пара над ее льдом.
На графике зависимости р–Т (рис.3.1) точка пересечения кривых, отражающих зависимость от температуры давления пара надо льдом и над растворителем лежит выше и правее, чем точка пересечения с кривой давления пара над раствором. Т.е. давление пара над раствором становится равным давлению пара надо льдом при более низкой температуре. При этом понижение температуры замерзания ( Тз) растет с концентрацией молекулярного раствора:
Тз=Т0-Тз р-ра. |
(3.4) |
Тз=ЕзСm, |
(3.5) |
где Ез – криоскопическая постоянная растворителя или моляльное понижение температуры замерзания – понижение температуры замерзания при растворении 1 моль неэлектролита в 1000 г растворителя; Сm – моляльная концентрация. Ез зависит только от природы растворителя (справочная величина): вода - 1,86 ; бензол – 5,1; фенол – 7,3; анилин – 5,9 град/моль.
При смешении соли со снегом или льдом наблюдается сильное понижение температуры образующегося раствора из-за поглощения тепла тающим льдом и растворяющейся солью: (29 г NaCl + 100 г льда) понижают температуру до - 21,2оС, (142 г CaCl2 6H2O + 100 г льда) до -55оС. Охлаждающие смеси и антифризы имеют большое практическое применение. Их используют для охлаждения цилиндров тракторных, автомобильных и авиационных двигателей в зимнее время, для заполнения противопожарных трубопроводов в не отапливаемых помещениях.
3)Повышение температуры кипения растворов. Жидкость кипит при равенстве давления пара над ней атмосферному давлению. Поскольку давление пара над раствором, ниже, чем над растворителем, то оно достигает значение
41

атмосферного при более высокой температуре (рис.3.2). Повышение температуры кипения зависит от концентрации:
Тк=Тр-р-Т0; |
(3.7) |
Тк=ЕкСm, |
(3.8) |
где Тк – повышение температуры кипения, |
Сm – моляльная |
концентрация, Ек – эбулиоскопическая постоянная растворителя или моляльное повышение температуры кипения – повышение температуры кипения для раствора, содержащего 1 моль растворенного неэлектролита в 1000 г
растворителя. Эбуллиоскопическая постоянная зависит от природы растворителя и не зависит от природы неэлектролита и его концентрации: вода
– 0,5; бензол – 1,2; этиловый спирт - 2,1 град/моль растворенного в-ва.
Рис.3.1. Связь понижения давления |
Рис.3.2.Связь понижения давления |
пара с понижением температуры |
пара с повышением температуры |
замерзания |
кипения |
Моляльная |
концентрация раствора рассчитывается |
по формуле: |
|
Сm= |
mр.в. 1000 |
, |
(3.9) |
M р.в. mр−ля |
|||
подставив это выражение в уравнение 3.5, можно выразить из него Мр.в.:
Мр.в. = |
E mр.в. 1000 |
(3.10) |
mр−ля T |
Используя криоскопический или эбулиоскопический метод можно определять молярную массу неэлектролита.
Осмос – односторонняя диффузия растворителя из менее концентрированного в более концентрированный раствор через полупроницаемую мембрану. Осмос ведет к выравниванию концентраций растворов. Сила, обуславливающая осмос, отнесенная к единице поверхности – осмотическое давление. Измеряют осмотическое давление осмометром (рис. 3.3). Это сосуд с трубкой, которая соединяется с манометром. Сосуд имеет окошко, закрытое полупроницаемой мембраной. Сосуд заливается раствором и опускается в растворитель. Растворитель диффундирует через мембрану в раствор, уровень жидкости в трубке осмометра повышается, что создает гидростатическое давление. С увеличением гидростатического давления диффузия замедляется и наступает динамическое равновесие. Установившееся
42
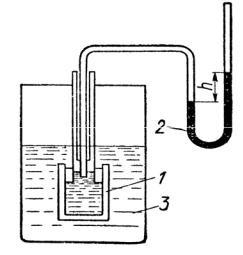
при этом гидростатическое давление, фиксируемое манометром, служит мерой осмотического давления.
Изучая результаты опытов П.Ф. Пфейфера по измерению осмотического давления растворов Я.Г. Вант-Гофф (1886) заключил, что между состоянием вещества в растворе и газообразным состоянием имеется качественная и количественная аналогия.
Рис.3.3.Схема осмометра: 1 – осмометр, 2 – манометр, 3 – сосуд с растворителем
Закон Вант-Гоффа: Осмотическое давление раствора на границе раствор – растворитель равно газовому давлению, которое было бы, если бы растворенное вещество находилось в газообразном состоянии и занимало бы объем раствора при той же температуре.
росмV=nRT, |
(3.11) |
где росм – осмотическое давление в н/м2, V – объем раствора в м3. Из уравнения следует, что осмотическое давление пропорционально концентрации растворенного вещества и абсолютной температуре.
Осмотическое давление играет большую роль в процессе усвоения пищи, обмена веществ, подает воду в крону деревьев и т.д. Клеточная мембрана – полупроницаема. Давление клеточного сока на мембрану – гидростатическое давление обуславливает тургор. Потеря тургора клетками в концентрированном растворе – плазмолиз (испытывают растения на солончаках). Консервирование овощей, фруктов, ягод соленьем, вареньем связанно с добавлением большого количества соли или сахара, которые обезвоживают гнилостные микроорганизмы. Растворы с одинаковым осмотическим давлением – изотонические (физиологический раствор - 0,9% NaCl изотоничен плазме крови). Компоты содержат изотоническую клеточному соку ягод концентрацию сахара и т.д. Растворы с большим осмотическим давлением – гипертонические, с небольшим – гипотонические. Гемолиз крови – разрушение клеток крови имеет место при погружении эритроцитов в гипотонический раствор.
Все выше изложенное относится к растворам органических веществ в
воде.
43
Растворы электролитов
Растворы неорганических веществ (солей, кислот, оснований) замерзают при более низких, а кипят при более высоких температурах, чем растворы органических веществ . Причину объяснила теория электролитической диссоциации С.Аррениуса:
1)Ионы в растворе существуют и при отсутствии прилагаемого электрического поля.
2)Частицы электролита в растворе существуют в виде ионов и
молекул.
3)Между ионами и молекулами существует равновесие.
4)Между ионами в растворе нет электростатического взаимодействия.
Электролиты условно подразделяют на сильные и слабые по степени диссоциации (α) (отношение числа распавшихся на ионы молекул к общему числу растворенных молекул). Слабые электролиты подчиняются закону разбавления Оствальда, согласно которому с увеличением концентрации
степень диссоциации уменьшается, а константа диссоциации остается неизменной (Кд=α2С). Но, как показали результаты экспериментов, для сильных электролитов константа диссоциации изменяется с изменением концентрации. В концентрированных растворах уменьшается величина электропроводности, осмотическое давление и др. Изменение свойств растворов сильных электролитов с увеличением концентрации объясняет теория сильных электролитов П. Дебая – Э. Хюккеля.
Согласно этой теории молекулы сильных электролитов практически полностью диссоциированы на ионы в растворах любой концентрации. Что доказано, в частности, отсутствием соответствующих полос недиссоциированных молекул в спектрах поглощения и спектрах комбинационного рассеивания. К тому же ионы уже существуют в составе твердых кристаллов. Наблюдаемое же понижение электропроводности, осмотического давления и т.д. при повышении концентрации сильных электролитов, связано не с уменьшением степени диссоциации, а с влиянием электростатического взаимодействия ионов. В результате электростатического взаимодействия каждый ион окружен определенным числом контрионов (ионной атмосферой). При разбавлении расстояния между ионами увеличиваются, силы электростатического взаимодействия ослабевают, уменьшается тормозящее действие контрионов, что воспринимается как полная диссоциация.
Для количественной характеристики свойств сильных электролитов
вводится понятие активности ионов (а+, а-). Активность выражает эффективную концентрацию диссоциированной части электролита в растворе, учитывающей взаимное притяжение разноименных ионов. Она является вспомогательной, расчетной величиной:
ак =f+С+, аа =f- С- |
(3.12) |
где f+ и f- - коэффициенты активности катионов и анионов, С+ и С- - |
|
аналитические концентрации |
катионов и анионов в моль/1000 г р-ля. |
44
Практически используется средний коэффициент активности для анионов и катионов (f). Его величина зависит и от присутствия других ионов в растворе. Для характеристики влияния концентрации всех ионов в растворе вводится понятие ионной силы:
J=1/2(C1Z2+C2Z2+…CiZi2), (3.13)
где С – молярная или моляльная концентрация иона, Z – заряд иона. В растворах с одинаковой ионной силой коэффициент активности имеет одну и ту же величину.
Для разбавленных водных растворов, ионная сила которых не превышает 0,01, зависимость коэффициента активности от ионной силы (при 25оС)
выражается формулой предельного закона Дебая – Хюккеля:
lg f = - 0,51 z+ z - J1/2 |
(3.14) |
Ионная сила крови животных приблизительно 0,15. Поддержание этой величины – важное условие гомеостаза (постоянства внутренней среды).
Электропроводность растворов – величина обратная сопротивлению.
Она выражается формулой
L=χ S/l , (4.1)
где L – электропроводность измеряется в ом-1. χ - удельная электропроводность
– электропроводность куба данного проводника с длиной ребра, равной 1 см,
при площади электродов 1 см2. Удельная электропроводность растворов изменяется в пределах – 10-8÷1 ом-1см-1, что значительно меньше, чем у проводников первого рада.
Если подставить выражение электропроводности в уравнение закона Ома и выразить оттуда удельную электропроводность, то получится:
χ = |
I |
|
l |
, |
(4.2) |
|
E |
S |
|||||
|
|
|
|
где I - сила тока, Е – напряжение, S и l –площадь и длина проводника.
Удельная электропроводность численно равна числу ампер, которое проходит через слой электролита толщиной 1 см, с сечением 1см2 при градиенте потенциала в 1 в/см.
Электропроводность раствора электролита зависит от 1)концентрации ионов, 2)скорости их перемещения, 3)заряда ионов, 4)температуры раствора.
1).По мере разбавления раствора удельная электропроводность возрастает из-за увеличения степени диссоциации слабых электролитов или активности сильных, которые увеличиваются сначала быстрее, чем уменьшается общая концентрация ионов в растворе. А затем, из-за уменьшения абсолютного числа ионов в единице объема, удельная электропроводность падает.
2).Ионы различных электролитов движутся в электрическом поле с различной скоростью. Абсолютные скорости движения ионов (uо) в воде при 18оС и градиенте потенциала 1 в/см невелики: 3 10-4 ÷35 10-4 см/сек. Низкая скорость объясняется гидратацией ионов, а следовательно и увеличением размера движущейся частицы, что увеличивает сопротивление среды.
45
3).Заряд иона определяет количество электричества, которое он переносит с одного электрода на другой.
4).С ростом температуры, удельная электропроводность растворов растет на 2% на каждый градус, т.к. уменьшается вязкость среды и увеличивается кинетическая энергия ионов.
Эквивалентная электропроводность – электропроводность раствора,
содержащего 1 моль-эквивалент электролита. Обозначается λv. Поскольку растворимость электролитов различна, то моль-эквивалент их можно растворить в различном объеме растворителя.
Число, показывающее, сколько см3 раствора надо взять, чтобы в нем находился 1 моль-эквивалент растворенного электролита, называется разбавлением (V). Электропроводность 1 см3 - χ. Поэтому эквивалентная
электропроводность равна |
|
λv =χV [ом-1см2 моль-экв-1] |
(4.3) |
Эквивалентная электропроводность |
с разбавлением увеличивается, т.к. |
при постоянном количестве электролита число ионов с разбавлением увеличивается. При достаточно большом разбавлении наступает полная диссоциация электролита (α=1 или f=1), после чего количество ионов в растворе остается неизменным. Эквивалентная электропроводность, которая достигает максимума и более не изменяется, называется эквивалентной электропроводностью при бесконечном разбавлении (λ∞). У сильных электролитов λ∞ достигается довольно быстро при разбавлении раствора, у слабых электролитов λv растет непрерывно при всех разбавлениях, доступных исследованию в водных растворах.
Каблуков установил, что электролиты, ведущие себя как сильные в водных растворах в других растворителях (спирты, бензол) могут вести себя как слабые электролиты. Так, например, ведет себя хлороводород.
Закон независимого движения ионов (Кольрауша). Если взять эквивалентные электропроводности солей, имеющие одинаковые катионы или анионы, то разность этих электропроводностей будет постоянной.
Таблица 4.1.
Электролиты |
λ∞ (ом-1см2моль-экв-1) |
Δλ∞ |
KCl |
129,8 |
Разные катионы: 129,8 – 108,6 = 21,2 |
NaCl |
108,6 |
126,1 – 104,9= 21,2 |
KNO3 |
126,1 |
Разные анионы: 129,8 – 126,1 = 3,7 |
NaNO3 |
104,9 |
108,6 - 104,9 = 3,7 |
Найденная закономерность дает возможность считать, что катион и анион проводят электрический ток независимо друг от друга. Следовательно λ∞ - суммарное свойство:
λ∞ = la +lk , (4.4)
где la , lk – подвижности катиона и аниона (электропроводности ионов).
Эквивалентная электропроводность раствора электролита при бесконечном разбавлении равна сумме подвижностей катиона и аниона данного электролита. (Закон Кольрауша).
46
Подвижность ионов пропорциональна их абсолютным скоростям (u):
la = Fuaо ; lk = Fuкo , [ом-1см2моль-экв-1}] |
(4.5) |
где F –число Фарадея. |
|
λ∞= Fuaо + Fuкo= F(uk +ua) |
(4.6) |
Подвижность ионов изменяется с изменением |
температуры и |
разбавлением. Разбавление уменьшает электростатическое взаимодействие зарядов, препятствующее движению ионов. А температура влияет на вязкость раствора, уменьшая ее.
Сольватация ионов также влияет на подвижность, увеличивая радиус частицы за счет удерживаемых в электрическом поле иона дипольных молекул воды. Чем сильнее напряженность поля иона, тем больше молекул воды удержится в нем. Например: у иона Li+ маленький радиус обуславливает большую плотность электрического поля, в котором ассоциируется больше
молекул воды, поэтому подвижность этого иона меньше, чем у ионов Na+, K+, Cs+.
Практическое применение электропроводности. 1.Определение степени диссоциации. Эквивалентная
пропорциональна степени
(4.7)
где К – коэффициент пропорциональности, зависящий от природы электролита.
При бесконечном разбавлении раствора |
электролит полностью распадается на |
ионы α=1, тогда |
|
λ∞=Кα=К |
(4.8) |
Следовательно К – эквивалентная электропроводность при бесконечном |
|
разбавлении данного электролита. |
|
λv=αλ∞, |
(4.9) |
откуда |
|
α=λv /λ∞. |
(4.10) |
Эквивалентная электропроводность легко определяется опытным путем, а электропроводность при бесконечном разбавлении рассчитывается по справочным данным согласно закону Кольрауша.
2.Определение константы диссоциации слабого электролита. Если полученное выражение степени диссоциации подставить в уравнение закона разбавления Оствальда:
K = |
α2 |
|
, |
|
|
(1−α)V |
|
||||
|
|
|
|
||
то получим после преобразований: |
|
||||
K = |
λ2V |
|
|
(4.11) |
|
λ∞ (λ∞ −λv )V |
|
||||
Это уравнение связывает константу диссоциации с электропроводностью. |
|||||
3.Определение растворимости труднорастворимых солей. Измерив |
|||||
удельную электропроводность, и найдя |
λ∞ = la +lk из уравнения λv =χV |
||||
47
находим разбавление (объем, содержащий 1 моль малорастворимого электролита). Обратная величина этого числа – растворимость соли в моль/л.
Экспериментальная часть
Явления, наблюдаемые при растворении веществ Опыт 1. Изменение температуры при растворении.
В две пробирки налейте до 1/3 объема воды и измерьте ее температуру. В первую пробирку всыпьте 2-3 г нитрата аммония, осторожно перемешайте термометром и отметьте самую низкую температуру. Во вторую пробирку внесите несколько кусочков гидроксида натрия и после перемешивания отметьте самую высокую температуру. Объясните происходящие явления.
Опыт 2. Зависимость растворимости солей от температуры.
Налейте в пробирку воды, всыпьте в нее небольшое количество нитрата натрия, истолченного в порошок, взбалтывайте до полного растворения соли. Добавляйте нитрат натрия и взбалтывайте до тех пор, пока соль не перестанет растворяться и на дне останется немного кристаллов. Нагрейте пробирку на пламени горелки до растворения соли, продолжая добавлять соль до получения насыщенного горячего раствора. Нагреть раствор до кипения и дать ему охладиться до комнатной температуры. Отметьте, какое количество кристаллов выпало. Сделайте вывод о растворимости NaNO3 при разных температурах.
Опыт 3. Пересыщенные растворы.
В пробирку насыпьте 5 г ацетата натрия, прибавьте 3 мл воды и нагрейте до растворения соли. Затем, закрыв отверстие пробирки ватой, поставьте пробирку в стакан с холодной водой. Когда раствор охладиться выньте вату и бросьте в пробирку кристаллик ацетата натрия. Объясните наблюдаемое явление.
Опыт 4. Приготовление растворов заданной концентрации.
Получите у преподавателя задание для приготовления определенного объема раствора соли заданной концентрации из имеющегося в лаборатории кристаллогидрата.
Контрольные вопросы
1.Дайте определение растворов. Охарактеризуйте молекулярные растворы с позиций сольватной теории Д.И.Менделеева.
2.Дайте определение моляльной концентрации и мольной доли, как способам выражения состава раствора.
3.Охарактеризуйте причину понижения давления пара над раствором по сравнению с давлением пара над чистым растворителем. Сформулируйте закон Рауля.
4.Объясните причину понижения температуры замерзания растворов по сравнению с растворителями. От чего зависит величина понижения? Дайте определение криоскопической постоянной.
5.Опишите криоскопический метод определения молекулярной массы органических веществ.
48
6.Объясните причину повышения температуры кипения растворов по сравнению с растворителями. Опишите зависимость повышения температуры от концентрации раствора. Дайте определение эбулиоскопической постоянной.
7.Что такое осмос? Как можно измерить осмотическое давление? Дайте формулировку закона Вант-Гоффа.
8.Сформулируйте основные положения теории электролитической диссоциации С. Аррениуса.
9.Как теория сильных электролитов П. Дебая – Э. Хюккеля объясняет изменение электропроводности и осмотического давления в растворах сильных электролитов с увеличением их концентрации?
10. Что такое активность ионов? Как она рассчитывается? Что такое ионная сила раствора? Приведите выражение предельного закона Дебая – Хюккеля.
11.Что такое электропроводность растворов? Дайте определение удельной, эквивалентной и эквивалентной электропроводности при бесконечном разбавлении. От чего зависит электропроводность раствора?
12.Что такое подвижность ионов? От чего она зависит? Сформулируйте закон независимого движения ионов Кольрауша.
Примеры решения задач.
Пример 1. Определите массу кристаллогидрата CuSO4 5H2O, необходимого для приготовления 50 г 10%-ного раствора сульфата меди. Какой объем воды необходим для приготовления этого раствора?
Дано: |
Решение: |
mр-ра = 50 г |
Найдем массу безводной соли в 50 г 10%-ного р-ра |
W(CuSO4) = 10% |
W = (mв-ва / mр-ра) 100% |
|
m(CuSO4) = 50 0,1 = 5 (г) |
Найти:V(H2O), |
M(CuSO4)=64+32+4 16=160(г/моль) |
m(CuSO4 5H2O), |
Найдем количество вещества CuSO4: ν=m/M, |
|
ν(CuSO4)=5/160=0,031(моль) |
Найдем массу кристаллогидрата, содержащего 5 г безводной соли: 1 моль
CuSO4 5H2O содержит 1 моль CuSO4, ν( CuSO4 5H2O)=ν(CuSO4)=0,031 моль. M(CuSO4 5H2O)=160+5 18=250(г/моль), m(CuSO4 5H2O)=250 0,031=7,8(г).
Найдем объем воды, необходимый для приготовления раствора: m(H2O) = mр-ра - mв-ва , m(H2O) = 50-7,8 = 42,2 (г)
V(H2O) = m/ ρ, ρ(Н2О) = 1 г/мл, V(H2O) = 42,2/1 = 42,2 (мл) Ответ: m(CuSO4 5H2O) = 7,8 г; V(H2O) = 42,2 мл.
Пример 2. Приведите расчет для приготовления 200 мл 0,3 н раствора сульфата никеля из имеющегося в лаборатории NiSO4 7H2O и воды.
49
Дано: |
Решение: |
||
СН(NiSO4)=0,3 моль-экв/л |
|
mв−ва |
|
|
Сн = |
|
, |
|
M f Vр−ра |
||
Vр-ра=200мл=0,2 л |
Найдем массу соли NiSO4 7H2O. Так как 1 моль |
||
Найти: m(NiSO4 7H2O). |
кристаллогидрата содержит 1 моль безводной соли, то |
||
|
при приготовлении растворов заданной |
||
нормальной или молярной концентрации, расчет ведут по молярной массе кристаллогидрата.
mв-ва=Cн M f Vр-ра, где М=59+32+64+18 7=281(г/моль), f=1/2 (табл.1 №24), mв-ва=0,3 281 0,5 0,2=8,43(г).
Растворы молярной и нормальной концентрации готовят в мерных колбах заданного объема, поэтому объем добавляемой воды не рассчитывают.
Ответ: m(NiSO4 7H2O)=8,43 г.
Пример 3. Какой объем 15%-ного раствора карбоната натрия (ρ=1,10 г/мл) необходим для приготовления 120 мл 0,45 М раствора?
Дано: |
Решение: |
W(Na2CO3)=15% |
W = (mв-ва / mр-ра) 100%, ρ=m/V, |
ρ(15%р-ра)=1,1 г/мл |
См = m/M Vр-ра (табл.1) |
V(0,45Мр-ра)=120 мл |
М(Na2CO3)=2 23+12+3 16=106(г/моль) |
СМ=0,45 моль/л |
Масса безводного Na2CO3 в 120 мл 0,45 М р-ра: |
Найти: V15%р-ра |
m(Na2CO3)=0,45 106 0,12 = 5,72 (г) |
Найдем, в какой массе 15%-ного раствора содержится 5,72 г карбоната натрия:
mр-ра=5,72/0,15=38,13 (г), Vр-ра=m/ρ, V15%р-ра= 38,13/1,1=34,67(мл) Ответ: V15%р-ра= 34,67 мл.
Пример 4. Рассчитайте молярную, моляльную и нормальную
концентрацию серной кислоты в ее 16% растворе. |
|
|
||||||||||||
Дано: |
Решение: |
|
|
|
|
|
|
|||||||
W(H2SO4))=16% или |
СМ |
= |
m |
|
[моль/л]; |
СН = |
m |
[моль-экв/л]; |
||||||
M V |
M f V |
|||||||||||||
0,16 |
|
|
|
|
|
|
|
|
||||||
|
Сm= |
mр.в. |
|
1000 |
|
|
|
|
||||||
|
M р.в. |
mводы |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||
Найти: СМ, СН |
W= |
|
|
mр.в. |
|
100% ; m(р-ра)=ρV; |
|
|
||||||
|
|
mр−ра |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
Из таблицы: ρ(16% |
H2SO4) =1,112 г/мл. |
|
|
|
||||||||||
Пусть имеется 1 л 16% раствора H2SO4, тогда: |
|
|||||||||||||
m(16% H2SO4) =1,112 1000=1112 (г), |
|
|
|
|||||||||||
m(р.в)=1112 0,16=177,92 (г) |
|
|
|
|
|
|
|
|||||||
М(H2SO4)=98 г/моль. |
|
|
|
|
|
|
|
|
|
|
|
|
||
СМ=177,92 =1,82 (моль/л) |
|
|
|
|
|
|
|
|||||||
98 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
f(H2SO4)=1/2, CH= 177,92 =3,64 (моль-экв/л) 98 0,5 1
50
