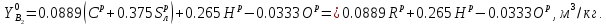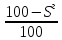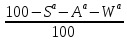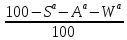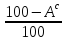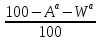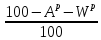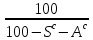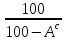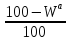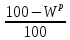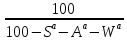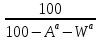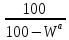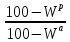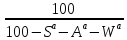- •Министерство образования и науки Российской Федерации
- •Вопрос 22. Выведите расчетное выражение (формулу) для подсчета теоретически необходимого количества воздуха при сжигании 1 кг твердого и жидкого топлива.
- •Вопрос 32. Что такое полезно используемая теплота пк? Какая связь ее с кпд пк?
- •Вопрос 42. Закон Аррениуса и энергия активизации.
- •Вопрос 52. Характеристики угольной пыли. Тонкость помола пыли.
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное
учреждение высшего профессионального образования
«Ивановский государственный энергетический университет
имени В.И. Ленина»
Кафедра ТЭС
Контрольная работа
по курсу «Котельные установки и парогенераторы»
Вариант №2
Выполнил: студент гр. 3-75
Беляев А.Н.
Иваново 2015.
Вопрос 2. Изобразите упрощенную принципиальную схему теплоэлектроцентрали (ТЭЦ) с котлом Е-420-13.8-565Ж и проставьте в нужных точках схемы численные значения величин, указанных в марке котла, с размерностями.

Упрощенная принципиальная схема ТЭЦ с котлом Е-420-13.8-565Ж
Паровой котел Е-420-13.8-565Ж;
Паровая турбина;
Электрический генератор;
Конденсатор;
Конденсатный насос;
Питательный насос;
Подогреватель низкого давления;
Подогреватель высокого давления;
Деаэратор;
Подогреватель сетевой воды;
Промышленный отбор пара;
Водоподготовительная установка.
Вопрос 12. Порядок пересчета содержания элементов с одной массы на другую.
Виды исходной массы топлива.
Рабочая – то, что поступает в котельную,
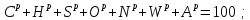
Аналитическая – в условиях лаборатории,
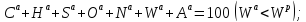
Сухая (влажность
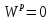 ),
),
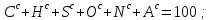
Горючая (влажность
 ,
зольность
,
зольность ),
),
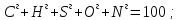
Органическая,

Для
произвольного элемента справедливо
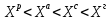
Переход от одной массы к другой осуществляется с помощью коэффициентов пересчета, которые и используются для пересчета содержания элементов с одной массы на другую.
Переводные формулы:
|
Масса топлива при исходных данных |
Коэффициенты для пересчета данных на массу топлива | ||||
|
Органическую |
Горючую |
Сухую |
Аналитическую |
Рабочую | |
|
Органическая |
1 |
|
|
|
|
|
Горючая |
|
1 |
|
|
|
|
Сухая |
|
|
1 |
|
|
|
Аналитическая |
|
|
|
1 |
|
|
Рабочая |
|
|
|
|
1 |
Вопрос 22. Выведите расчетное выражение (формулу) для подсчета теоретически необходимого количества воздуха при сжигании 1 кг твердого и жидкого топлива.
Теоретический объем воздуха – это то количество воздуха, которое необходимо израсходовать для полного сжигания 1 кг. топлива, при условии, что весь кислород прореагировал с горючим.
В процессе горения топлива в топке котла участвует углерод, водород и горючая сера топлива. В результате завершившегося процесса горения из исходных веществ – топлива и атмосферного воздуха – в топке образуются продукты сгорания: дымовые газы, а при горении твердого топлива – еще и очаговые остатки. По закону сохранения материи масса продуктов сгорания оказывается равной массе топлива и атмосферного воздуха, вступивших в реакцию горения.
При сгорании углерода имеем следующую зависимость: C+O2=CO2 [1], то есть 12 массовых частей + 32 массовые части = 44 массовые части.
Горение серы при теплохимических расчетах выражается стехиометрическим уравнением реакции сгорания серы и серистый ангидрид, то есть уравнением : S+O2=SO2 [2], то есть 32 массовые части + 32 массовые части = 64 массовые части.
Саморазгоняющийся характер цепных реакций горения водорода, окиси углерода и углеводородов, приводящий к почти мгновенному завершению их, позволяет для практических расчетов пользоваться стехиометрическими уравнениями этих реакций.
Горение водорода – уравнение: 2H2+O2=2H2O2 [3], то есть 4 массовых части + 32 массовых части = 36 массовых частей.
Горение окиси углерода – уравнение: 2CO+O2=2CO2 [4], то есть 56 массовых частей + 32 массовые части = 88 массовых частей.
Углекислота, сернистый ангидрид, азот и кислород образуют в совокупности «сухие» газы. Углекислоту и сернистый ангидрид часто объединяют под названием «сухие трехатомные газы» и обозначают через RO2.
RO2=CO2+SO2 [5].
Сопоставление уравнения реакции горения углерода [1] с уравнением реакции горения серы [2] показывает, что эти реакции выражаются стехиометрически одинаково. Это позволяет упростить теплотехнические расчеты, относящиеся к процессу горения топлива, путем замены в них количества содержащейся серы в топливе эквивалентным ей количеством углерода. Очевидно, что количество углерода эквивалентное количеству летучей серы, содержащейся в топливе, равно:
Cэкв=12/32·Sn=0.375·Sл % [6].
Поэтому суммарное содержание углерода и серы в топливе можно заменить эквивалентным содержанием углерода:
R=C+Cэкв=C+0.375·Sл % [7].
Количество воздуха, необходимое для горения, а также состав дымовых газов вычисляют в кубических метрах при нормальных условиях (0 ºС и 760 мм.рт.ст.) для 1 кг. твердого и жидкого топлива.
Из формул [1], [2] и [3] следует, что для обеспечения полного сгорания 1 кг твердого и жидкого топлива, имеющего элементарный состав Cp, Hp, Op, Np, Sлp, Ap и Wp теоретически требуется массовое количество кислорода, равное:
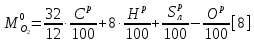
или соответственно объемное количество его равное:
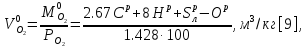
где
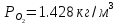 - плотность кислорода при нормальных
условиях.
- плотность кислорода при нормальных
условиях.
Так как содержание кислорода в атмосферном воздухе по объему равно 21 %, то теоретически необходимый для полного сгорания 1 кг твердого и жидкого топлива объем атмосферного воздуха составляет:
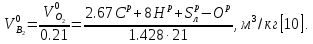
Отсюда с учетом формулы [7] можно получить расчетную формулу для определения теоретически необходимого количества воздуха для сгорания 1 кг твердого и жидкого топлива в виде: