Экзамен ХП шпора
.docx|
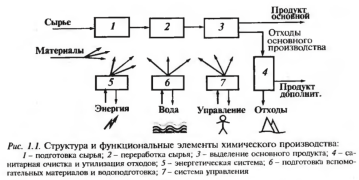
1.Химическое производство. Определение. Состав, компоненты и структура химического производства. Химическое производство- совокупность процессов и операций, осуществляемых в машинах и аппаратах и предназначенных для переработки сырья путем химических превращений в необходимые продукты. Компоненты: Переменные – потребляются или образуются в производстве (сырье, поступающее на переработку; вспомогательные материалы; продукты - основной и дополнительный - как результат переработки сырья; отходы производства; энергия, обеспечивающая функционирование производства). Постоянные компоненты закладываются в производство или участвуют в нем: аппаратура (машины, аппараты, емкости, трубопроводы, арматура); устройства контроля и управления; строительные конструкции (здания); обслуживающий персонал. Состав: химическое производство; хранилища сырья, продуктов и других материалов; транспортировка сырья, продуктов, промеж. веществ, отходов; обслуживающий персонал производственного подразделения; система управления, обеспечения и безопасности.
1-подготовка сырья.2-переработка сырья.3-выделение основного продукта.4-санитарная очистка и утилизация отходов.5-энергетическая система.6-подготовка вспомогательных материалов и водоподготовка.7-система управления 2.Показатели химического производства: технические, экономические, эксплуатационные, социальные. Технические показатели определяют качество химико-технологического процесса. Производительность (мощность) производства – количество получаемого продукта или количество перерабатываемого сырья в единицу времени: П=G/t Расходный коэффициент показывает количество затраченного сырья, материалов или энергии на производство единицы продукта. Выход продукта – отношение полученного количества продукта к максимальному количеству, которое теоретически можно получить из того же сырья. Интенсивность процесса – количество перерабатываемого сырья или получающегося продукта в единице объёма аппарата. Характеризует совершенство организации процесса. Удельные капитальные затраты – затраты на оборудование, отнесенные к единице его производительности. Качество продукта определяет его потребительские свойства и товарную ценность. Определяется ГОСТом, ТУ, сертификатом качества. Экономические показатели определяют экономическую эффективность пр-ва. Себестоимость продукции – суммарные затраты на получение единицы продукта.(сырье, энергия, оплата труда, капитальные затраты на ремонт) Производительность труда – количество продукции, произведённой в ед.времени на рабочего. Хар-ет эффективность производства относительно затрат труда. Эксплуатационные показатели хар-ют изменения, возникающие в х-т процессе и производстве во время их эксплуатации при появлении отклонений от регламент. условий и состояний. Надёжность хар-ют средним временем безаварийной работы либо числом аварийных остановок оборудования или произв-ва в целом за определённый отрезок времени. Безопасность функционирования – вероятность нарушений, приводящих к нанесению вреда или ущерба обсл. персоналу, оборудованию, окр. среде, населению. Чувствительность к нарушениям режима и изменению условий эксплуатации – определяется отношением изменения показателей процесса к этим отклонениям. Управляемость и регулируемость хар—ют возможность поддерживать показатели процесса в допустимых пределах, опр-ют величину допустимых изменений условий процесса, управляющие пар-ры и их взаимовлияние (сложность управления). Социальные показатели определяют комфортность работы на данном производстве и его влияние на окружающую среду. Безвредность обслуживания следует из сопоставления сан-гигиен условий для обслуживающего персонала с соответствующими нормами по загазованности, запыленности, уровню шума. Экологическая безопасность – степень воздействия производства на окр среду и экол обстановку в районе.
|
3.Химическое производство как химико-технологическая система. Элементы и связи в ХТС и их назначение. Химическое производство - совокупность процессов и операций, осуществляемых в машинах и аппаратах и предназначенных для переработки сырья путем химических превращений в необходимые продукты. Система – совокупность элементов и связей между ними, функционирующих как единое целое. Элемент изменяет свойства и состояние входящих в него потоков. Выходящие потоки передаются по связям в другие элементы, в которых происходят их последующие изменения. Система элементов, перерабатывая входящие и выходящие из нее потоки, функционирует как единое целое. В химическом производстве элементы образуют машины и аппараты; связями являются трубо, газо- и паропроводы. В элементах происходит разделение, смешение, сжатие, нагрев, химические превращения и прочее, а по связям материальные, тепловые, энергетические потоки передаются из одного элемента в другой. Это позволяет представлять химическое производство как химико-технологическую систему. Химико-технологическая система (ХТС) – совокупность устройств (элементов) и потоков (связей) между ними, функционирующая как единое целое и предназначенная для переработки исходных веществ (сырья) в продукты. Элемент ХТС может быть представлен отдельным аппаратом (реактором, смесителем, абсорбером, теплообменником, турбиной и т.д.) или их совокупностью. 4.Функциональные и масштабные подсистемы. Функциональные подсистемы обеспечивают выполнение функций производства и его функционирование в целом. Технологическая подсистема – часть производства, где осуществляется переработка сырья в продукты – химико-технологический процесс. Энергетическая подсистема – часть производства, служащая для обеспечения энергией химико-технологического процесса. Подсистема управления – часть производства, с помощью которой осуществляется получение информации о его функц-ии и упр-ии. Обычно это автомат система упр техн процессом (АСУТП). Масштабные подсистемы выполняют определенные функции в последовательности процессов переработки сырья в продукты как отдельные части химико-технологического процесса. Их можно систематизировать в виде их иерархической последовательности.
5.Элементы ХТС. Их классификация. Элементы и классификация: 1)Механические и гидромеханические: подготовка сырья (измельчение, флотация), объединение (разделение) потоков: дробилки, грануляторы, смесители, насосы, фильтры и т.д. 2)Теплообменные: изменяют температуру и теплосодержание потоков: теплообменники, испарители, конденсаторы. 3) Массообменные: изменяют состав потока: адсорберы, абсорберы, ректификационные колонны. 4) Энергетические: преобразование энергии в энергоносители: газовые, тепловые турбины, котлы. 5) Элементы контроля и управления: предназначены для управления на производстве: датчики, выключатели, вентили. 7.Модели ХТС. Описательные модели ХТС на примере производства аммиака. Описательные модели: 1) химическая схема; 2) операционная схема; 3) математическая модель. Химическая схема – последовательность превращений исходных веществ в продукты; описывается стехиометрическими уравнениями. Синтез аммиака из водорода и азота представлен одним химическим уравнением: 3H2+N2=2NH3 Производство аммиака из природного газа (метана) требует проведения нескольких химических реакций: СH4 + H2О = CO + 3H2 –конверсия метана с водяным паром, CO + H2О = CO2 + H2 – конверсия оксида углерода, 3H2 + N2 = 2NH3 – синтез аммиака. Операционная – описывает основные стадии переработки сырья. 1) Очистка природного газа от серосодержащих соединений адсорбцией сероводорода. H2S+ZnO=ZnS+H2O 2) Конверсия метана с водяным паром. 3) Конверсия оксида углерода с водяным паром. 4) Получение азота. 3O2+2CH4=2CO+4H2O 5) Абсорбция диоксида углерода. CO2+2RNH2+H2O=(RNH3)2CO3 6) Очистка газа после конверсии от оксида углерода СО. CO+3H2=CH4+H2O 7) Синтез аммиака 3. Математическая модель – показывает количественные характеристики ХТС. Система алгебраических и дифференциальных уравнений, которые решаются одновременно. Устанавливает зависимость параметров выходящих потоков от входящих, а также параметров аппаратов. YВЫХ = f(xВХ; параметры ап.) Удобно использовать те математические модели, которые основываются на законах сохранения массы и энергии.
|
6.Классификация связей ХТС. Структура связей ХТС и их назначение. Классификация: потоки между аппаратами (связи между элементами) классифицируют по их содержанию. Материальные потоки переносят вещества и материалы по трубопроводам различного назначения, транспортерами и др механическими устройствами. Энергетические потоки переносят энергию в любом ее проявлении – тепловую и топливо (пар, горячие потоки, горючие газы и жидкости по трубопроводам), механическую (газы под давлением через трубопровод), электрическую (провода, силовые кабели). Информационные потоки используются в системах контроля и управления процессами и производством. Используются эл провода и тонкие капиллярные трубки в пневматических системах. Структура связей. Последовательность прохождения потоков через элементы ХТС определяет стр-ру связей и обеспечивает необходимые условия работы элементов системы
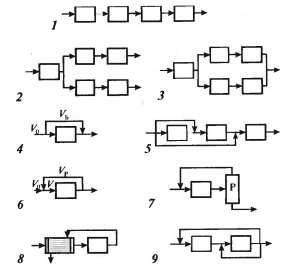
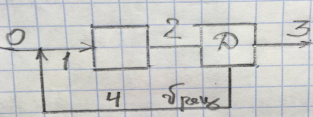
Последовательная связь (рис 1) поток проходит аппараты поочерёдно. Применение: последовательная переработка сырья в различных операциях, более полная переработка сырья последовательными воздействиями Разветвлённая (рис 2). После некоторой операции поток разветвляется и далее отдельные потоки перерабатываются различными способами. Используется для получения разных продуктов Параллельная (рис 3). Поток разветвляется, проходят через разные аппараты, после чего объединяются. Исп-ют для периодических стадий в непрерывном. Еще одно назначение – резервирование на случай выхода из строя одного из аппаратов («холодное» резервирование). Обводная связь, или байпас (рис 4 - простой и 5 - сложный). Часть потока, не поступая в аппарат, обходит его. Поддерживают необходимые t потоков байпасированием их мимо теплообменника. Байпас β опр-ют как долю основного потока. Проходящего мимо аппарата: β=Vб/V0. Обратная связь, или рецикл (рис 6-9).часть потока после одного из аппаратов возвращается в предыдущий. Такую схему исп-ют для повышения интенсивности радикально – цепной реакции подачей на вход части исходного потока, содержащего активные радикалы. 8.Графические модели ХТС на примере производства аммиака. Функциональная модель (схема) строится на основе химической и операционной и наглядно отражает основные стадии химико-технологического процесса и их взаимосвязь.
Представление основных операций химико-технологического процесса в виде функциональной схемы весьма удобно для его понимания. Она дает общее представление о функционировании ХТС и служит предпосылкой для аппаратурного оформления и более детальной разработки ХТС. Приведем еще пример функциональной схемы – синтез аммиака, т.е. рассмотрим подсистему 7 в производстве аммиака как ХТС. Реакция водорода с азотом вследствие обратимости протекает не полностью, поэтому синтез аммиака включает три стадии и представлен следующей операционной моделью. А.
Синтез аммиака
Б. Выделение аммиака. В. Возврат (рецикл) непрореагировавших водорода и азота в реактор ( на стадию А).
Технологическая модель (схема) показывает элементы системы, порядок их соединения и последовательность технологических операций. Нередко расположение аппаратов соответствует их примерной расстановке на цехе. На технологической схеме могут быть приведены краткие данные о параметрах процесса. Технологическую схему получают в результате научной разработки данного способа производства, технологической и конструктивной проработки схем, узлов и аппаратов. Технологические схемы используют как при эксплуатации производства, так и при его проектировании. Она входит в проектную и техническую документацию каждого производства. Структурная модель (схема) в отличие от технологической включает элементы ХТС в виде простых геометрических фигур (прямоугольников, кругов). Изображение аппаратов обезличено, но это значительно упрощает общий вид структуры ХТС. Специальные схемы применяют при анализе и расчетах ХТС, используя специальный математический аппарат и вычислительные методы. В операторной схеме каждый элемент представлен специальным обозначением, называемым «технологический оператор». Они помогают распознать по схеме, какие преобразования (операции) происходят с потоком в элементе. |
9.Состояние ХТС. Параметры состояния и параметры свойств потоков, параметры состояния элементов ХТС. Расчет ХТС. Состояние или режим ХТС определяется параметрами потоков (связей) и состоянием аппаратов (элементов). Параметры потоков – химические, физико-химические и физические данные о потоке. К ним относятся: - параметры состояния: количество потока между элементами в единицу времени (расход), фазовый состав, химический состав, Т, Р, теплосодержание; - параметры свойств: теплоемкость, , и др. Для описания энергетических и информационных потоков используются свои показатели: напряжение, сила тока, интенсивность управляющего сигнала и др. Состояние элемента включают данные, от которых зависит изменение показателей потока в элементе. - регулирующие воздействия: температура хладагента, отводящего теплоту из реактора или подача пара в паровую турбину; - изменяемые при эксплуатации характеристики аппарата и условия процесса в нем: изменение условий процесса в реакторе Расчет ХТС – определение параметров потоков в ХТС заданной структуры и с заданным состоянием ее элементов. При любых изменениях состояния потоков в элементе, подсистеме или ХТС в целом должны соблюдаться законы сохранения массы и энергии.
Т.о, расчет ХТС представляет собой установление балансов массы и теплоты для всех его элементов с учетом связей между ними. Такой расчет называют балансовым, различая материальный баланс и тепловой. 10. Материальный и тепловой баланс. Последовательность расчета ХТС с различной структурой. Формы представления балансов. Материальный баланс - выражение закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса вещества, вступившего во взаимодействие, равно массе веществ, образующихся в результате этого взаимодействия, т.е. приход вещества равен его расходу. Тепловой баланс – составляют по данным материального баланса с учетом тепловых эффектов химических реакций и физических превращений, протекающих в аппарате, а также с учетом подвода тепла извне и отвода ее с продуктами реакций, а также потери в окружающую среду через стенки аппарата. Последовательность расчета ХТС с различной структурой: 1) Линейная (прямоточная): Расчет состояния системы осуществляется последовательно от элемента к элементу по мере движения потока. Расчет состояния системы осуществляется последовательно от элемента к элементу по мере движения потока. Разветвленная ХТС, параллельное соединение, байпасировние-обводная линия – рассчитываются также.
Состояние потока «0» на входе в ХТС известно, состояние «1» определяется и затем последовательно считаются состояния потоков по нижней ветви и верхней. 2) Схема с рециклом:
Такую структуру рассчитать последовательно нельзя, так как на поток, входящий в элемент, влияет поток рециркулирующий. Связь «4» разрывают и представляют такую структуру в виде:
Значение v’’рецзадают и считают схему как последовательную. V’рец =v’’рец– расчёт сводится к такому условию. Если значение не совпадают, то задают еще v’’реци повторяют расчет. Решается на ЭВМ. Формы представления балансов: 1) Табличная 2) Графическая Gвх=Gвых – условие сходимости балансов Vвх≠Vвых Ошибка в 3% при технических расчётах возникает вследствие округления величин.
|
|
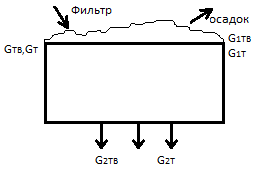
11.Материальный баланс элемента ХТС без химического превращения. Материальный баланс сложного делителя. Ни величина потока, проходящего через такой элемент, ни количество компонентов в потоке меняться не будут, и GВХ= GВЫХ, Gi,ВХ= G i,ВЫХ. При рассмотрении только материального баланса такие элементы можно не включать в ХТС. Делитель сложный распределяет компоненты между потоками. Мат баланс фильтра: G1,ТВ= GТВ; G1,Т= gGTB. G2,TВ= 0; G2,T= GT - gGTB (g=кг т/кг тв) αm-коэф.распределения жидкости(кол-во влаги в остатке/кол-во влаги на входе = gGTB/GT)
12. Тепловой баланс ХТС. Q = ∆U + A , где ∆U – изменение внутренней энергии, А – работа против внешних сил ∆ U = U2 – U1 A
=
Q = U2 – U1 + pV2 – pV1; H = U+ PV Q = (U2 + pV2) – (U1 + pV1) = H2-H1 = Hвых – Hвх Энтальпия на входе/ выходе системы считается по всем компонентам потока, учитывая превращения Запись теплового баланса по температурам Сp
=
Q
= HВЫХ
– HВХ
= HT–
HT0
=
Cp – дифференциальная (неудобно) Cp = a + bT-1 + cT-2–среднеинтегральная (+)
Qнагрева
от Т0 до Т: Qнагр
= Температура потока ХТС изменяется вследствие внутренних источников теплоты (протекание хим. р-ии), при этом Qp (тепловой эффект р-ии) –изменение энтальпии потока за счет изменения состава реакционной смеси. Если при протекании р-ии происходит изменение состава смеси, то выделяющееся тепло идет на нагрев реакционной смеси. (Qp = Qнагрева) Cp – величина аддитивная, рассчитывается как сумма ком-ов потока. Для технических расчетов принимают, что в заданных интервалах Т величин Cp = const. Qвх = Gвх∙Cp∙T0 Qист = Giвх∙Qpxi Qвых=Gвых∙Cp∙T ∑Qвх - ∑Qвых + ∑Qист = 0
13.Эффективность использования материальных и энергетических ресурсов. Материальные ресурсы: Расходный коэффициент – количество затраченного сырья (энергии, вспомогательных материалов) на производство единицы продукции. Различают теор коэф-т, определяемый из стехиометрического уравнения р-ции обр-ия прод-та из исх в-в при полном их превращении, и практический, т.е. реально используемый в производстве. Их отношение показывает степень использования сырья. Расходный коэффициент = кол-во затраченного сырья/ кол-во продукции; степень использования =теор расходный коэф-т/практ расходный коэф-т Основные причины различия теоретического и реального расх коэф-тов: неполнота превращения исх в-ва в продукт; обр-ие побочных в-в; неполнота выделения пр-та; потери промежуточных комп-тов и продукта; наличие примесей в сырье, не идущих на обр-ие прод-та; использование части сырья на вспомогательные цели.
Энергетические ресурсы: Тепловой КПД. Источниками энергии яв-ся входящие потоки, несущие энергию топлива Qтопл, электроэнергию Qэл, тепло сырья Qсыр и вспом мат-лов Qмат, а также экзотермич р-ции Qэкз. Их суммарное потребление – Qзатр. Из системы выводится энергия с потоками пр-тов Qпрод и отходов Qотх, с энергетическими потоками – Qэн, затрачивается на проведение эндотермич р-ций – Qэнд и теряется естественным путём – Qпот. Из выходящих эн потоков полезно используется Qэн в виде пара котлов – утилизаторов, нагреваемых в теплообменниках-утилизаторах внешних потоков, энергии турбин и электрогенераторов. Энергетическую эффективность ХТС хар-ют тепловым КПД: ηтепл= Qэн/Qзатр Но если эн потоки используются внутри системы, покрывая часть расходов, т.е Qэн=0, то КПД=0 и если эн потоки исп-ся полностью для выработки энергии, то КПД<100% (есть другие потоки, выводящее энергию из ХТС). Это нелогично, поэтому тепловой КПД представляют как отношение полезно затраченного тепла к его суммарному кол-ву, введенному в ХТС.
|
14. Свойства ХТС: 1)Зависимость режима одного аппарата (элемента) от режима других. 2) Усовершенствование одного узла (элемента) улучшает эффективность ХТС в целом за счет выигрыша в другом узле системы. 3) Оптимальные режимы отдельно взятого элемента и функционирующего в системе могут различаться. 4) Неоднозначность режимов и их устойчивость Оптимальные
режимы отдельно взятого элемента и
функционирующего в системе могут
различаться. Рассмотрим
ХТС, состоящую из реактора и системы
разделения (рис а), для которой заданы
производительность П и С0.
Величина З слагается из капитальных
затрат и расходов на сырье:
Одиночный
реактор.
Затраты на этот аппарат зависят от
его объема. Предположим, что процесс,
представляющий реакцию первого
порядка, осуществляется в режиме
идеального смешения. Тогда из
математического описания:
Полагаем,
что стоимость реактора пропорциональна
его объему:
Реактор
в системе.
К затратам на реактор из выражения
(5.41) добавляются затраты на разделение
ЗД.
Положим, что они пропорциональны
количеству примесей к продукту, т.е.
количеству непрореагировавшего сырья
V0C0(1-x).
Не усложняя расчетную формулу, для
выражения ЗД
примем простейший вариант: ЗД=D(1-х),
где D
включает постоянные в расчете ЗД.
Тогда затраты на систему
К затратам на реактор добавляются затраты на разделение (прямая штриховая линия на рис.б), и оптимальная степень превращения хХТС становится отличной от хР. В данном случае хХТС> хР. Рассмотренное свойство ХТС также обусловлено взаимодействием ее элементов. 18. Энергия в химической технологии. Виды энергии. В хим.производствах протекают процессы с выделением энергии или затратой, или с взаимными превращениями и переходами. Энергия затрачивается на подготовку сырья, осуществление хим.превращений, выделение продуктов, транспортировку материалов, сжатие газа и т.д. Виды энергии: Тепловая энергия применяется для осуществления нагрева, плавления, сушки, выпаривания, дистилляции, тепловой десорбции, эндотермических превращений.(энергия получена за счет сжигания твердого, жидкого, газообразного топлива); Электрическая энергия применяется для электрохимических, электротермических, электромагнитных процессов. Широко используется превращение электрической энергии в механическую в электроприводах различных машин и мех.устройств; Световая энергия применяется для превращения в электрическую (фотоэлектрические явления, которые применяют для автоматического контроля и управления технологическими процессами). Энергия Излучения и атомных превращений для проведения радиационно-химических превращений и ядерно-химических реакций.
|
15. Существование режимов ХТС. Химико-технологический процесс характеризуют рядом показателей функционирования ХТС в целом и иногда у системы появляются свойства, не присущие ее элементам.
Обозначим
τ0=νр/V0
как условное время в реакторе для
свежей смеси и найдем
16. Неоднозначность режимов и их устойчивость. Объясняется существованием обратных связей по теплу и влиянием выходящих потоков на входящие:
Продиф-ем по Твх:
Применяется для всех т/о. Чтобы условие выполнялось необходимо снизить интенсивность обратной связи.
|
17. Сырье в химической технологии. Виды сырья. Сырьё – природные материалы, используемые в производстве пром продуктов. Сырьё классифицируют по происхождению – минеральное, растительное, животное; по запасам – возобновимое и невозобновимое; по хим составу – неорганическое, органическое; по агрегатному состоянию – тв, жид, г/о. Минеральное сырьё – добываемые из земных недр полезные ископаемые. Рудное мин сырьё – горные породы, из кот получают металлы. Наряду с металлами при переработке руды получают хим пр-ты(получение H2SO4 при пр-ве Cu, Zn). Нерудное мин сырьё – горные породы, исп-ые в произв-ве хим, строительных др неметаллических мат-лов и не являющиеся исх мат-лом для пр-ва металлов (галит-NaCl в производстве каустической соды NaOH и хлора, пирит FeS2 и S2 в п-ве H2SO4 ). Горючее мин сырье содерж в своем составе C – это угли, нефть, горючие сланцы, ПГ. Служат источниками тепловой энергии. Растительное сырьё – древесина, хлопок, лен, отходы первичной переработки с/х продукции; животное – шерсть, жиры, отходы первич переработки. Растительное перерабатывают так: используют его высокомолекулярные компоненты (пр-во пластмасс, волокон), пиролиз с обр-ем г/о и жид пр-тов (CO, CO2, H2, масляные фракции), каталитическое расщепление полимерных компонентов с обр-ием орг пр-тов (этанол, фурфурол, фенолы) Также следует выделить воздух и воду. Азот воздуха исп-ют для пр-ва NH3, кислород – в окислительных процессах; вода – для получения к-т и щелочей, для приготовления р-ров, как абсорбент при очистке газов. Невозобновимые – селитра как источник чистого азота, почти исчерпана. Полупродукты – вещества и мат-лы, являющиеся исходными в производстве продуктов и полученные из природного сырья в другом пр-ве (аммиак в пр-ве азотной к-ты и бензол в синтезе алкилбензолов). Масла из растит сырья исп-ют в пр-ве мыла, лаков и красок. Вторичное сырьё – используемые в производстве в-ва и мат-лы, являющиеся невостребованными в других производствах. Используют отходы производства и отходы потребления. Пути использования: 1) извлечение, регенерация непрореагировавшего сырья и мат-лов и возврат их в пр-во 2) извлечение ценных комп-тов как продуктов производства 3)выделение компонентов и придание им товарной ценности 4) использование отходов как исх в-в в других производствах и отраслях промышленности. 19. Вторичные энергоресурсы в химической технологии. Виды ВЭР и их использование. Вторичные энергетические ресурсы (ВЭР) – энергетический потенциал продукции, отходов, дополнительных и промежуточных продуктов, который образуется в технологических агрегатах и не используется в этом же производстве, но может быть частично или полностью применен для энергосбережения других производств. 1. Горючие (топливные) ВЭР – это топливные вторичные продукты, отходы, которые в своем составе содержат H2, CO и др. газы. Пример: котельно-печное топливо, которое добавляют к основному в мартеновских печах. 2. Тепловые – это материальные потоки с высокой температурой, которые используют на предприятиях. Энергия отходящих газов, жидкостей, пар из котлов-утилизаторов. (Низкопотенциальные, Высокопотенциальные). 3.Силовые (ВЭР избыточного давления) -газы, жидкости под высоким давлением. Используются для выработки электроэнергии в турбинах для приводов, аппаратов машин. 28. Выбор реактора или системы реакторов при проведении обратимой экзотермической реакции в адиабатическом режиме.
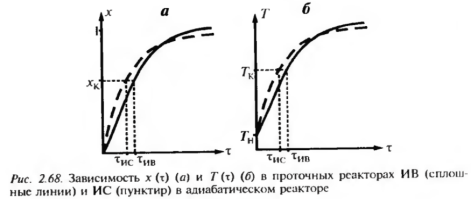
В РИС процесс протекает при конечных условиях (С, Т), а в РИВ условия меняются от начальных до конечных. Поэтому в режиме ИВ средняя концентрация исходных веществ больше, а средняя температура – меньше. Температурное влияние на скорость превращения положительное и более сильное, чем отрицательное влияние концентрации. Пусть ТН=500К, ΔТад=200град, х=0,5. Средние условия протекания процесса в режиме ИВ: х = 0,25, Т=ТН+ ΔТадх=550К. В режиме ИС: х=0,5, Т=600 К. Скорость реакции, пропорциональная 1-х, в режиме ИВ будет в 1,5 раза выше, чем в режиме ИС. Но разница в температурах в 50 градусов дает выигрыш в скорости реакции для режима ИС примерно в 4 раза, что превышает «концентрационные» потери. Режим ИС более интенсивен, чем режим ИВ-для достижения одинаковой степени превращения условное время процесса в реакторе ИС меньше. Только при достаточно больших степенях превращения, когда влияние концентрационного фактора будет превалирующим, процесс в режиме ИС будет менее интенсивен. |
|
20.Синтез ХТС. Концепция полного использования сырьевых ресурсов. Примеры ее реализации. Синтез или построение ХТС заключается в определении основных технологических операций и их последовательности, выборе аппаратов и установлении связей между ними, определении параметров технологических режимов отдельных аппаратов и системы в целом обеспечивающих наилучшие условия функционирования ХТС. Концепция полного использования сырьевых продуктов направлена на максимальное превращение сырья в используемые, полезные продукты. 1)Выбор процесса – важнейший способ улучшения использования сырьевых ресурсов. Пример – получение хлорвинила. Хлорвинил получают в две стадии. Сначала хлорируют этилен, а затее проводят пиролиз образовавшегося дихлорэтана: CH2CH2+Cl2=ClCH2CH2Cl = CH2CHCl. Избирательность каждой из стадий около 95%. Образующийся HCl относят к отходам. Выход хлорвинила по этилену составляет 90%. Перейдя к одностадийной схеме, описываемой уравнением CH2CH2+HCl+O2=CH2CHCl+H2O с избирательностью 95%, удалось разработать процесс с 95%-ным выходом продукта по обоим исходным компонентам. 2)Избыток одного из реагентов, как правило, более дешевого и доступного, а также возможность его возвращения в процесс также приводит к улучшению использования сырьевых ресурсов. В данном случае используют два фактора влияния избытка реагента на увеличение выхода продукта. а. Термодинамический фактор, когда избыток одного реагента увеличивает максимальное, равновесное превращение другого. В паровой конверсии метана стехиометрическое соотношение реагентов СH4:H2O = 1:1. В промышленных условиях хр значения 0,58. При соотношении СH4:H2O = 1:4 хр=0,92. б. Кинетический фактор связан с особенностями механизма и кинетики протекающего процесса. В реакции окисления аммиака 4NH3+5O2 = 4NO+6H2O стехиометрическое соотношение реагентов O2:NH3 = 1,25. смесь аммиака с воздухом будет содержать 14% NH3 и 17,5% О2. СNH3 = 14(1-0,99) = 0,14%, СО2 =17,5 -1,25(14*0,99)= 0,17% и в этих условиях аммиак окисляется в основном до азота. Необходим избыток кислорода, вытесняющий аммиак с поверхности катализатора, тогда окисление будет протекать преимущественно до NO. Если же использовать соотношение O2:NH3 = 1,8, т.е. в аммиачно-воздушной смеси будет содержаться 10% аммиака и 18% кислорода, то концентрации реагентов будут другими: СNH3 = 10(1-0,99) = 0,1%, СО2=18-1,25(10*0,99)= 5,6%. Концентрация кислорода у поверхности на два порядка превысит концентрацию аммиака, что и обеспечит избирательное окисление аммиака. Именно это и определяет 10%-ное содержание аммиака в аммиачно-воздушной смеси. 3)Противоточный контакт фаз – известное решение, обеспечивающее максимальную движущую силу процесса переноса, широко распространенным примером которого является противоточная организация движения теплоносителей в теплообменнике. Другой пример – абсорбция оксидов азота. 4)Фракционный рецикл используют при неполном превращении исходных реагентов. В системе разделения, расположенной после реактора, непрореагировавшие реагенты выделяют и возвращают на переработку. 5)Регенерация с рециклом заключается в регенерации вспомогательного материала после его использования с последующим возвращением в процесс. 6)Утилизация отходов позволяет получить дополнительные полезные продукты из побочных продуктов реакции, практически всегда образуемых вместе с целевым продуктом, а также из непрореагировавших исходных веществ и их примесей, имеющихся в сырье. 7) Альтернативное сырье. Одним из направлений расширения сырьевых источников является использование отходов других производств, а другим – поиск альтернативных источников первичного сырья. Уголь является наиболее распространенным углеродосодержащим полезным ископаемым. Известны методы превращения угля в жидкие углеводороды и топливо.
|
21. Концепция полного использования энергетических ресурсов. Примеры ее реализации. Концепция полного использования энергоресурсов направлена на минимизацию энергетических и тепловых затрат, на полное использование их в процессе. Регенерация тепла и энергии. Если необходимо нагреть поток, а потом охладить, можно Входящий
нагреть теплом выходящего. Это вид
циркуляционн. схемы распространенный
в промышленности. Наиболее эффективна
схема при экзотермич р-ции. При
гидродеалкилировании толуола с
максимальной регенерацией тепла
горячее газы после реактора используются
в кипятильниках колонн разделения и
подогрева реакционной смеси.
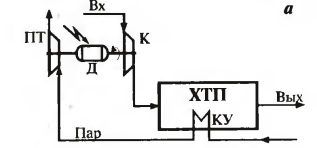
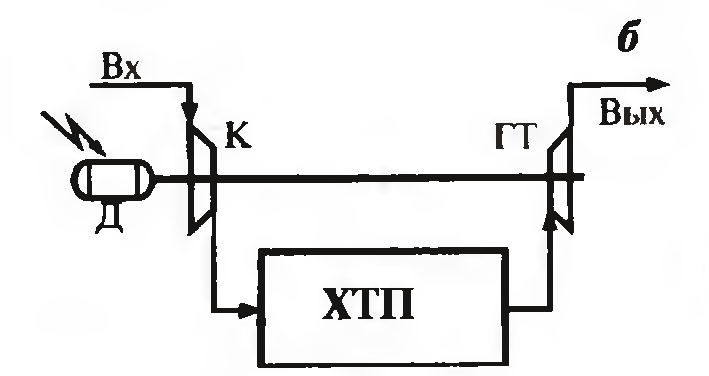
Тепло мб использовано для получения пара в котле-утилизаторе; пар затем используется как энергоноситель для привода паровых турбин того же пр-ва (рис1 а) или как теплоноситель в технологических целях.
Регенерацию энергии осущ-ют в процессах под давлением. Исходный газ сжимается в компрессоре и направляется в технологические аппараты. Оставшийся сжатый газ направляется в газовую турбину, находящуюся на одном валу с компрессором (рис 1б). расходы энергии для привода компрссора таким образом уменьшатся. Утилизация тепла и энергии – тепло или энергия потока исп-ся для выработки тепловых, электрических и др энергоресурсов, применяемых не в самом произв-ве. Большая часть энергии на произв-ве остается в виде энергии технологических потоков, энергия может выделяться при протекани экотермич р-ций. Тепловую энергию потоков можно использовать, вырабатывая пар в котлах-утилизаторах(рис 2 а).энергию давления можно исп-ть для привода эл-генератора (рис 2б)
К – компрессор, Д-основной эектропривод, ГТ и ПТ – газ и пар турбины, КУ-котел-утилизатор, Г-генератор Альтернативные источники энергии – тепло, вырабатываемое атомными котлами, солнечная энергия Замена хмической схемы получения продукта – переход к процессу с меньшим числом стадий (сокращает число нагревов/охлаждений потоков, затраты на преодоление гидравлического сопротивления). Пример: бутанбутен-1-бутадиен-1,3 (дивинил). Обе р-ции эндотермические, каталитические, протекают с увеличением объема при высоких t и при атм давлении или вакууме. Двухстадийное получение дивинила дает высокий выход (65%), но необходимо разделять газовые смеси после каждой ступени, капитало- и энергозатратно. Одностадийное дегидрирование н-бутана: реакции протекают одновременно на катализаторе, который быстро дезактивируется. Дегидриррование проводят под вакуумом при t=580-6000C в адиабатических реакторах регенеративного типа, циклы дегидрирования и регенерации чередуются. Рабочий цикл катализатора – несколько минут. Теплота, выделяемая при регенерации катализавтора, аккумулируется им и используется при дегидрировании. Это экономит тепло. Число циклически работающих реакторов – 5-8. Переключение потоков автоматическое, следоватеьно, поток исх в-в и продуктов непрерывный
|
22. Концепция минимизации отходов. Примеры ее реализации. Отходы химического производства. Безотходные и малоотходные производства. Концепция минимизации отходов направлена на защиту окружающей среды и связана с экологической обстановкой региона и с санитарно-гигиеническими условиями для обслуживающего персонала. Основные приемы по реализации данной концепции связаны с полным использованием сырьевых и материальных ресурсов и полным использованием энергетических ресурсов. Санитарная очистка и обезвреживание выбросов предполагают установку подсистем ХТС, цель которых заключается в удалении вредных примесей из выводимых из производства потоков или их переводе в нетоксичное состояние. Отходы можно сбрасывать, если содержание примесей меньше допустимой нормы по их вредному воздействию на окружающую среду. Уменьшение и замена вспомогательных потоков. Например, водяные холодильники целесообразно заменить на воздушные для охлаждения до температуры окружающей среды, т.к. водяные подвержены коррозии, что может привести к аварийным ситуациям, также нерационально утилизировать теплоту чуть теплой воды. Замкнутый водооборот позволяет избежать одного из отходов – загрязненной воды. Повышение надежности оборудования и элементов ХТС помогает исключить потери в виде утечек и выбросов любых компонентов. Основные источники такого рода потерь: разрушение конструктивных элементов путем силового воздействия, коррозионное разрушение, нарушение целостности стыковочных деталей. Предотвращение: использование совершенных конструкций; подбор соответствующих конструкционных материалов, устойчивых к имеющимся воздействиям; технологическая дисциплина процесса; регулярных профилактический осмотр и ремонт; прогнозирование нарушений. Безотходное и малоотходное производства. Безотходная технология – способ производства продукции, при котором сырье, материалы, энергия используется наиболее рационально и комплексно, и любые воздействия на окружающую среду не нарушают ее нормальное функционирование. Малоотходным производством считается такое, при котором вредное воздействие на окружающую среду не превышает уровня, допустимого санитарно-гигиеническими нормами. 23. Концепция оптимального использования оборудования. Примеры ее реализации. Концепция оптимального оборудования направлена на минимизацию капитальных затрат на технологическое оборудование путём создания условий протекания в нём процессов с максимально возможной интенсивностью. 1) Выбор процесса более интенсивного, протекающего с большей скоростью. Например, переход от алюмосиликатного катализатора гидрокрекинга углеводородов на цеолитные, что явилось причиной повышения скорости процесса более чем в 300 раз. 2) Оптимизация процесса- приём увеличения его интенсивности. 3) Организация процесса в аппарате. Почти всегда один и тот же процесс можно провести разными способами. Но какой-то при тех или иных условиях будет выгоднее. Еще одним пример является сокращение затрат на теплообменнике - использование противотока теплоносителя. 4) Организация технологического процесса в подсистеме ХТС. Такой подход основан на одном из свойств ХТС – усовершенствование одного элемента приводит к выигрышу в эффективности процесса в системе в целом. Это особенно наглядно на замене периодического процесса на непрерывный. В первом случае нужна доп аппаратура для накопления исх компонентов и продуктов Включим в систему узел сжигания топлива:
Он вносит дополнительные затраты в систему очистки, но дополнительный нагрев позволяет, во-первых, поддерживать постоянную и желаемую разность температур в теплообменнике и, во-вторых, уменьшить затраты на оборудования ХТС. 5) Конструктивные решения аппаратов, позволяющие уменьшить объемы его непроизводительных частей. Последние создают необходимые условия протекания процесса: распределение потоков, обеспечение жёсткости конструкции, удобство монтажа. 6) Увеличение единицы мощности.
|
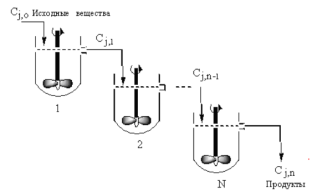
24.Однородные ХТС. Каскад РИС. Аналитический метод расчета каскада РИС. Однородные ХТС – это ХТС, состоящие из элементов одного рода ( смешение, вытеснение) Каскад представляет собой несколько последовательно соединенных проточных реакторов идеального смешения. В единичном реакторе идеального смешения из-за того, что концентрация реагентов мгновенно снижается до конечной величины, скорость реакции при большой степени превращения невелика. Поэтому очень часто применяют ряд последовательно расположенных РИС. Концентрация исходного реагента в такой системе снижается до конечного значения не сразу, а постепенно от реактора к реактору.
Для простых необр.р-ий 1 порядка:
Для
2-го порядка
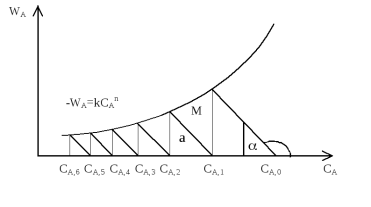
25.Графический метод расчета каскада РИС. В
основе расчета лежит уравнение
Концентрация
реагента на входе в m-1
реактор и время пребывания τ –величины
постоянные и известные, так как они
задаются по условию. Таким образом,
зависимость
|



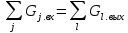
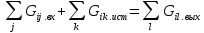


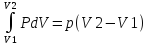 = const
= const
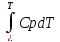
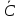 p
=
p
=
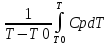
 p
(T-T0)
p
(T-T0)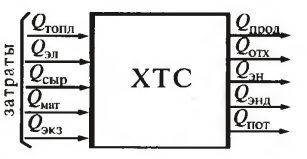
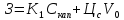 ,(5.40)
где Скап
– стоимость капитальных вложений (на
оборудование); ЦС
- стоимость единицы сырья; V0
– расход сырья; К1
– коэффициент окупаемости, показывающий
долю стоимости оборудования. Полагая,
что срок службы оборудования 5 лет,
К1=0.2
,(5.40)
где Скап
– стоимость капитальных вложений (на
оборудование); ЦС
- стоимость единицы сырья; V0
– расход сырья; К1
– коэффициент окупаемости, показывающий
долю стоимости оборудования. Полагая,
что срок службы оборудования 5 лет,
К1=0.2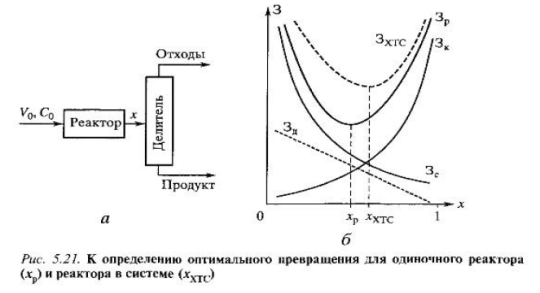
 Производительность
П определяется: П=V0C0х,
откуда V0=П/С0х
Производительность
П определяется: П=V0C0х,
откуда V0=П/С0х ,
получим
,
получим
 и объем реактора
и объем реактора
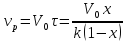
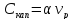 ,
где α – коэфф
пропорц.
Подставляя
выражения для V0
и vр
в выражение
(5.40), приведем последнее к зависимости
от х. Таким образом, затраты на процесс
в одиночном реакторе Зр
будут складываться из двух слагаемых:
,
где α – коэфф
пропорц.
Подставляя
выражения для V0
и vр
в выражение
(5.40), приведем последнее к зависимости
от х. Таким образом, затраты на процесс
в одиночном реакторе Зр
будут складываться из двух слагаемых:
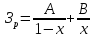 (5.41) Здесь
в коэффициенты А и В включены все
постоянные (k,
α,С0,
V0,
K1
и др.). Первое слагаемое в уравнении
(5.41), включает капитальные затраты на
реактор Зк,
которые возрастают с увеличением
степени превращения: чем больше х, тем
больше объем реактора и затраты на
него. Второе слагаемое включает затраты
на сырье Зс.
Чем больше х, тем полнее используется
сырье и меньше затраты на него.
Зависимости ЗК,
ЗС
и ЗР
от х показаны на рис. б сплошными
линиями. Видно существование некой
степени превращение хР,
при которой затраты на единичный
реактор минимальны.
(5.41) Здесь
в коэффициенты А и В включены все
постоянные (k,
α,С0,
V0,
K1
и др.). Первое слагаемое в уравнении
(5.41), включает капитальные затраты на
реактор Зк,
которые возрастают с увеличением
степени превращения: чем больше х, тем
больше объем реактора и затраты на
него. Второе слагаемое включает затраты
на сырье Зс.
Чем больше х, тем полнее используется
сырье и меньше затраты на него.
Зависимости ЗК,
ЗС
и ЗР
от х показаны на рис. б сплошными
линиями. Видно существование некой
степени превращение хР,
при которой затраты на единичный
реактор минимальны.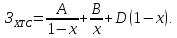
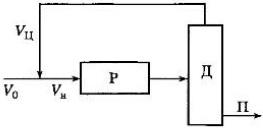 Обратная
связь в ХТС может быть причиной
неосуществимости в некоторых системах
устойчивых режимов. Это свойство ХТС
характерно для схемы с фракционным
рециклом, состоящим из реактора и
аппарата выделения продукта. Допустим,
в систему подается только исходное
вещество V0.
В РИС протекает реакция первого порядка
со степенью превращения исходного
вещества х, т.е. концентрация в реакторе
и на входе С=С0(1-х).
После выхода из реактора продукты
полностью отделяются, а непрореагировавшее
исходное вещество в количестве Vц
возвращается обратно, так что общее
количество вещества на входе в реактор
Vн=V0+Vц.
Процесс в реакторе описывается
уравнением
Обратная
связь в ХТС может быть причиной
неосуществимости в некоторых системах
устойчивых режимов. Это свойство ХТС
характерно для схемы с фракционным
рециклом, состоящим из реактора и
аппарата выделения продукта. Допустим,
в систему подается только исходное
вещество V0.
В РИС протекает реакция первого порядка
со степенью превращения исходного
вещества х, т.е. концентрация в реакторе
и на входе С=С0(1-х).
После выхода из реактора продукты
полностью отделяются, а непрореагировавшее
исходное вещество в количестве Vц
возвращается обратно, так что общее
количество вещества на входе в реактор
Vн=V0+Vц.
Процесс в реакторе описывается
уравнением
 .
Поскольку на вход реактора подается
только исходное вещество, т.е. С0=1,
то
.
Поскольку на вход реактора подается
только исходное вещество, т.е. С0=1,
то
 .После
отделения продукта рециркулирующий
поток Vц=Vн(1-х)
и Vн=V0+Vц=V0+Vн(1-х)
или Vн=V0/х.
Следовательно
.После
отделения продукта рециркулирующий
поток Vц=Vн(1-х)
и Vн=V0+Vц=V0+Vн(1-х)
или Vн=V0/х.
Следовательно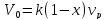 .
.
 .
Результат будет иметь смысл, т.е. х>0,
если kτ0>1.
можно выбрать такую температуру, т.е.
значение k,
или такое τ0,
что приведет к kτ0<1,
но тогда получится отрицательная (х),
что невозможно. Для объяснения этого
рассмотрим эту же систему без рецикла.
При заданных условиях (k
и τ0)
в реакторе уст-ся некоторое значение
х. добавим к реактору колонну разделения
и непрореагировавший компонент вернем
в реактор, что приведет к увеличению
нагрузки Vн
на реактор и уменьшения степени
превращения. Т.о, в реактор будет
возвращаться все больше и больше
исходного вещества, уменьшая дальнейшее
превращение. Если kτ0>1,
то установится значение х, как и в
системе с рециклом. Если kτ0<1,
то рецикл будет нарастать, степень
превращения будет стремиться к нулю,
исходное вещество будет накапливаться
в системе и Vн→∞.
Стационарного режима достигнуть не
удастся.
.
Результат будет иметь смысл, т.е. х>0,
если kτ0>1.
можно выбрать такую температуру, т.е.
значение k,
или такое τ0,
что приведет к kτ0<1,
но тогда получится отрицательная (х),
что невозможно. Для объяснения этого
рассмотрим эту же систему без рецикла.
При заданных условиях (k
и τ0)
в реакторе уст-ся некоторое значение
х. добавим к реактору колонну разделения
и непрореагировавший компонент вернем
в реактор, что приведет к увеличению
нагрузки Vн
на реактор и уменьшения степени
превращения. Т.о, в реактор будет
возвращаться все больше и больше
исходного вещества, уменьшая дальнейшее
превращение. Если kτ0>1,
то установится значение х, как и в
системе с рециклом. Если kτ0<1,
то рецикл будет нарастать, степень
превращения будет стремиться к нулю,
исходное вещество будет накапливаться
в системе и Vн→∞.
Стационарного режима достигнуть не
удастся.
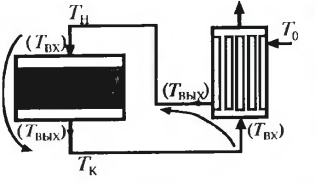 Пусть
ТК
на выходе из реактора временно
повысилась. Исходная смесь дополнительно
нагревается, что приведет к увеличению
скорости реакции и увеличение Тк
(разогрев). Если Тк понизится, то процесс
пойдет на затухание.Условия устойчивости
системы с обратной положительной
связью: (dTВЫХ/dTВХ)P(dTВЫХ/dTВХ)T
<
1, где (dTВЫХ/dTВХ)P
- чувствительность ТВЫХ
к ТВХ
в реакторе (dTВЫХ/dTВХ)T
-
чувствительность Твых к Твх в т/о.
Составим тепловой баланс т/о:Fт-
площадь; Kt
– коэф теплопередачи; Q-
кол-во переданной теплоты.
Q=Kt*FT*(Tвх-Твых)
– на разогрев исх смеси.
Q=vo*Cp*(Tвых-Т0)
Пусть
ТК
на выходе из реактора временно
повысилась. Исходная смесь дополнительно
нагревается, что приведет к увеличению
скорости реакции и увеличение Тк
(разогрев). Если Тк понизится, то процесс
пойдет на затухание.Условия устойчивости
системы с обратной положительной
связью: (dTВЫХ/dTВХ)P(dTВЫХ/dTВХ)T
<
1, где (dTВЫХ/dTВХ)P
- чувствительность ТВЫХ
к ТВХ
в реакторе (dTВЫХ/dTВХ)T
-
чувствительность Твых к Твх в т/о.
Составим тепловой баланс т/о:Fт-
площадь; Kt
– коэф теплопередачи; Q-
кол-во переданной теплоты.
Q=Kt*FT*(Tвх-Твых)
– на разогрев исх смеси.
Q=vo*Cp*(Tвых-Т0)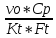 *(Tвых-Т0)=Твх-Твых
*(Tвых-Т0)=Твх-Твых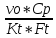 *
*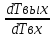 = 1-
= 1-
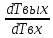 =>
=>
 =
= )*(
)*(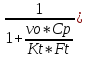 <1
<1 <
1 +
<
1 +
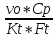 = 1+
= 1+
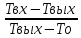 = 1+
= 1+
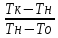 =
=
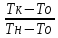
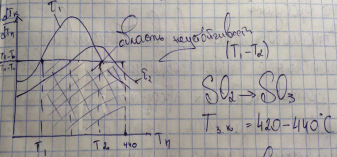 Чтобы
избежать попадания в зону неустойчивости,
начинать лучше с Т=440С
Чтобы
избежать попадания в зону неустойчивости,
начинать лучше с Т=440С
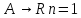 r=kCA
, WA=-kCA,
τ1=τi=….=τm
r=kCA
, WA=-kCA,
τ1=τi=….=τm ;
;
 ;
;

 ;
;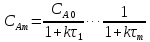 ;
;
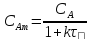
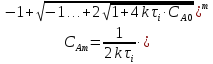
 ,
из которого следует, что для m-го
реактора:
,
из которого следует, что для m-го
реактора:
 ,
где СA,m-1
b
СA,m
концентрации вещества на входе и на
выходе из m-го
реактора. τ –условное
время пребывания.
,
где СA,m-1
b
СA,m
концентрации вещества на входе и на
выходе из m-го
реактора. τ –условное
время пребывания.

 от СА
описывается уравнением прямой с углом
наклона α,
для которого tg
α =-1/τ .
С другой стороны, скорость реакции
описывается уравнением -
от СА
описывается уравнением прямой с углом
наклона α,
для которого tg
α =-1/τ .
С другой стороны, скорость реакции
описывается уравнением -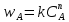 .
Поэтому точка пересечения прямой и
кривой характеризует концентрацию
исходного реагента в m-ном
реакторе. Таким образом, для проведения
расчета К-РИС необходимо вначале
построить кривую
по кинетическому уравнению, затем из
точки на оси абсцисс, для которой
СА,m-1=CA,0, проводим
прямую с тангенсом угла наклона –1/τ
до пересечения с кривой в точке М.
Опустив перпендикуляр из точки М на
ось абсцисс, получают значение
концентрации в первом реакторе. Эта
же концентрация является исходной
для входа во второй реактор. Для
нахождения концентрации во втором
реакторе операцию повторяют снова,
взяв в качестве исходной точку СА,1 и
повторяют до тех пор, пока не достигнут
заданной степени превращения. Так как
время пребывания принимают во всех
реакторах одинаковым, то и угол наклона
у них один, поэтому они параллельны.
.
Поэтому точка пересечения прямой и
кривой характеризует концентрацию
исходного реагента в m-ном
реакторе. Таким образом, для проведения
расчета К-РИС необходимо вначале
построить кривую
по кинетическому уравнению, затем из
точки на оси абсцисс, для которой
СА,m-1=CA,0, проводим
прямую с тангенсом угла наклона –1/τ
до пересечения с кривой в точке М.
Опустив перпендикуляр из точки М на
ось абсцисс, получают значение
концентрации в первом реакторе. Эта
же концентрация является исходной
для входа во второй реактор. Для
нахождения концентрации во втором
реакторе операцию повторяют снова,
взяв в качестве исходной точку СА,1 и
повторяют до тех пор, пока не достигнут
заданной степени превращения. Так как
время пребывания принимают во всех
реакторах одинаковым, то и угол наклона
у них один, поэтому они параллельны.