
- •Лабораторная работа
- •Тема 1. «Кинетика химических реакций».
- •Тема 2. «Влияние температуры и катализатора на скорость химических реакций».
- •Теория.
- •Теория.
- •1. Влияние температуры на скорость химических реакций.
- •2. Каталитические реакции.
- •3. Экспериментальное определение энергии активации.
- •Экспериментальная часть.
ФЕДЕРАЛЬНОЕ АГЕНСТВО СВЯЗИ
Государственное образовательное учреждение
Высшего профессионального образования
Московский технический университет связи и информатики
Лабораторная работа
по дисциплине «Химия».
Тема 1. «Кинетика химических реакций».
Тема 2. «Влияние температуры и катализатора на скорость химических реакций».
Вариант №6.
2016 г.
№1.Кинетика химических реакций.
Теория.
Основные понятия.
Химической кинетикой называют раздел химии, посвященный изучению закономерностей протекания химических реакций.
Все химические реакции подразделяются на простые, протекающие в несколько стадий (последовательных и параллельных). Простые реакции отличаются друг от друга числом молекул, принимающих участие в элементарном акте реакции: мономолекулярные – происходят при распаде или превращении одной молекулы, бимолекулярные – это реакции с участием двух (иногда одинаковых) молекул. Тримолекулярные реакции чрезвычайно редки, так как для их протекания требуется столкновение трех молекул. Понятие «молекулярность» к сложным реакциям неприменимо.
Скорость химической реакции определяется количеством вещества (в молях), реагирующих за единицу времени в единице объема (для гомогенных реакций) или на единице площади твердого вещества (для гетерогенных реакций, протекающих на границах раздела фаз твердое тело/газ, твердое тело/жидкость). Так как скорость реакции пропорциональна, стехиометрическим коэффициентам в уравнении реакции, то необходимо указывать вещество, по которому определяется скорость реакции.
Согласно приведенному выше определению средняя скорость химических реакций определяется выражениями:
 и
и
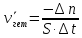 ,
(1)
,
(1)
где ∆n – изменение количества реагирующего вещества за время ∆t в объеме V или на поверхности твердого тела S. Знак «минус» согласовывает положительное значение скорости и отрицательное значение ∆n.
В дальнейшем будем для простоты рассматривать гомогенные реакции, протекающие при постоянном объеме.
Так
как
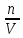 = c,
то
= c,
то
 = ∆c,
= ∆c,
Где с – концентрация вещества (моль/л).
В этом случае скорость можно выразить через изменение концентрации реагирующего вещества:
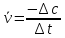
Истинной скоростью химической реакции называется величина, определяемая выражением:
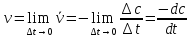 (2)
(2)
Скорость химических реакций зависит от природы, агрегатного состояния и концентрации реагирующих веществ, от температуры, давления, от различного вида излучений, от наличия и природы катализатора и др.
Зависимость скорости химических реакций от концентрации реагирующих веществ дается законом действия масс:
а) для простых реакций: скорость реакции пропорциональна концентрациям реагирующих веществ в степенях, равных стехиометрическим коэффициентам (то есть коэффициентам в уравнении реакции):
аА+bB → продукты реакции
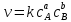 ,
(3)
,
(3)
где k-константа скорости.
Например, для простой реакции:
H2 + I2 →2HI
скорость
прямой реакции выражается уравнением:

б) для сложных реакций: скорость реакции пропорциональна концентрациям реагирующих веществ в некоторых степенях, как правило, не совпадающих со стехиометрическими коэффициентами:

 (4)
(4)
Например, для сложной (цепной) реакции: H2 + Br2 = 2HBr
скорость прямой реакции выражается уравнением:
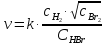
Как следует из приведенных примеров, по уравнению реакции нельзя судить о том, простая это реакция или сложная. Каждая реакция требует изучения.
Сумма показателей степеней в уравнениях закона действия масс называется порядком реакции (р). Порядок реакции определяется на основе изучения зависимости скорости химической реакции от концентраций реагирующих веществ.
Рассмотрим для пример кинетические закономерности некоторых химических реакций.
Простые химические реакции.
Необратимая реакция первого порядка.
(Необратимая реакция – это реакция, идущая только в одну сторону – образования продуктов реакции). Возьмем реакцию:
А → продукты реакции
например, разложение диметилового эфира при нагревании:
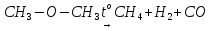
Согласно закону действия масс можно записать, что скорость простой реакции первого порядка пропорциональна концентрации реагирующего вещества в первой степени:
 (5)
(5)
Полученное уравнение решается методом разделения переменных:
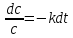 (6)
(6)
Интегрируя это уравнение от начального условия: при t=0, c=c0
 (7)
(7)
получаем:
 (8)
(8)
или
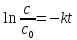 (9)
(9)
Из последнего уравнения при потенцировании следует:
 (10)
(10)
то есть концентрация реагирующего вещества экспоненциально уменьшается со временем реакции, причем в тем большей степени, чем больше константа скорости реакции: k3>k2>k1
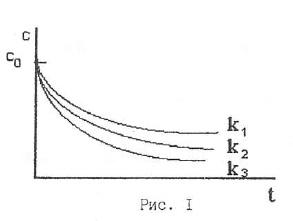
На основании изучения зависимости концентрации реагирующего вещества от времени реакции можно найти константу скорости химической реакции.
Из уравнения (9) получаем:
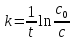 (11)
(11)
Зная с0 и с в момент времени t, легко рассчитать значение k. Кроме того, из уравнения (8) следует:
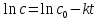 (12)
(12)
Представляя графически эту зависимость в координатах ln с от t, по тангенсу угла наклона прямой линии также получаем значение k:

(Примечание: при расчете тангенса угла наклона следует делить численные значения отрезков на осях координат).
Для характеристики скорости реакции первого порядка можно использовать понятие «периода полураспада (Т1/2)» - времени, в течение которого прореагирует половина исходного количества вещества.
Из уравнения (9) получаем выражение:
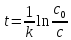 (13)
(13)
и применяем к нему определение периода полураспада:
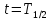 ,
когда
,
когда
 ,
,
в итоге получаем:
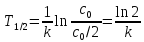
 (14)
(14)
Период полураспада не зависит от исходной концентрации и является наглядной характеристикой скорости реакции.
Кинетике реакции первого порядка подчиняются не только многие простые химические реакции, но и ядерные реакции самопроизвольного распада радиоактивных элементов.
Необратимые реакции второго порядка.
Это реакции типа:
А + В → продукты реакции
Например,

Согласно закону действия масс моно записать:
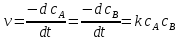 (15)
(15)
Рассмотрим простейший случай, когда сА=сВ (это получается автоматически, если реагируют, как в нашем примере с N2O5, одинаковые молекулы. Опуская индексы, (15) можно переписать в виде:
 (16)
(16)
Разделяем переменные:
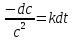 (17)
(17)
Интегрируя,
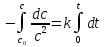 (18)
(18)
Получаем выражение
 (19)
(19)
Откуда можно найти константу скорости химической реакции:
 (20)
(20)
Уравнение, полученное из (19):
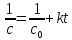 (20a)
(20a)
в координатах 1/с от t представляет собой прямую линию с тангенсом угла наклона альфа, равным константе скорости реакции:
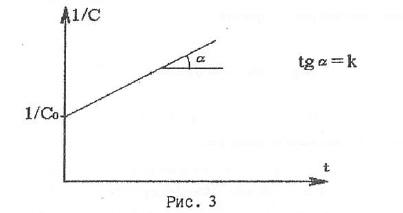
Концентрация вещества со временем реакции изменяется по уравнению:
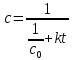 (20б)
(20б)
Время превращения половины количества веществ:
 (21)
(21)
зависит от начальной концентрации веществ А и В.
№2.Влияние температуры и катализатора на скорость химических реакций.
