
лекции / ПНС_Холиномиметики
.pdf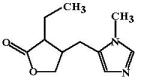
ХОЛИНЕРГЧЕСКИЕ СРЕДСТВА. ХОЛИНЕРГИЧЕСКИЕ АГОНИСТЫ.
Наступило молчание, и вдруг Ногарэ почувствовал позыв к рвоте, сопровождавшийся ощущением тяжести в желудке и в груди; он с трудом перевел дух. От боли он скорчился в кресле, и, как ни пытался выпрямиться, мускулы, к его удивлению, ему не повиновались. Однако слабость тут же прошла, он глубоко вздохнул и вытер мокрый от пота лоб.
М. Дрюон Проклятые короли.
Холинергическими называют лекарственные средства, которые влияют на передачу импульсов в холинергических синапсах. В зависимости от основной направленности действия – облегчения или угнетения передачи они могут быть разделены на 2 группы:
•Холинергическими агонистами (холиномиметиками) называют лекарственные средства, которые усиливают проведение импульсов в холинергических синапсах (т.е. воспроизводят эффекты медиатора холинергических нервов – ацетилхолина);
•Холинергические антагонисты (холиноблокаторы, холинолитики) – лекарственные средства, которые затрудняют проведение импульсов в холинергических синапсах (т.е. блокируют действие ацетилхолина на холинорецепторы).
Классификация холинергических агонистов
I. М-холиномиметические средства: пилокарпин, ацеклидин. II. Н-холиномиметические средства: никотин, цитизин, лобелин III.М,Н-холиномиметические средства:
1.Прямого действия: ацетилхолин, карбахолин;
2.Непрямого действия (антихолинэстеразные средства):
A Обратимые ингибиторы холинэстеразы: физостигмин, галантамин, неостигмин, дистигмин, амбеноний, ривастигмин;
B Необратимые ингибиторы холинэстеразы (ФОС): армин.
IV.Стимуляторы высвобождения ацетилхолина: аминопиридин, цизаприд.
М-холиномиметические средства
Пилокарпина гидрохлорид (Pilocarpini hydrochloride, Pilocar) Алкалоид, который содержится в листьях южноамериканских кустарников рода Pilocarpus (Pilocarpus pennatiofolius Jaborandi и Pilocarpus microphyllus). В настоящее время разработан метод искусственного синтеза пилокарпина.
МД: Пилокарпин проникает в холинергические синапсы и связывается с М-холинорецепторами, вызывая их активацию.
Необходимым условием для активации М-холинорецепторов является наличие у молекулы катионной головки и эфирной связи, которые находятся на расстоянии 0,3 нм друг от друга (т.е. разделены 2
углеродными атомами). Роль катионной головки пилокарпина выполняет азот имидазольного кольца, а в качестве эфирной связи выступает часть фуранонового кольца. Эти части молекулы пилокарпина разделяет 5 атомов углерода, однако, за счет вращения молекулы вокруг метиленового мостика происходит сближение этих группировок на расстояние ≈0,3 нм.
Пилокарпин может активировать как постсинаптические, так и пресинаптические М- холинорецепторы. При активации постсинаптических рецепторов пилокарпин вызывает развитие эффектов, характерных для активации парасимпатических нервов. Воздействуя на пресинаптические М-холинорецепторы пилокарпин вызывает усиление секреции ацетилхолина в сегетативных ганглиях и может оказать некоторое ганглиостимулирующее действие на парасимпатический и симпатический отделы вегетативной нервной системы.
ФК: Пилокарпин является третичным амином, при этом его катионный центр является ароматической частью имидазольной системы, поэтому протонируется плохо. Такая особенность строения позволяет пилокарпину хорошо всасываться и проникать через гистогематические барьеры (в том числе и в ЦНС, оказывая на нее возбуждающее действие). Развитие
2
центральных нежелательных эффектов пилокарпина ограничивает его системное применение и чаще лекарство используют в расчете на местное действие.
ФЭ: Фармакологические эффекты в целом связаны со стимуляцией парасимпатического отдела ВНС.
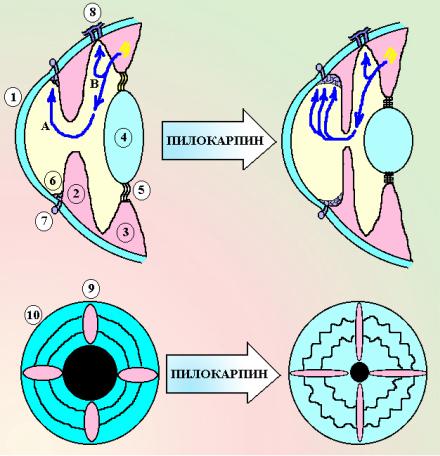
Схема 1. Влияние холиномиметических средств на глаз. 1 – роговица, 2 – радужка, 3 – цилиарное тело, 4
– хрусталик, 5 – циннова связка, 6 – угол передней камеры и лимфатические щели фонтанновых пространств, 7 –
шлеммов канал и круговая вена глаза, 8 – эписклеральные вены, 9 – m. dilatator pupillae, 10 – m. sphincter pupillae, А – трабекулярный путь оттока влаги, В – увеасклеральный путь оттока влаги. Под влиянием М-холиномиметиков происходитсужениезрачка(миоз), увеличиваетсяоотоквнутриглазнойжидкости, развиваетсяспазмаккомодации.
1. Влияние на глаз.
Сосудистая оболочка глаза в переднем отделе содержит 2 мышечных образования – радужку и цилиарное тело. Радужка представляет собой свободный передний край сосудистой оболочки, который ограничивает отверстие – зрачок, через который лучи света проникают к сетчатке. В толще радужки располагаются 2 мышцы – мышца, расширяющая зрачок (m. dilatator pupillae, волокна которой идут в радиальном направлении) и мышца, суживающая зрачок (m. sphincter pupillae, волокна которой идут циркулярно). Иннервация этих мышц осуществляется вегетативными веточками глазодвигательного нерва (III пара черепных нервов). Дилятатор зрачка получает симпатическую иннервацию и имеет α1-адренорецепторы, а сфинктер зрачка получает иннервацию парасимпатическими волокнами нерва и имеет М3-холинорецепторы. Дилятатор и сфинктер зрачка регулируют его диаметр и обеспечивают адаптацию глаза к различному уровню освещения.
Цилиарное тело (corpus ciliaris) – мышца, которая располагается позади радужной оболочки и формирует циркулярную площадку для прикрепления хрусталика глаза. К цилиарному телу крепится т.н. циннова связка. Волокна этой связки вплетаются в капсулу хрусталика и фиксируют его в вертикальной плоскости. За счет сокращения и расслабления цилиарного тела происходит изменение кривизны хрусталика и глаз адаптируется к четкому видению предметов, которые находятся на различном удалении. Гладкомышечные клетки цилиарного тела иннервируются парасимпатическими веточками глазодвигательного нерва и несут М3-холинорецепторы.
Радужка и цилиарное тело с хрусталиком делят пространство глаза на 2 камеры – переднюю и заднюю. Эти камеры принимают участие в циркуляции внутриглазной жидкости. Задняя камера – это щелевидное пространство между радужкой и хрусталиком. Именно в эту камеру происходит секреция эпителием цилиарного тела водянистой влаги (жидкости, которая поддерживает внутриглазное давление). Далее водянистая влага через зрачок изливается в переднюю камеру (пространство между роговицей и радужкой). В передней камере находятся пути оттока внутриглазной жидкости:
3
•90% жидкости оттекает по трабекулярному пути – в углу передней камеры (т.е. в том месте где встречается роговица и радужка) лежит особая сеть трабекул, которая формирует лимфатические щели – фонтанновы пространства. По этим щелям внутриглазная жидкости поступает в шлеммов канал, а затем по нему в циркулярную вену глаза, которая лежит в основании роговицы.
•10% жидкости оттекает по увеасклеральному пути. Вначале жидкость поступает к основанию цилиарного тела, а затем, через супрахориоидальные сосуды в эписклеральные вены (вены, находящиеся на поверхности склеры).
Пилокарпин вызывает следующие изменения:
суживает зрачок глаза (миоз, от греческого meiosis – уменьшение). Это связано с тем, что он активирует М-холинорецепторы m. sphincter pupillae, которая при этом сокращается. вызывает спазм аккомодации (циклоспазм). Это связано с тем, что он активирует М- холинорецепторы цилиарного тела и вызывает его сокращение. При этом высота цилиарного тела увеличивается и оно перестает натягивать циннову связку. Натяжение волокон связки ослабевает и капсула хрусталика благодаря элластичным свойствам сокращается, делая хрусталик более выпуклым. Глаз устанавливается на точку ближнего видения. Одновременно возникает макропсия – предметы кажутся нечеткими и увеличенными в размере.
снижение внутриглазного давления. Под влиянием пилокарпина происходит сужение зрачка и радужная оболочка вытягивается и утончается. Корень радужки при этом отходит от роговицы и открывает угол передней камеры глаза. Возникает расширение просвета лимфатических щелей и отток внутриглазной жидкости через фонтановы пространства в шлеммов канал и вены глаза облегчается. Такое преобладание оттока жидкости над ее продукцией приводит к падению внутриглазного давления.
Миотическое действие пилокарпина сохраняется от 3 до 24 часов, а спазм аккомодации исчезает уже через 2 часа.
2. Влияние на бронхи. Пилокарпин активирует М3-холинорецепторы гладких мышц бронхов при этом сигнал через Gq-белок передается на фосфолипазу С, которая гидролизует PIP2 до инозитол трифосфата и диацилглицерола. Оба этих медиатора способствуют повышению внутриклеточной концентрации ионов кальция (IP3 вызывает выделение кальция из внутриклеточного депо, а DAG – открывает кальциевые каналы в мембране клетки). Ионы кальция активируют особый белок кальмодулин, который дефосфорилирует миозинкиназу и переводит ее в активную форму. Миозинкиназа фосфорилирует легкие цепи миозина и запускает сокращение гладкомышечной клетки.
Таким образом, под влиянием пилокарпина происходит сокращение гладких мышц бронхов. За счет активации М3-холинорецепторов бронхиальных желез пилокарпин увеличивает секрецию слизи по такому же пути.
3. Желудочно-кишечный тракт. Пилокарпин активирует М3-холинорецепторы гладких мышц и желез ЖКТ, вызывая эффекты, подобные тем, которые развиваются в дыхательных путях: усиливается моторика ЖКТ, раскрываются сфинктеры, повышается секреция слюны и желудочного сока.
К действию пилокарпина, равно как и других холинергических средств, более чувствительны верхние отделы ЖКТ. Это связано с тем, что функция пищевода и желудка находится под достаточно мощным контролем парасимпатической нервной системы (V, IX, X пары черепных нервов). Нижние же отделы ЖКТ, напротив, в большей степени находятся под контролем гормонов энтерохромаффинной системы или метасимпатического отдела нервной системы.
4. Мочеполовая система. Пилокарпин вызывает сокращение детрузора мочевого пузыря (мышцы, изгоняющей мочу), одновременно раскрывая его сфинктеры. Поэтому пилокарпин способствует отделению мочи при атонии мочевого пузыря.
5. Влияние на сердечно-сосудистую систему. Воздействие на миокард связано с влия-
нием на М2-холинорецепторы:
М2-холинорецепторы передают сигнал на Gi-белки, при этом их α-субъединица нарушает работу аденилатциклазы и в клетке ослабевает синтез цАМФ. цАМФ необходим для по-
4
ступления ионов Са2+ в миокард – он фосфорилирует кальциевые каналы и поддерживает их в рабочем состоянии. В результате снижения концентрации кальция сила сердечных сокращений падает.
βγ-субъединицы G-белка активируют каналы для ионов К+ в клетках проводящей системы. Ионы калия покидают через канал клетку и вызывают при этом гиперполяризацию ее мембраны. В результате возбудимость клеток понижается и проведение импульсов замедляется.
Под влиянием βγ-субъединиц G-белка происходит инактивация Са2+-каналов L-типа – эти каналы обеспечивают поступление ионов кальция в клетку во время диастолы и процесс развития медленной диастолической деполяризации (МДД). Нарушение процесса МДД приводит к понижению автоматизма и снижению частоты генерации импульсов в клетках сино-атриального узла.
Таким образом, под влиянием пилокарпина уменьшается автоматизм, возбудимость и проводимость в миокарде, падает ЧСС. Сила сокращений сердца также снижается, однако, в связи с тем, что в желудочках сердца число М-холинорецепторов невелико, в большей степени падает сила сокращений миокарда предсердий.
|
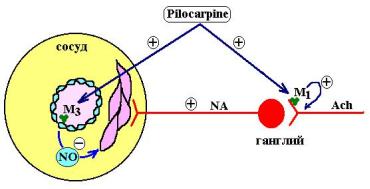
Влияние пилокарпина на сосуды |
|
носит 2-фазный характер. Вначале он |
|
вызывает кратковременное снижение |
|
АД, связанное с тем, что он стимули- |
|
руются М-холинорецепторы эндоте- |
|
лия сосудов и происходит выброс NO |
|
(эндотелийзависимого сосудорасши- |
|
ряющего фактора). Затем развивается |
|
гипертензивная реакция и АД повы- |
|
шается. Это связано с тем, что пило- |
Схема 2. Влияние пилокарпина на тонус сосудов. Пилокарпин |
карпин действует на пресинаптиче- |
стимулирует эндотелиальные М3-холинорецепторы, которые |
ские М1-холинорецепторы, вызывая, |
обеспечивают секрецию NO и расширение сосудов. Кроме то- |
тем самым, выделение ацетилхолина |
го, он активирует выброс ацетилхолина в вегетативных ганг- |
в синапс и активирует симпатические |
лиях сосудосуживающих симпатических нервов (через М1- |
нервы, которые вызывают вазоконст- |
холинорецепторы). |
рикторную реакцию. |
|
Такое сосудистое действие пилокарпина является уникальным и не характерно для других холиномиметических средств.
6. Влияние на смешанные секреторные железы. Пилокарпин стимулирует секрецию потовых, слезных и носоглоточных желез. Чувствительность потовых желез к пилокарпину настолько высока, что подкожное введение 10 мг пилокарпина может вызвать у человека отделение от 2 до 3 литров пота.
Применение и режимы дозирования:
1. Лечение глаукомы. Глаукома – это группа заболеваний, которая характеризуется прогрессирующим поражением зрительного нерва вследствие повышения внутриглазного давления (ВГД). В норме величина ВГД составляет от 18 до 20 мм рт. ст. и зависит от балланса между процессом продукции водянистой влаги и ее оттоком.
Различают 2 формы глаукомы:
•Открытоугольная глаукома – это хроническое заболевание, при котором угол передней камеры глаза, через который происходит отток жидкости, остается открытым, но лимфатические щели фонтанновых пространств постепенно зарастают и ВГД медленно повышается. Основным способм лечения этой формы глаукомы является снижение продукции внутриглазной жидкости, активация альтернативных путей оттока жидкости (увеасклерального).
•Закрытоугольная глаукома – это заболевание, которое возникает у лиц с узкой передней камерой глаза и ее мелким углом. Если у таких лиц происходит длительное рас-
5
ширение зрачка и радужка утолщается, то угол передней камеры может полностью закрыться и отток жидкости внезапно прекращается. ВГД скачкообразно повышается до 40-60 мм рт. ст, развивается острый приступ глаукомы (мучительные боли в глазу, которые иррадиируют в череп на стороне поражения, нарушение зрения, рвота). При отсутствии помощи у таких пациентов может наступить слепота, вследствие отслойки сетчатки. Основным способом лечения данного вида глаукомы является улучшение оттока внутриглазной жидкости через переднюю камеру и последующая хирургическая коррекция размера камеры.
Пилокарпин применяют как для купирования острого приступа закрытоугольной глаукомы, так и для последующей профилактики повторных приступов:
Для купирования острого приступа глаукомы пилокарпин используют в виде 1-2% капель, закапывая в больной глаз по 1-2 капли каждые 10-15 мин в течение 1 часа, затем каждые 30 мин в течение 2-3 часов и в последующем каждый час еще в течение 6 часов. После купирования приступа переходят на поддерживающую терапию.
Поддерживающая терапия при профилактике приступов закрытоугольной глаукоме и плановом лечении открытоугольной глаукомы. Используют закапывание 1-4% раствора 2-4 раза в сутки или формы продленного действия – полимерные пленки, мазь пилокарпина, которые закладывают за нижнее веко 1-2 раза в сутки.
Пленки пилокарпина представляют собой водорастворимый полимер, который окрашен брилиантовой зеленью и содержит иммобилизированный пилокарпин. Пленку глазным пинцетом помещают за нижнее веко и на 30-60 сек фиксируют глаза закрытыми неподвижно. Пленка при этом набухает и переходит в элластичное состояние, прикрепляясь к слизистой конъюнктивы. Постепенно пленка деградирует и выделяет пилокарпин.
После однократного применения пилокарпина эффект развивается через 30-40 мин и сохраняется 4-8 часов. Снижение давления при этом составляет 25-26% от первоначального уровня.
2. Крайне редко используют системное введение пилокарпина для лечения ксеростомии (сухости слизистых оболочек рта и носоглотки) при синдроме Шегрена (ревматическое заболевание, при котором поражаются экзокринные железы и нарушается секреция слюны, слезной жидкости, носовой слизи). Применяют пилокарпин внутрь по 5 мг 3 раза в день (курс лечения 1-2 месяца).
ФВ: порошок, глазные капли 1, 2, 3 и 4% во флаконах по 5 и 10 мл; глазная мазь 1 и 2% в тубах по 3,0; пленки глазные по 0,00002 и 0,00004; таблетки по 0,005.
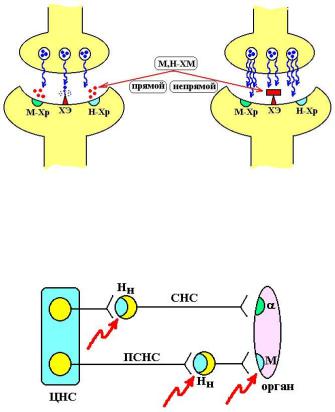
Ацеклидин (Aceclidine) Является синтетическим веществом из группы хинуклидина. Механизм действия ацеклидина на организм аналогичен действию пилокарпина. Однако, хинуклидиновый атом азота ионизируется более легко, чем азот пилокарпина, поэтому ацеклидин хуже проникает через ГЭБ и является менее токсичным.
В отличие от пилокарпина ацеклидин оказывает несколько меньшее воздействие на ткани желез и более выражено влияет на гладкие мышцы внутренних органов.
Применение и режимы дозирования. Для лечения глаукомы ацеклидин используют редко, т.к. его инстилляции вызывают раздражение конъюнктивы и боли в глазном яблоке. Глазные капли закапывают 3-6 раз в день, мазь закладывают 1-2 раза в день.
Значительно чаще ацеклидин применяют в расчете на системное действие при послеоперационной атонии желудка, кишечника, мочевого пузыря. Иногда, при полостных операциях, механические манипуляции с содержимым брюшной полости приводят к микротравмам нервных сплетений, и, в послеоперационном периоде, тонус и моторика органов брюшной полости резко понижается. Введение ацеклидина позволяет восстановить работу гладких мышц. Обычно ацеклидин вводят подкожно по 2-4 мг (при необходимости инъекцию можно повторить через 20-30 мин).
6
ФВ: глазные капли 2, 3 и 5% (экстемпоральные), мазь 3 и 5%, раствор 0,2% в ампулах по 1 мл.
Нежелательные эффекты при использовании М-холиномиметиков. Как правило они являются продолжением фармакологических эффектов и возникают при чрезмерной стимуляции М-холинорецепторов:
•Эффекты, связанные с местным воздействием М-холиномиметиков на глаз. Под влиянием М-холиномиметиков глаз устанавливается на точку ближнего видения, возникает лекарственная миопия (близорукость). Чрезмерное сокращение цилиарной мышцы может привести к возникновению спастических стреляющих болей в глазу.
•Эффекты, связанные с резорбтивным воздействием при попадании в кровоток. При передозировке М-холиномиметиков развивается симптомокомплекс, который получил название «мускариноподобного синдрома». Наблюдается:
Гиперсекреция пищеварительных, бронхиальных и потовых желез в виде истечения слюны (саливации), слезной жидкости (лакримации), носовой слизи (ринореи), бронхиального секрета (бронхореи) и профузной потливости (диафереза).
Повышение тонуса гладких мышц внутренних органов сопровождается бронхоспазмом (повышением тонуса бронхов), тошнотой, рвотой, коликами (схваткообразные боли в животе, вызванные спастическим сокращением гладких мышц желчных путей, мочеточников, кишечника). Может возникнуть недержание мочи.
Со стороны сердечно-сосудистой системы отмечается брадикардия и гипотония (при передозировке пилокарпина – гипертензия).
Развиваются глазные симптомы (миоз, циклоспазм, миопия), которые обусловлены поступлением холиномиметиков в глаз из системного кровотока.
Смерть наступает в связи с параличом дыхательного центра. Помощи при отравлении заключается в назначении М-холиноблокаторов (атропина сульфата).
М,Н-холиномиметики
Схема 3. Сравнение действия прямых и непрямых (косвенных) М,Н-холиномиметиков. Прямые М,Н-
холиномиметики взаимодействуют с холинорецепторами всех видов и активируют их. Непрямые холиномиметики
– блокируют разрушение ацетилхолина, действие которого на рецептор усиливается и удлиняется.
Схема 4. Двойное усиление парасимпатических эффектов подвлияниемМ,Н-холиномиметиков.
М,Н-холиномиметиками называют лекарственные средства, при введении которых в организм, стимулируются одновременно М- и Н-холинорецепторы.
Различают М,Н-холиномиметики прямогоикосвенногодействия(см. схему3):
•М,Н-холиномиметики прямого действия непосредственно взаимодействуют с М- и Н-типами холинорецепторов, активируя их.
•М,Н-холиномиметики косвенного действия не влияют непосредственно на холинорецепторы. Они инактивируют
холинэстеразу и приводят к прекращению разрушения ацетилхолина, который выделяется из синапса. Накопление ацетилхолина в синаптической щели приводит к активации всех видов холинорецепторов и усилению передачи импульсов во всех холинергических синапсах. Благодаря такому действию эту группу лекарств называют еще антихолинэстеразными средствами.
Под влиянием М,Н-холиномиметиков происходит активация всех Н-холино-
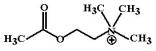
7
рецепторов – как тех, что располагаются в парасимпатических ганглиях, так и тех, что лежат в симпатических ганглиях. Однако, при введении М,Н-холиномиметиков в организм возникают, как правило, только парасимпатические эффекты. Данный феномен можно объяснить тем, что в парасимпатических нервах будет происходить двойное усиление передачи – как в ганглиях (Н- холинорецепторы), так и в синапсах рабочих органов (М-холинорецепторы). В симпатической нервной системе, напротив, усиление эффекта будет происходить лишь однократно – только в ганглиях(гдележатН-холинорецепторы).
М,Н-холиномиметики прямого действия
Ацетилхолина хлорид (Acetylcholini chloridum) Эндогенный медиатор в холинергических синапсах.
Историческая справка. Синтезирован в 1867 г A. Baeyer. Впервые его применили в медицинской практике в 1939 г для проведения судорожной терапии при лечении психических заболеваний. Ранее для этой цели широко применяли лептазол, который часто провоцировал развитие переломов во время судорожного припадка. Было заявлено, что при использовании ацетилхолина риск переломов минимален, а эффективность терапии составляет 80%. Однако, энтузиазм к данному виду лечения быстро прошел, поскольку было установлено, что вызываемые ацетилхолином судороги связаны не с его влиянием на мозг, а с аноксией, вследствие паралича сердца. В 1944 г в журнале Archives of Neurology and Psychiatry группа врачей публикует описание клинического состояния, которое возникает после применения ацетилхолина: «… Через несколько секунд после введения ацетилхолина (как можно более быстрого, чтобы избежать его разрушения в крови) больной принимал положение с коленями, прижатыми к груди, согнутыми руками и наклоненной головой. У него начинался приступообразный сильный кашель, иногда с покраснением лица. Отмечалось затруднение при глотании, и были слышны звуки, сопровождавшие усиленную перистальтику. Дыхание было затрудненное и нерегулярное. Кашель прекращался как только больной ложился на спину.
Через 40 с после введения исчезал пульс и наступала кома. Зрачки расширялись, повышалась активность глубоких рефлексов. Через 45 с развивался опистотонус с коротким апноэ.
… Глубокие рефлексы подавлялись, наступала релаксация, больной оставался неподвижным, кожные покровы были холодными и влажными, серого цвета. Через 90 с покраснение лица свидетельствовало о появлении пульса. Увеличивалась частота дыхания, и приблизительно через 125 с восстанавливалось сознание. Иногда возникало непроизвольное мочеиспускание, но дефекации не было. После проведенного лечения больной предпочитал спокойно лежать в постели. Большинство больных были устойчивы к этому виду лечения».
МД: Ацетилхолин взаимодействует с М- и Н-типами холинорецепторов, активируя их. В дозах 0,1-0,5 мкг/кг стимулируются преимущественно М- холинорецепторы, активация Н-холинорецепторов проявляется только при использовании более высоких доз ≈2-5 мкг/кг.
ФК: Молекула ацетилхолина имеет заряд, поэтому ее абсорбция из места введения протекает крайне плохо. В тканях и плазме крови имеется псевдохолинэстераза, которая проводит гидролиз ацетилхолина одновременно с ацетилхолинэстеразой синапсов, поэтому время существования ацетилхолина в организме ограничивается 10-15 минутами. Такое непродолжительное сохранение эффекта не позволяет вводить ацетилхолин иным путем, чем инъекционный.
ФЭ: Благодаря тому, что ацетилхолин быстро разрушается, заметное влияние он успевает оказать лишь на структуры сердечно-сосудистой системы.
1.При введении малых доз с невысокой скоростью (20-50 мкг/мин) ацетилхолин оказывает влияние на внесинаптические М-холинорецепторы эндотелия сосудов данного региона. Активация этих рецепторов вызывает освобождение NO из эндотелия и генерализованную вазодилятацию с падением артериального давления.
Снижение артериального давления приводит к уменьшению стимуляции рефлексогенных зон дуги аорты и синокаротидной зоны волной крови. Возникает растормаживание сосудодвигательного центра и рефлекторная тахикардия.
2.При введении высоких доз ацетилхолина или при большой скорости инфузии (100 мкг/мин), часть лекарственного вещества успевает достигнуть миокарда и воздействует
на его М2-холинорецеторы. В итоге, за счет активации М-холинорецепторов эндотелия наблюдается гипотензивная реакция, а за счет воздействия на миокард – резкая брадикардия (снижение автоматизма и проводимости миокарда). Рефлекторная тахикардия при этом подавляется.
8
Н-холиномиметическое действие ацетилхолина не проявляется при его обычном введении. Но если его ввести лицам с блокированными М-холинорецепторами, то возникает тахикардия и повышение артериального давления. Это связано с тем, что ацетилхолин стимулирует Н-холинорецепторы симпатических ганглиев.
При местном введении ацетилхолина в конъюнктивальный мешок глаза развивается миоз, циклоспазм и снижение внутриглазного давления, которые связаны со стимуляцией М-
холинорецеторов m. sphincter pupillae и m. ciliaris.
Применение. Практического применения ацетилхолин в медицинской практике в настоящее время не находит. Это связано с тем, что действие его чрезвычайно кратковременно, кроме того, при быстром внутривенном введении он может вызвать коллапс с остановкой сердца.
Ранее ацетилхолин пытались применять при лечении облитерирующих заболеваний сосудов нижних конечностей (состояния при которых уменьшается кровоток в сосудах). В настоящее время ацетилхолин применяют исключительно в экспериментальной фармакологии.
ФВ: порошок в ампулах по 100 мг.
Карбахолин (Carbachol, Miostat) Синтетическое карболиновое производное ацетилхолина. Отличается большой устойчивостью к действию холинэстеразы, поэтому гидролизуется крайне медленно. Карбахолин несколько в большей степени, по сравнению с ацетилхолином, воздействует на Н-холинорецепторы, чем на М-холинорецепторы. По механизму и характеру действия в
целом напоминает ацетилхолин.
В связи с достаточно высоким риском развития коллапса и атриовентрикулярной блокады при парентеральном введении, в расчете на местное действие применяется редко.
Обычно его используют в офтальмологии для создания интраоперационного миоза при выполнении оперативных вмешательств на глазном яблоке. Карбахолин вводят в переднюю камеру глаза в дозе 0,75-1,5 мг. Миоз может сохраняться до 2 суток.
ФВ: порошок для приготовления глазных капель 0,75; 1,5; 2,25 и 3%.
Непрямые М,Н-холиномиметики (антихолинэстеразные средства)
Антихолинэстеразные средства обратимо или необратимо блокируют ацетилхолинэстеразу синапсов и псевдохолинэстеразу плазмы крови. Это вызывает накопление в синапсе ацетилхолина, приводит к усилению и пролонгированию его действия на М- и Н-холино- рецепторы.
Ацетилхолинэстераза обеспечивает гидролиз 600.000 молекул ацетилхолина в течение 1 минуты. Она имеет 2 активных центра:
•Анионный центр – его формируют карбоксильная группа глутаминовой кислоты, которая
несет избыточный отрицательный заряд и триптофан (glu202 и trp286). Этот центр присоединяет катионную головку ацетилхолина и, путем ионной связи, обеспечивает правильную ориентацию молекулы.
•Эстеразный центр – формируется гидроксильной группой серина (ser203), окруженной карбоксильным центром глутаминовой кислоты и имидазольным кольцом гистидина
(glu334 и his447). Этот центр формирует ковалентную связь с ацетатной группировкой ацетилхолина, трансформируя тригональную молекулу медиатора в тетрагональный проме-
жуточный продукт.
После образования тетрагонального комплекса с ацетилхолином, фермент отщепляет от него ацетильную группу и подвергается регенерации с освобождением остатка уксусной кислоты. Весь цикл регенерации занимает 150 мС.
Существует 3 принципиальных подхода к угнетению ферментативной активности холинэстеразы:
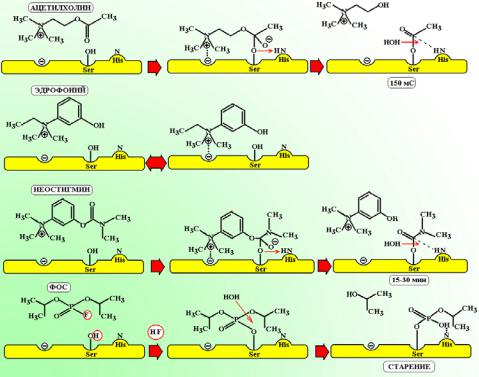
9
Схема 5. Фармакологические подходы к блокированию холинэстеразы. Вверху показан гидролиз ацетилхоли-
на. Эдрофоний обратимо блокирует анионный центр фермента, образуя непрочную ионную связь. Производные карбаминовой кислоты (неостигмин) связывают оба центра фермента и карбамоилируют его эстеразный центр. В результате регенерация фермента замедляется в 6.000 раз. Фосфорорганические соединения фосфорилируют активный центр фермента, а затем вызывают его «постарение» за счет дополнительного гидролиза одной из алкильных групп. В итоге, блокада фермента становится необратимой.
•Блокада анионного центра фермента. Лекарственные средства этой группы имеют легко ионизируемые оснóвные группы, которые способны устанавливать ионные связи с данным центром фермента. При этом эндогенный ацетилхолин не может занять правильную ориентацию относительного эстеразного центра фермента. Поскольку ионные связи с анионным центром весьма непрочные, то длительность блокады фермента крайне непродолжительная и неустойчивая. Как правило, лекарственные средства этой группы используются только с диагностическими целями (эдрофоний, фасцикулин).
•Блокада анионного и эстеразного центров фермента. Лекарственные средства этой группы являются производными карбаминовой кислоты и занимают оба центра фермента и подвергаются процедуре гидролиза. В ходе гидролиза ацетилхолинэстераза отщепляет от них остаток карбаминовой кислоты и возникает карбамоилированный фермент. В отличие от ацетилированного фермента, который восстанавливается за 150 мС карбамоилированной ацетилхолинэстеразе требуется на регенерацию от 15 до 30 мин (т.е. в 6.00012.000 раз больше времени). Естественно, что такое выключение холинэстеразы сопровождается значительным скоплением ацетилхолина в синапсе. Лекарственные средства этой группы называют обратимыми ингибиторами холинэстеразы, подчеркивая тем самым, что активность фермента способна самопроизвольно восстанавливаться за счет постепенного гидролиза карбамаминовой группировки.
•Блокадаэстеразногоцентрафермента. Лекарственныесредстваэтойгруппыотносятсякклассу фосфорорганических соединений. Они взаимодействуют с эстеразным центром фермента, подвергая его фосфорилированию. В отличие от нестойких карбаминовых ковалентных соединений, фосфорилированые формыфермента крайнеустойчивы. Еслиалкильные заместителиу фосфорилированного фермента представлены этильными или метильными радикалами, то дефосфорилирование фермента еще возможно, хотя и протекает крайне медленно (в течение нескольких часов или суток). Если заместители являются вторичными или третичными алкильными радикалами (см. схему 5), то модификация фермента происходит практически необрати-
10
мо. Соединения этого класса называют необратимыми ингибиторами холинэстеразы. Этил- и метилзамещенные ФОС используют в медицинской практике, а также как инсектицидные средства. Соединения со вторичными и третичными алкильными группировками, которые имеют высокую токсичность используют как боевые отравляющие вещества нервнопаралитическогодействия(зарин, зоман, табун).
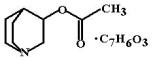
Физостигмина салицилат (Physostigmini salicylas, Eserini salicylas) Алкалоид кала-
барских (судилищных) бобов – плодов древовидного кустарника физостигмы ядовитой (Physostigma venenosum), произрастающего в Западной Африке. Аборигены использовали бобы для проведения «божьего суда». Если подозреваемый в преступлении выживал после употребления бобов в пищу, его считали невиновным. (Шаманы знали,
что при нагревании ядовитый алкалоид разрушается и поэтому, проведя предварительное расследование, всегда могли обеспечить нужный исход испытания).
МД: Физостигмин имеет более высокое сродство к ацетилхолинэстеразе, чем к псевдохолинэстеразе. Блокирует анионный и эстеразный центры фермента. В процессе гидролиза физостигмина ацетилхолинэстераза карбамоилируется и остается в неактивном состоянии от 15 до 30 мин. Такая модификация фермента вызывает прекращение гидролиза ацетилхолина и, с каждым новым импульсом, в синаптическую щель выделяются все новые и новые порции медиатора. Действие ацетилхолина М- и Н-холинорецеторы усиливается и удлиняется. Действие физостигмина проявляется только в том случае если заблокировано от 60 до 90% фермента.
Кроме того, было показано, что физостигмин способен непосредственно активировать М-холинорецепторы, связываясь с их активным центром.
ФК: Физостигмин является третичным амином, т.е. он не имеет ионизированных групп и, поэтому, хорошо всасывается при любом пути введения. Физостигмин высоколипофилен и хорошо проникает в ЦНС, где вмешивается в холинергическую передачу.
ФЭ: Под влиянием физостигмина увеличивается концентрация ацетилхолина в синапсах ЦНС, М-холинергических синапсах внутренних органов, Н-холинергических синапсах вегетативных ганглиев и скелетных мышц. Однако, наибольшая активность физостигмина реализуется именно в М-холинергических синапсах внутренних органов.
Центральные эффекты (влияние на передачу в синапсах ЦНС). Под влиянием физостигмина происходит общее повышение электрической активности мозга (ЭЭГ), улучшаются процессы памяти и обучения. Однако, субъективно у пациента возникает тревожное состояние.
М-холиномиметическое действие. Связано с облегчением передачи в М-холинергических синапсах. Проявляется типичным симптомокомлексом:
•Глаз. Физостигмин вызывает сужение зрачка (миоз), который развивается через несколько минут после инстилляции в глаз и продолжается до 6-8 часов. Миоз выражен настолько, что зрачок может уменьшиться до размеров булавочной головки. За счет миоза открывается угол передней камеры глаза и улучшается отток водянистой влаги, в итоге, снижается внутриглазное давление. За счет накопления ацетилхолина в синапсах цилиарного тела возникает его сокращение и глаз устанавливается на точку ближнего видения (циклоспазм и лекарственная миопия).
•Железы. Под влиянием физостигмина усиливается действие ацетилхолина на М- холинорецепторы экзокринных желез и возрастает секреция слезных, носоглоточных, слюнных желез, увеличивается продукция желудочного сока и пота.
•Гладкие мышцы внутренних органов. Развивается сокращение гладких мышц бронхов, пищевода, желудка, кишечника, мочеточников.
Н-холиномиметическое действие. Под влиянием физостигмина увеличивается концентрация ацетилхолина в области нейро-мышечных синапсов и действие избыточных количеств ацетилхолина НМ-холинорецепторы приводит к увеличению силы мышечных сокращений, облегчает нервно-мышечную проводимость. В высоких концентрациях физо-
