
- •Глава 9
- •§ 9.1. Внутренняя энергия термодинамической системы
- •§ 9.2. Работа газа при изменении его объема
- •§ 9.3. Первое начало термодинамики
- •§ 9.4. Теплоемкость
- •§ 9.5. Молярная теплоемкость при постоянном объеме
- •§ 9.6. Молярная теплоемкость при постоянном давлении. Уравнение Майера
- •§ 9.7. Применение первого начала термодинамики к изопроцессам
- •§ 9.8. Круговые процессы (циклы). Цикл Карно
- •§ 9.9. Второй закон (начало) термодинамики. Энтропия
- •§ 9.10. Энтропия идеального газа
- •§ 9.11. Энтропия и вероятность
- •§ 9.12. Реальные газы. Уравнение Ван-дер-Ваальса
- •Контрольные вопросы
- •Задачи к главам 8, 9
Глава 9
Основы термодинамики.
§ 9.1. Внутренняя энергия термодинамической системы
Тело как система из составляющих его частиц обладает внутренней энергией. С позиций молекулярно-кинетической теории внутренняя энергия — это сумма потенциальной энергии взаимодействия частиц, составляющих тело, и кинетической энергии их беспорядочного теплового движения.
Вычислим внутреннюю энергию идеального газа. Если потенциальная энергия взаимодействия молекул равна нулю, внутренняя энергия идеального газа равна сумме кинетических энергий хаотического теплового движения всех его молекул. Внутренняя энергия 1-го моля газа равна сумме кинетических энергий NA молекул:
![]() . (9.1)
. (9.1)
Внутренняя энергия массы mгаза равна:
![]() , (9.2)
, (9.2)
где
![]() – количество вещества.
– количество вещества.
§ 9.2. Работа газа при изменении его объема
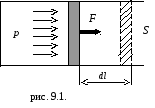
Если газ, расширяясь, передвигает поршень на расстояние dl, то производит над ним работуdA = Fdl = pS dl = pdV (рис.9.1.), т.е.
![]() dA
= pdV(9.3)
dA
= pdV(9.3)
Полная работа A, совершаемая газом при изменении его объема отV1 доV2 ,
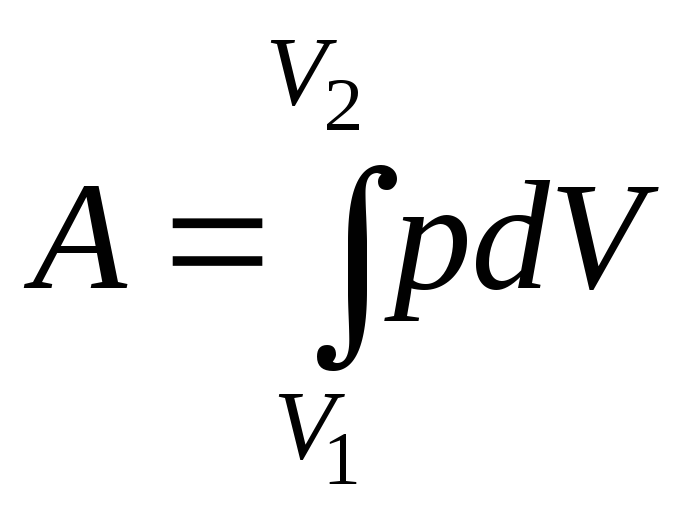 . (9.4)
. (9.4)
Изменение давления газа при его расширении можно представить графически (рис.9.2).
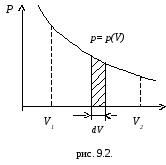
При увеличении объема на dVсовершаемая газом работа равнаpdV, т.е. определяется площадью заштрихованной полоски. Полная работа, совершаемая газом при расширении от объемаV1до объемаV2 определяется площадью, ограниченной осью абсцисс, кривойp(V)и прямымиV1иV2.
§ 9.3. Первое начало термодинамики
Термодинамическое состояние каждого газа определяется тремя величинами: давлением, объемом и температурой, называемыми параметрами состояния. Изменение двух или сразу всех трех параметров состояния системы называется термодинамическим процессом. Все термодинамические процессы сопровождаются обменом или превращением энергии. При этом всегда выполняется первый закон (начало) термодинамики.
Первое начало термодинамики это закон сохранения и превращения энергии применительно к термодинамическим процессам: количество теплоты, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами
![]() , (9.5)
, (9.5)
где
![]() –
для газов.
–
для газов.
§ 9.4. Теплоемкость
Удельная теплоемкость это величина, определяемая количеством теплоты, необходимым для нагревания 1 кг вещества на 1 К
![]() . (9.6)
. (9.6)
Единицей теплоемкости является Дж/(кг .К).
Молярная теплоемкость это величина, определяемая количеством теплоты, необходимым для нагревания 1-го моля вещества на 1 К.
![]() , (9.7)
, (9.7)
где = m /– количество вещества. Из (9.6) и (9.7) получаемC= c μ .
Различают теплоемкости (удельную и молярную) припостоянном объеме(cV и CV) и постоянном давлении (cp иCp), если в процессе нагревания вещества его объем или давление поддерживаются постоянными.
§ 9.5. Молярная теплоемкость при постоянном объеме
Записав первое начало термодинамики
![]()
и учитывая, что
![]() ,
,![]() ,
для 1-го моля газа получим
,
для 1-го моля газа получим
![]() . (9.8)
. (9.8)
При V=const,pdV=0, поэтому сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:
![]() . (9.9)
. (9.9)
Таким образом, молярная теплоемкость равна
![]() (9.10)
(9.10)
