
01.Лечебное дело / Общая химия / Литература / МУРОМЦЕВА ПРАКТИЧЕСКАЯ ХИМИЯ
.PDF
|
|
Окончание табл. 9.3 |
|
|
|
Назначение пластмассы |
Характерные свойства |
Примеры |
Светотехнические |
Стойкие к действию света |
Полиметилметакрилат, |
и оптические |
и высокие оптические |
полистирол, акрил |
|
свойства |
|
Фрикционные |
Высокий коэффициент |
Асбополимерные |
(детали тормозов |
трения |
материалы |
муфт сцепления) |
|
|
Антифрикционные |
Низкий коэффициент |
Капрон фторопласт-4, |
|
трения |
лавсан |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Что такое пластмассы? Из каких компонентов состоят пластмассы?
2.Что такое полимер? Какими способами получают полимеры?
3.Как влияют атомы кислорода, серы, хлора, присутствующие в молекулярных цепях полимеров, на свойства материала?
4.Какие свойства придают полимерному материалу содержащиеся в молекулярных цепях атомы кремния, титана, алюминия?
5.Как меняется структура макромолекул термореактивных полимеров в процессе изготовления изделий?
6.Каково назначение наполнителей и добавок в пластмассах?
7.Как классифицируют пластмассы по назначению? Каковы характерные свойства пластмасс в зависимости от назначения?
8.Каковы достоинства и недостатки пластмасс антифрикционного назначения по сравнению с металлическими антифрикционными материалами?
9.Какие материалы называют полиолефинами, полиамидами, фторопластами, поликарбонатами, полиимидами? Каковы их основные свойства?
10.Как влияет комбинирование фторопласта с другими материалами на его свойства? Какие композиционные материалы на основе фторо- пласта-4 вам известны?
11.Какие термореактивные материалы используют для изготовления узлов трения? Каковы их характерные свойства?
9.2. Индивидуальные задания
Задание. Дайте характеристику полимерного материала по классификационному признаку. Запишите химическую формулу (по возможности), исходное сырье, получение полимерного материала. Дайте характеристику свойствам, укажите достоинства и недостатки полимера и назовите область применения (табл. 9.4 – вариант своего контрольного задания).
81

|
|
|
Таблица 9.4 |
|
|
Варианты контрольного задания |
|
|
|
|
|
Вари- |
|
Классификационный признак |
Полимерный материал |
ант |
|
||
|
|
|
|
1 |
1. |
Неполярные термопластичные пластмассы |
Полиэтилен |
|
2. |
Пластмассы с порошковыми наполнителями |
– |
2 |
1. |
Полярные термопластичные пластмассы |
Фторопласт-3 |
|
2. |
Газонаполненные пластмассы |
– |
3 |
1. |
Термореактивные материалы |
– |
|
2. |
Слоистые пластмассы |
Гетинакс |
4 |
1. |
Неполярные термопластичные пластмассы |
Полипропилен |
|
2. |
Слоистые пластмассы |
Текстолит |
5 |
1. |
Газонаполненные пластмассы |
– |
|
2. |
Полярные термопластичные пластмассы |
Полиметилметакрилат |
6 |
1. |
Неполярные термопластичные пластмассы |
Полистирол |
|
2. |
Термореактивные материалы |
|
7 |
1. |
Полярные термопластичные пластмассы |
Полиметилметакрилат |
|
2. |
Слоистые пластмассы |
Текстолиты |
8 |
1. |
Пластмассы с волокнистыми наполнителями |
Стекловолокниты |
|
2. |
Неполярные термопластичные пластмассы |
Полистирол |
9 |
1. |
Неполярные термопластичные пластмассы |
Фторопласт-4 |
|
2. |
Слоистые пластмассы |
Древеснослоистые |
10 |
1. |
Полярные термопластичные пластмассы |
Полиамиды |
|
2. |
Термореактивные материалы |
|
11 |
1. |
Газонаполненные пластмассы |
– |
|
2. |
Полярные термопластичные пластмассы |
Поливинилхлорид |
12 |
1. |
Полярные термопластичные пластмассы |
Поликарбонаты |
|
2. |
Неполярные термопластичные пластмассы |
Полиэтилен |
13 |
1. |
Полярные термопластичные пластмассы |
Фторопласт-3 |
|
2. |
Термореактивные пластмассы |
Аминопласты |
14 |
1. |
Газонаполненные пластмассы |
Пенополиуретаны |
|
2. |
Термопластичная пластмасса |
Винипласт |
15 |
1. |
Термопластичная пластмасса |
АБС-пластики |
|
2. |
Слоистые пластмассы |
Текстолиты |
9.3. Экспериментальная часть
Реактивы: этиловый спирт, концентрированная H2SO4, растворы бромной воды, перманганата калия/
Опыт 1. Получение этилена и изучение его свойств
(опыт проводить под тягой)
А. Для получения этилена из этилового спирта и серной кислоты необходимо приготовить смесь: (по объему) 1 часть этилового спирта и 3 части концентрированной серной кислоты.
Получите у лаборанта растворы перманганата калия и бромной воды.
82
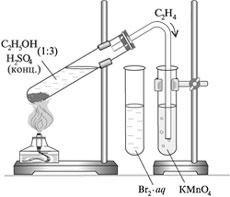
Б. Налейте приготовленную смесь спирта и кислоты в пробирку на ¼ от объема пробирки и добавить 0,5–1 г песка для равномерного кипения. Закройте пробирку пробкой с газоотводной трубкой. Закрепите пробирку под углом в лапке держателя штатива и нагрейте (рис. 9.2).
В. Опустите газоотводную трубку в пробирку с бромной водой и пропустите этилен. Наблюдайте эффект, раствор оставьте для сравнения.
Г. Продолжая нагревание смеси, опустите газоотводную трубку в пробирку с раствором перманганата калия и пропустите этилен. Наблюдайте эффект, раствор оставьте для сравнения.
Д. Поднимите конец газоотводной трубки вверх и подожгите этилен. Отметьте цвет и яркость пламени.
Е. Запишите наблюдения, уравнения реакций: получения этилена, взаимодействия его с бромной водой и раствором перманганатом калия, горения этилена. Объясните, почему этилен горит ярким пламенем в отличие от бытового газа.
Опыт 2. Изучение свойств полиэтилена
А. В пробирку с перманганатом калия, бромной водой поместите измельченные кусочки полиэтилена. Наблюдайте, происходит ли изменение окраски растворов. Действуют ли эти вещества на полимер?
Б. Отношение к кислотам и щелочам (опыт проводить под тягой).
В три пробирки налейте концентрированные растворы кислот (серной, соляной или азотной) и щелочи, поместите кусочки полиэтилена. Наблюдайте, действуют ли эти вещества на полимер. Пробирку с серной кислотой нагрейте до появления признаков реакции.
Сделайте вывод о взаимодействии полимера с кислотами и щелочами при обычной температуре и при нагревании, какими химическими свойствами обладает полимер. Результаты опыта занести в табл. 9.5.
|
|
|
|
|
|
|
Таблица 9.5 |
|
Результаты опыта |
|
|
|
|||
|
|
|
|
|
|
|
|
№ пробирки |
|
Действие растворов и растворителей |
|
||||
кислоты |
|
щелочи |
|
спирта |
|
ацетона |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
83
В. Отношение к нагреву, горение
!этилен капает расплавленным материалом, при попадании на кожу вызывает ожоги.Опыт проводить под тягой, соблюдая осторожность, горящий поли-
Кусочек полиэтилена положите на асбест и нагрейте на плитке при минимальной мощности. При помощи стеклянной палочки попытайтесь изменить форму изделия. Отметьте поведение полимера при нагревании. Какое свойство лежит в основе данного явления? К какой группе полимеров относится полиэтилен, где применяется данное свойство?
Подожгите образец и обратите внимание: на цвет пламени, характер горения, горит ли он вне пламени, на запах продуктов горения, на образование копоти. Результаты занесите в табл. 9.6.
Таблица 9.6
Отношение полиэтилена к нагреванию, горение
Отношение |
Способность |
Цвет |
Характер |
Запах |
Вид |
|
к нагреванию |
к воспламенению |
пламени |
горения |
остатка |
||
|
||||||
|
|
|
|
|
|
По результатам опытов сделайте вывод: о химической активности полимера, объясните, почему свойства полиэтилена отличаются от свойств этилена. Запишите: реакцию получения полиэтилена, формулы: мономера, структурного звена. Определите молярную массу полиэтилена.
Опыт 3. Изучение свойств полистирола
А. Растворимость.
В две пробирки с 2–3 мл бензола (или дихлорэтана) поместите измельченные кусочки полистирола. Наблюдайте при встряхивании происходящие в пробирке изменения с полимером. Смажьте полученным вязким раствором концы пластинок полистирола и, положив их одна на другую, сдавите пальцами или поместите под груз. Через некоторое время пластинки оказываются склеенными.
Б. Отношение к нагреву, горение.
Нагрейте несильно кусочек полистирола над пламенем горелки или на асбестовой сетке (см. опыт 2). Проверьте, легко ли он изменяет форму и сохраняет ли после охлаждения. Сравните по термопластичности полистирол с полиэтиленом.
84
Подожгите кусочек полистирола. Проверьте, горит ли он вне пламени, образуется ли при этом копоть, обладают ли продукты горения запахом. Запишите результаты наблюдения в табл. 9.10.
|
|
|
|
|
|
Таблица 9.10 |
|
Отношение полистирола к нагреву, горение |
|
|
|||||
|
|
|
|
|
|
|
|
Отношение |
Способность |
|
Цвет |
Характер |
Запах |
|
Вид |
к нагреванию |
к воспламенению |
пламени |
горения |
|
остатка |
||
|
|
||||||
|
|
|
|
|
|
|
|
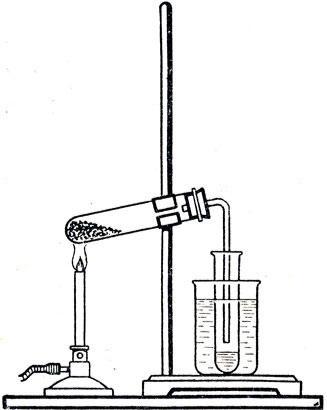
В. Разложение при нагревании (деструкция). |
|
|
|
||||
Мелкие кусочки неокрашенно- |
|
|
|
|
|
||
го полистирола поместите в про- |
|
|
|
|
|
||
бирку, и соберите прибор, как по- |
|
|
|
|
|
||
казано на рис. 9.3. Нагревайте |
|
|
|
|
|
||
пробирку постепенно на голом |
|
|
|
|
|
||
пламени. Наблюдайте за изме- |
|
|
|
|
|
||
нениями полистирола. Обра- |
|
|
|
|
|
||
зующийся при разложении поли- |
|
|
|
|
|
||
мера стирол |
конденсируется |
в |
|
|
|
|
|
приемнике – пробирке, охлаж- |
|
|
|
|
|
||
даемой водой. Примесями он ок- |
|
|
|
|
|
||
рашен в желтый цвет (опыт не |
|
|
|
|
|
||
следует доводить до разложе- |
|
|
|
|
|
||
ния всего полимера, так как при |
|
|
|
|
|
||
этом образуется много побоч- |
|
|
|
|
|
||
ных продуктов). Для более ров- |
|
|
|
|
|
||
ного кипения жидкости поместите |
|
|
|
|
|
||
в пробирку очень немного чисто- |
|
|
|
|
|
||
го речного песка; перегонку и в |
|
|
|
|
|
||
этом случае не доводите до кон- |
|
|
|
|
|
||
ца. Испытайте полученный сти- |
|
|
|
|
|
||
рол бромной водой и раствором |
Рис. 9.3. Деполимеризация полистирола |
||||||
марганцовокислого калия. |
|
|
|
|
|
|
|
Составьте уравнения реакции полимеризации стирола, деполимеризации полистирола и взаимодействия стирола с бромной водой (рис. 9.3).
85
! Опыт проводить под тягой
Опыт 4. Изучение свойств полиметилметакрилата (органического стекла).
А. В пробирку с бромной водой поместить мелкие кусочки полимера. Наблюдайте, происходит ли изменение окраски раствора? Наблюдение запишите в табл. 9.11. Повторите опыт с раствором перманганата калия, наблюдения занесите в табл. 9.11.
Таблица 9.11
Отношение полиметилметакрилата к нагреванию, горение
Отношение |
Способность |
Цвет |
Характер |
Запах |
Вид |
|
к нагреванию |
к воспламенению |
пламени |
горения |
остатка |
||
|
||||||
|
|
|
|
|
|
Б. Отношение к нагреву, горение.
Установите опытным путем, является ли данный полимер термопластичным. Подожгите кусочек полиметилметакрилата. Проверьте, горит ли полимер вне пламени, выделяется ли при горении копоть, какой окраски пламя. Обратите внимание на слабое потрескивание при горении и образующийся запах. Запишите результаты наблюдения в табл. 9.11.
В. Деструкция полиметилметакрилата.
Опыт выполните, как описано для полистирола. Деполимеризация полиметилметакрилата идет легче, мономер образуется более чистым и с большим выходом. Проверьте отношение мономера к бромной воде и раствору марганцовокислого калия.
86
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Коровин, Н.В. Общая химия [Текст] : учебник для технических направ. и спец. вузов / Н.В. Коровин. – М. : Высш. шк., 2009. – 558 с.
2.Глинка, Н.Л. Общая химия [Текст] : учебник для вузов / Н.Л. Глинка. – Л. : Химия, 2011. – 650 с.
3.Глинка, Н.Л. Задачи и упражнения по общей химии [Текст] : учеб. пособие для вузов / Н.Л. Глинка ; под ред. В.А. Рабиновича, Х.М. Рубиной. – Л. : Химия, 2006. – 280 с.
4.Киреев, В.В. Высокомолекулярные соединения [Текст] : учебник для вузов / В.В. Киреев. – М. : Высш. шк., 2013.
5.Зимон, А.Д. Коллоидная химия [Текст] : учебник для вузов / А.Д. Зимон, Н.Ф. Лещенко. – М. : Агар, 2003. – 320 с.
6.Ахметов, Н.С. Общая и неорганическая химия [Текст] : учебник для вузов / Н.С. Ахметов. – М. : Высш. шк., 2001. – 743 с.
7.Киреев, В.А Курс химии [Текст] : учебник для вузов / В.А. Киреев. – М. : Высш. шк., 1975. – 236 с.
8.Толстоусов, В.Н. Задачник по количественному анализу [Текст] : учеб. пособие для вузов / В.Н. Толстоусов, С.М. Эфрос. – Л. : Химия, 1986. – 160 с.
9.Зверев, В.М. Физико-химические представления о прочности и разрушении материалов в учебном курсе строительного материаловедения / В.М. Зверев // Труды Псковского политехнического института. – Псков : Изд-во ППИ, 2011. – № 14.2. – С. 113–116.
87
СОДЕРЖАНИЕ |
|
ВВЕДЕНИЕ .................................................................................................... |
3 |
Общие правила работы в химической лаборатории .................................. |
4 |
Лабораторная работа № 1. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.................... |
5 |
1.1. Теоретические сведения.................................................................. |
5 |
1.2. Примеры решения задач.................................................................. |
7 |
1.3. Индивидуальные задания ................................................................ |
9 |
1.4. Экспериментальная часть.............................................................. |
12 |
Лабораторная работа № 2. ГИДРОЛИЗ СОЛЕЙ ....................................... |
14 |
2.1. Теоретическая часть ...................................................................... |
14 |
2.2. Примеры решения задач................................................................ |
18 |
2.3. Индивидуальные задания .............................................................. |
20 |
2.4. Экспериментальная часть.............................................................. |
22 |
Лабораторная работа № 3. ОСНОВНЫЕ ХИМИЧЕСКИЕ ПОКАЗАТЕЛИ |
|
ВОДЫ ............................................................ |
24 |
3.1. Теоретическая часть ...................................................................... |
24 |
3.1.1. Жесткость воды...................................................................... |
24 |
3.1.2. Щелочность и кислотность .................................................... |
27 |
3.2. Примеры решения задач................................................................ |
29 |
3.3. Индивидуальные задания .............................................................. |
29 |
3.4. Экспериментальная часть.............................................................. |
32 |
Лабораторная работа № 4. АДСОРБЦИЯ КРАСИТЕЛЯ |
|
МЕТИЛЕНОВОГО ГОЛУБОГО |
|
НА АКТИВИРОВАННОМ УГЛЕ..................... |
35 |
4.1. Теоретические сведения................................................................ |
35 |
4.2. Примеры решения задач................................................................ |
41 |
4.3. Индивидуальные задания .............................................................. |
45 |
4.4. Экспериментальная часть.............................................................. |
48 |
Лабораторная работа № 5. КОЛЛОИДНЫЕ РАСТВОРЫ ......................... |
50 |
5.1. Теоретическая часть ...................................................................... |
50 |
5.2. Примеры решения задач................................................................ |
57 |
5.3. Индивидуальные задания .............................................................. |
58 |
5.4. Экспериментальная часть.............................................................. |
61 |
Лабораторная работа № 6. ХИМИЧЕСКИЕ СВОЙСТВА |
|
КОНСТРУКЦИОННЫХ МЕТАЛЛОВ |
|
И ИХ СОЕДИНЕНИЙ .................................... |
62 |
6.1. Теоретические сведения................................................................ |
62 |
6.2. Экспериментальная часть.............................................................. |
65 |
Лабораторная работа № 7. ХИМИЧЕСКИЕ СВОЙСТВА СОЕДИНЕHИЙ, ... |
|
ПРИМЕНЯЕМЫХ В СТРОИТЕЛЬСТВЕ ....... |
67 |
7.1. Теоретические сведения................................................................ |
67 |
7.2. Экспериментальная часть.............................................................. |
70 |
88
Лабораторная работа № 8. ОПРЕДЕЛЕНИЕ АКТИВНОСТИ |
|
КАЛЬЦИЕВОЙ ИЗВЕСТИ ............................. |
71 |
8.1. Теоретические сведения................................................................ |
71 |
8.1.1. Воздушная известь................................................................. |
72 |
8.1.2. Гидравлическая известь ........................................................ |
74 |
8.2. Экспериментальная часть.............................................................. |
75 |
Лабораторная работа № 9. ПЛАСТМАССЫ .............................................. |
77 |
9.1. Теоретические сведения................................................................ |
77 |
9.1.1. Наполнители и добавки ......................................................... |
79 |
9.1.2. Свойства пластмасс и области их применения.................... |
80 |
9.2. Индивидуальные задания .............................................................. |
81 |
9.3. Экспериментальная часть.............................................................. |
83 |
БИБЛИОГРАФИЧЕСКИЙ СПИСОК ............................................................ |
87 |
89
Учебное издание
Муромцева Елена Владимировна
ПРАКТИЧЕСКАЯ ХИМИЯ
Методическое пособие по выполнению лабораторных работ
Редактор А.А. Иванова
Технический редактор С.С. Заикина
————————————————————————————
План 2015 г. Поз. 9.31. Подписано в печать 21.01.2015. Уч.-изд. л. 5,7. Усл. печ. л. 5,3. Зак. 12. Тираж 50 экз. Цена 335 руб.
————————————————————————————
Издательство ДВГУПС 680021, г. Хабаровск, ул. Серышева, 47.
90
