
- •Химическая связь и строение химических соединений
- •Химическая связь
- •Характеристика химической связи
- •Характеристика химической связи
- •Типы химической связи
- •Ковалентная связь – …
- •Ковалентная связь
- •Различия между полярностью химической связи и полярностью молекулы
- •Метод валентных связей
- •Донорно-акцепторный механизм образования ковалентной связи
- •Кратность ковалентной связи
- •Насыщенность – …
- •Гибридизация
- •Ионная связь
- •Определение степени ионности связи по значениям ЭО атомов
- •Сравнительная характеристика ионной и ковалентной связи
- •Металлическая связь
- •Водородная связь – …
Химическая связь и строение химических соединений
Лекция №3 Лектор: Махачкеева Татьяна Александровна

Химическая связь
Валентность – способность атома присоединять определённое число других атомов с образованием молекулы.
Обозначают: Н– одновалентный О= двухвалентный
Н–О–Н
Химическая связь – вид взаимодействия в молекулах, ионах, кристаллах, характеризуемый определённой энергией, обусловливающей существование двух и многоатомных соединений.

Характеристика химической связи
Валентный угол
– угол между воображаемыми линиями, проходящими через ядра химически связанных
атомов.
Обозначается
Длина связи –
межъядерное
расстояние между химически связанными
атомами.
Обозначается ℓ
Н–Н
О
Н 104º Н
Энергия связи –
энергия которую надо затратить, чтобы разрушить химическую связь (прочность связи) Обозначается Есв

Характеристика химической связи
Связь образуется только в том случае, если
полная энергия системы при сближении
атомов понижается – условие образования
химической связи.
Еn = Екин + Епотенц

Типы химической связи
ионная
металлическая
ковалентная
водородная

Ковалентная связь – …
… химическая связь преобразование которой возникает одна или несколько электронных пар, в одинаковой степени принадлежащих взаимодействующим атомам.
Ковалентная связь
Полярная Неполярная
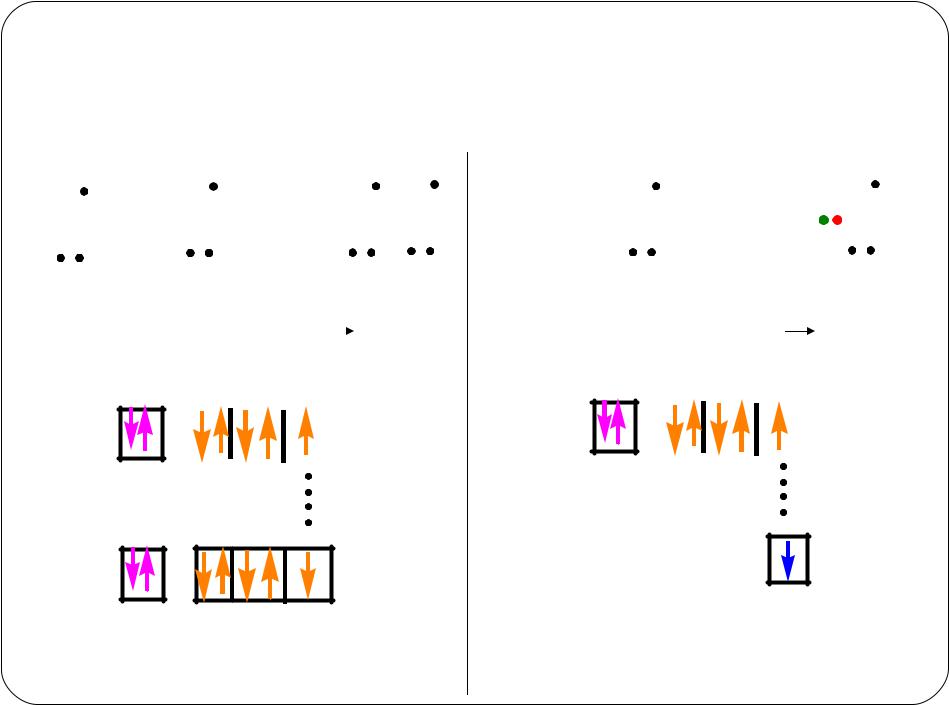
Ковалентная связь
неполярная |
полярная |
 F
F


 F
F


 F
F

 F
F
 H
H

 F
F

 H F
H F

F – F или F F |
H – F или H F |
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
F2 |
F |
|
|
|
|
|
|
|
|
|
|
+ – |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HF |
F |
|
H |
2s |
2p |
1s |
|

Различия между полярностью химической связи и полярностью молекулы
Для двухатомных молекул величина d связи является мерой полярности молекул в целом. Для многоатомных молекул d равен векторной сумме d моментов отдельных связей.
Теория валентных связей
Н • • Н
Условием образования молекулы из атомов является уменьшение энергии системы – выполняется при перекрывании валентных орбиталей, содержащих неспаренные электроны с антипараллельными спинами.

Метод валентных связей
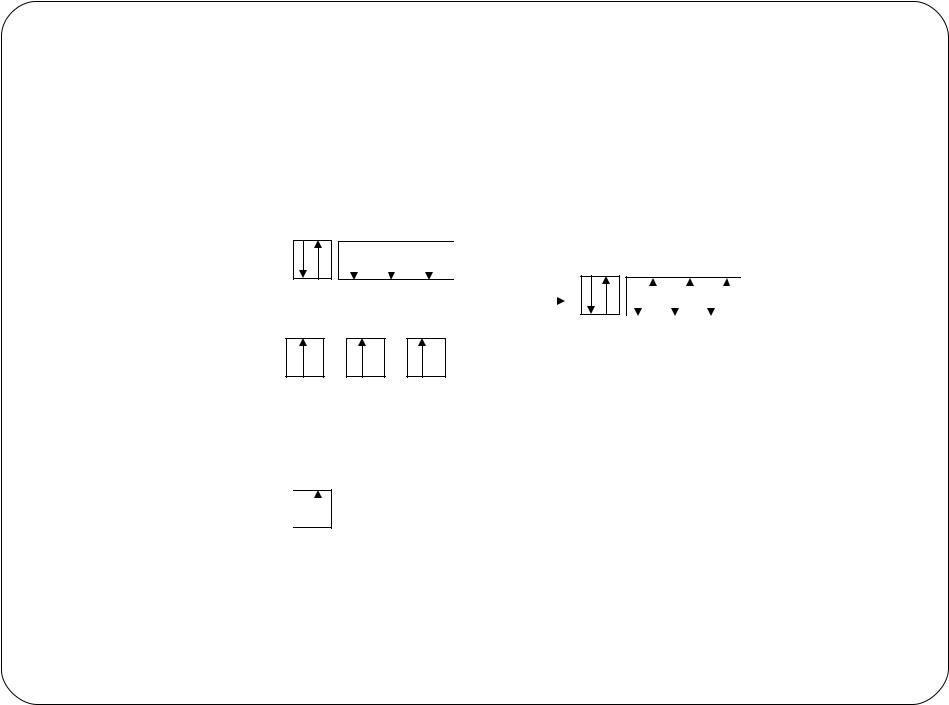
Донорно-акцепторный механизм образования ковалентной связи
А: + В → А – В
донор акцептор
N 2s2sp3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
:NH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H 1s1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
ОбразованиеNH4+ Н+ + NH3 
 [NH4]+
[NH4]+
