
- •Второй закон Рауля
- •Билет 12
- •18. Пространственное строение комплексных соединений. Классы комплексных соединений: внутрикомплексные, анионные, катионные нейтральные.
- •34. Окислительно-восстановительные системы. Окислительно-восстановительные потенциалы, механизмы их возникновения, биологическое значение.
- •Вопрос №21. Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов 1а- и 2а-групп. Биологическая роль натрия, калия, магния, кальция.
- •Вопрос 23. Химия элементов p-блока
- •24 Вопрос. Адсорбционные равновесия и …
Билет 12
Для неэктролитов i=1,
Для электролитов I больше 1, причем с разбавлением раствора I растет , приближаясь к целым числам
До Арениуса:диссоциация на ионы под действием i
Арениус: диссоциация молекул электролитов на ионы происходит уже в процессе растворения.
Диссоциация обратима: наряду с распадом на ионы-обратный процесс рекомбинации: образование из ионов молекул = устанавливается ионное равновесие)
Сильные электролиты: практически полностью диссоциируют: альфа = 30%
Слабые электролиты не полностью : альфа равна 3-5%
Kp=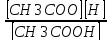
CH3COOHCH3COO + H
Закон Оствальда:
Kd
Альфа: 1.8 *10 в – 9
KD = 1.8 * 10 d -16
Активность)
Эффективная конц. в соответсвии с кислотой участвует в различных процессах
А=

Гамма- коэффицет активности
Ионная сила раствора) -I
I– полусумма произведений концентраций всех ионов раствора на квадрат заряда I=1/2 ECn*Z(в квадрате)n
Биологические жидкости сожержат много элементов NaCl KCL HCL CaCl2 NaH2PO4
Организм теряет воду и электролиты с мочей, при этом конц. элементов примерно постоянна( ионный гомеостаз)
Слюна как электролит является сложной биохим. Средой: вода, мин. Соли, орг. Вещ-ва
15 вопрос. Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия.
ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ Автопротолиз ‒ обратимый процесс передачи протона от одной нейтральной молекулы протонного растворителя к другой с образованием равного числа катионов и анионов. Жидкие протонсодержащие растворители (например, вода и аммиак) могут выступать и как основание, и как кислота, вступая в обратимую реакцию автопротолиза, например:
H2O + H2O ↔ OH‒ + H3O+
Состояние равновесия в таких реакциях характеризуется ионным произведением воды (КВ), численно равным произведению равновесных концентраций ионов гидроксония (H3O+) и гидроксид‒анионов (при стандартных условиях эта величина равна 10‒14). Автопротолиз характерен не только для воды, но и для других протонных растворителей, молекулы которых связаны между собой водородными связями (например, для аммиака NH3 и фтороводорода HF):
NH3 + NH3 ↔ NH4+ + NH2-
HF + HF ↔ H2F+ + F-
Амфолит (амфотерный электролит) ‒ электролит, выполняющий функции как кислот, так и оснований, способный диссоциировать как по механизму кислот (с отщеплением ионов водорода Н+), так и по механизму оснований (с отщеплением гидроксид‒ионов ОН‒), например, вода: Н2О ↔ Н+ + ОН‒. Продукты диссоциации также могут быть отнесены как к кислотам, так и к основаниям
Вода проявляет свойства как кислоты, так и основания. Вода усиливает кислотно ‒ оснόвные свойства растворенных веществ. При растворении в воде оснований она выполняет роль кислоты. Молекула воды (Н2О), выступая в роли слабой кислоты и реагируя с другой молекулой как со слабым основанием (в результате переноса протона от воды основанию), образует сильное сопряженное основание (ОН‒) и сильную сопряженную кислоту (Н3О+): Н2О + Н2О ↔ H3O+ + OH‒ [более сильной кислоты, чем (Н3О), и более сильного основания, чем (ОН‒) в воде не существуют]. Аналогичная ситуация возникает и при растворении серной кислоты в воде: кислота превращается в сопряженное основание, а вода (основание) ‒ в сопряженную кислоту (образуются ион гидроксония ‒ и бисульфат‒анион). Константа диссоциации воды ‒ около 2*10‒16 моль/л (при 25 oC). Концентрация молекул воды (H2O) в чистой воде практически постоянна (равна 55 моль/л). Соляная кислота (HCl) при растворении в воде также отдает протоны молекулам воды [при этом образуются анион хлора (Cl‒) и ионы гидроксония, H3O+]. При обмене протонами между соляной кислотой и водой кислота ведет себя в воде как сильная кислота
Взаимодействие кислотно‒оснόвное ‒ процесс передачи протона. Четкого деления веществ на кислоты и основания нет, так как вещества, потенциально способные быть кислотами, становятся ими только в присутствии основания, и наоборот. В любом кислотно-основном взаимодействии участвуют две пары сопряженных кислот и оснований (протолитов), т.е. кислотно-основное взаимодействие представляет собой двойное протолитическое равновесие.
Гидроксоний ‒ гидратированная форма протона ‒ (Н3О+). Как и все ионы, гидроксил и гидроксоний присутствуют в воде в гидратированной форме.
Катион водорода ‒ это протон (ядро атома водорода, полностью лишенное электронной оболочки), т.е. нехимическая частица (этим он отличается от всех остальных ионов). Вследствие этого катион не может существовать в химических системах как отдельная частица, а может только передаваться от одной частицы к другой. Так как молекула основания является акцептором протона, то кислоты и основания могут быть анионные, молекулярные и катионные.
Пара протолитическая (кислотно‒оснόвная) ‒ пара веществ, состоящая из кислоты и соответствующего основания (каждый ее отдельный компонент называется протолитом), например: (NH+4 ↔ H+ + NH‒3); (H2CO3 ↔ H+ + HCO‒3). Донорами протонов могут быть как нейтральные молекулы, так и ионы. Например, фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона H2PO4-(донора протонов) и иона НРО42- (акцептора протонов): H2PO4 ↔ H+ + HPO42- . Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли - двузамещенный фосфат Na2HPO4
Протолиз ‒ процесс, лежащий в основе кислотно‒оснόвного катализа, представляющий собой перенос протона от реагента (основания или кислоты) к катализатору или от кислоты к основанию.
Протолитическая теория ‒ протонная теория кислот и оснований, в соответствии с которой кислота и основание составляют сопряженную пару. Согласно протолитической теории
к кислотам относятся:
▪ нейтральные молекулы [например, HCl ↔ H+ + Cl‒, H3PO4 ↔ H+ + H2PO4‒ ; в том числе нейтральные аквакомплексы, например, [PtCl4(H2O) 2] ↔ 2Н+ + [PtCl4(OH)2]2‒]
▪ анионные кислоты [например, Н2РО4‒ ↔ Н+ + НРО42‒ , HРО42‒ ↔ Н+ + РО43‒, HSO4‒ ↔ H+ + SO42‒]
▪ катионные кислоты [например, NH4+ ↔ H+ + NH3; H3O + ↔ H+ + H2O; в том числе комплексные катионные кислоты: например, [Al(H2O) 6]3+ ↔ H+ + [Al(H2O)5(OH)]2+]
а к основаниям относятся:
▪ нейтральные молекулы [например, NH3 + H+ ↔ NH4+]
▪ анионные основания [например, СО32‒ + Н+ ↔ НСО3‒, РО43‒ + Н+ ↔ НРО42‒; ОН‒ + Н+ ↔ H2О]
▪ катионные основания [например, N2H5+ + H+ ↔ N2H62+]
Протолиты ‒ кислоты и основания, отдающие и принимающие протоны (т.е. вещества, участвующие в реакциях переноса протона). С точки зрения протолитической теории соли состоят из двух протолитов: катионных кислот и анионных оснований. После отщепления от одних протолитов протоны сразу присоединяются к другим протолитам. Типичным протолитом является сульфид-ион (S2-) - анион (неустойчивой, одной из самых слабых кислот) сероводородной кислоты, представляющей собой раствор сероводорода (H2S) в воде.
Протолиты амфипротонные ‒ протолиты, обладающие как протонодонорными, так и протоноакцепторными свойствами (например, Н2О, НСО‒)
Протолиты в водном растворе ‒ растворенные в воде вещества, выполняющие по отношению к ней функции кислоты или основания.
Примечание. Молекула бензола С6Н6 ‒ классическое вещество‒непротолит. Не являются протолитами также некоторые распространенные анионы (Cl‒, Br‒, I‒, NO‒3, ClO‒4, SO2‒4, ClO‒3, MnO‒4 и др.) и некоторые гидратированные катионы металлов (Li+, Na+, K+, Rb+, Cs+, Ca2+, Sr2+, Ba2+, Tl+ и др.).
Протолиты сопряженные ‒ кислота и основание одной и той же протолитической пары
Примечания:
▪ В водных растворах кислот и оснований имеются по парe сопряженных кислот и оснований
▪ Так как свободные протоны не могут существовать в растворе несвязанными, они переходят от кислоты к основанию, образуя сопряженные кислоту и основание [например:
CH3COOH(кислота) + NH3(основание) ↔ CH3COO‒ (сопряженное основание) + NH4+(сопряженная кислота)].
Аналогично, при смешивании серной и уксусной кислот (играющей роль основания), образуются протонированная сопряженная уксусная кислота и сопряженное основание (бисульфат‒анион):
H2SO4 + CH3COOH ↔ CH3COOH(2+) + HSO(4−)
Равновесие автопротолиза воды - равновесие типа (H2O + H2O ↔ H3O+ + OH-)
Растворители протонные ‒ растворители, являющиеся протолитами по отношению к растворенным веществам. К ним относятся вода (Н2О), аммиак (NH3), фтороводород (HF) и др. Главным свойством протонных растворителей является способность их молекул к автопротолизу (такой растворитель является амфолитом по отношению к самому себе). В водных растворах протолитов‒кислот среда кислая (т.е. водородный показатель pH < 7 для такого раствора), а в водных растворах протолитов‒оснований среда щелочная (т.е. водородный показатель pH > 7 для такого раствора). В водных растворах веществ‒непротолитов среда нейтральная (рН = рОН = 7), но на практике растворы с близкой к нейтральной среде могут иметь (рН) от 6 до 8.
Реакции кислотно−основного взаимодействия являются протолитическими. В них всегда принимают участие кислота и сопряженное с ней основание. Чем сильнее кислота (основание), тем слабее сопряженное основание (кислота). Протекание таких реакций обусловлено межмолекулярным или внутримолекулярным переносом протона (обобществлении электронной пары основания) с изменением кислотных и основных свойств частиц соответствующих кислот и оснований (например, реакции [де] гидратации или гидролиза). Этим они отличаются от окислительно−восстановительных реакций, где молекулы окислителя полностью отнимают электроны у молекул восстановителя). Такие реакции чаще всего протекают в растворах (исключением является реакция образования кристаллического хлорида аммония из газообразного хлороводорода и аммиака: HCl(г) +NH3(г)= NH4Cl(кр) ) и используются для прямого количественного определения сильных и слабых кислот, оснований или их солей. В кислотно−основных реакциях растворитель играет активную или специфическую роль: он может реагировать с ионами и молекулами (при сольватация), а также проявлять кислотные и оснóвные свойства. Промежуточными активными частицами являются ионы (катализатор инициирует их образование в результате передачи протонов от катализатора к реагенту или от реагента к катализатору). В результате кислотно−основных реакций могут таже образовываться координационные соединения. Количественной характеристикой кислотно−основных реакций является их константа равновесия
Реакции протолитические − химические реакции, в которых происходит перенос протона от одних реагирующих веществ к другим, например:
NH3 + H2O = NH4+ + OH−
К протолитическим реакциям относят кислотно−основные реакции и реакции нейтрализации и гидролиза.
В соответствии с протолитической теорией кислот и оснований кислоты представляют собой атомно−молекулярные частицы, способные в обычных условиях к внутримолекулярной или межмолекулярной, полной или неполной передаче протона, а основания − частицы, способные в этих же условиях к присоединению протона, например:
NH3(осн.1) + H2O(кисл.2) = NH4+ (кисл.2)+ OH−(осн.2)
Сродство к протону ‒ энергия, высвобождающаяся в газофазной реакции между протоном и молекулой с образованием соответствующей сопряженной кислоты
Реакция гидролиза - необратимая химическая реакция взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц (относится к протолитическим реакциям). Реакции гидролиза записывают в виде:
а) молекулярного уравнения: KNO2 + H2O ↔ KOH + HNO2
б) ионного уравнения:
NO2− + H2O ↔ HNO2 + OH−
NH4+ + H2O = NH4ОН + Н+ [образующийся ион водорода обусловливает кислотную среду раствора, т. е. (рН) < 7].
Уравнение реакции гидролиза соли (гидролиз иона) на примере FeCl3 выглядит как (FeCl3 = Fe3+ + 3Cl−)
атиону).
Гидролиз солей это реакции между составными частями воды и солей, сопровождающиеся образованием малодиссоциированных соединений. Гидролизу могут подвергаться не только соли, но и другие растворенные вещества (углеводы, белки, жиры, эфиры и т.д.). Реакция гидролиза часто сопровождается изменением рН раствора. Если вместо воды используется иной растворитель, то процесс носит название сольволиз.
Гидролизу подвергаются соли, являющиеся производными слабых кислот или оснований. Соли, образованные сильными кислотами и основаниями, гидролизу не подвергаются.
1)Гидролиз солей, образованных сильной кислотой и слабым основанием (гидролиз по катиону). Для характеристики полноты протекания реакции используют понятие степень гидролиза (β) – отношение концентрации молекул, подвергшихся гидролизу (сгидр) к исходной концентрации растворенной соли (сисх):

Степень гидролиза зависит от: 1)химической природы ионов, составляющих соль; 2)концентрации соли; 3)температуры. Степень гидролиза увеличивается с уменьшением константы диссоциации слабой кислоты или основания, уменьшением концентрации соли и повышением температуры.
Гидролиз
протекает в заметной степени только в
разбавленных растворах
![]() ,
тогда следовательно
,
тогда следовательно
![]() ,Это
произведение называется константой
гидролиза (Кг):
,Это
произведение называется константой
гидролиза (Кг):

Из выражения (7.42) следует, что уменьшение силы основания ведет к увеличению константы гидролиза, а следовательно, и степени гидролиза.
Степень гидролиза увеличивается с уменьшением силы основания и концентрации соли. Повышение температуры сопровождается увеличением КW, что также ведет к росту β.
2)Гидролиз солей, образованных слабой кислотой и сильным основанием (гидролиз по аниону).
 где
Ккислота – константа диссоциации слабой
кислоты.
где
Ккислота – константа диссоциации слабой
кислоты.
3)Гидролиз солей, образованных слабой кислотой и слабым основанием (гидролиз по аниону и катиону)
Константа гидролиза в этом случае определяется константой диссоциации слабой кислоты и слабого основания:
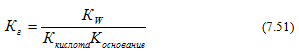
Реакции гидролиза играют важную роль в природных и производственных процессах. В водоочистке для удаления грубодисперсных и коллоидных примесей используют осадки гидроксидов алюминия и железа, получаемые гидролизом сульфатов железа (FeSO4.7H2O; Fe2(SO4)3.9H2O), алюминия Al2(SO4)3.18H2O), или хлорида железа (FeCl3.6H2O). Для обеспечения полноты протекания гидролиза растворы подщелачивают. Важной стадией процесса пищеварения является гидролиз пищи в желудочно-кишечном тракте. Энергия в живых организмах запасается, в основном, в виде АТФ (аденозинтрифосфорная кислота) и выделяется при ее гидролизе.
Алкалиметрия и ацидиметрия — важнейшие титриметрические методы определения кислот или же оснований, основанные на реакции нейтрализации:
Н+ + ОН− = Н2О
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией.
17. Лигандообразовательные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационные числа, дентантность.
Комплексными соединениями называют такие вещества, молекула которых состоит из центрального атома (иона), связанного с определенным числом n других молекул (ионов), называемых лигандами.
Теория Вернера:
-
В каждой комплексной молекуле есть центральный атом комплексообразователь, которыми чаще всего бывают катионы металлов или атомы металлов.
-
Вокруг комплексообразователя координируются молекулы или ионы. Одни из них располагаются непосредственно около центрального атома и представляют собой внутреннюю сферу. Другие формируют внешнюю сферу.
-
Ионы или молекулы, занимающие внутреннюю сферу, называются лигандами.
-
Ионы, находящиеся во внешней сфере, связаны с комплексообразователем ионной связью. Поэтому в воде происходит их диссоциация.
Координационное число – число всех связей комплексообразователя со своими лигандами. Координатное число определяется зарядом, размерами, строение электрической конфигурации комплексообразователя и лиганда.
Названия комплексных соединений образуют, называя сначала анион в миенительном падеже, а затем катион в родительном падеже. В комплексном соединении сначала называют лиганды - ионы, давая им окончание «о», затем называют лиганды – нейтральные молекулы.
Пример: дигидроксотетрахромплатинат (IV) аммония.
Общая формула комплексных соединений: [M(L)n]z-nx, Mz+ - атом комплексообразователь, Lх- - лиганд.
В реакции комплексообразователя лиганды являются основаниями Льюиса. В ходе реакции комплексообразования происходит перенос электронной пары, т.е. образование ковалентной связи по донорно-акцепторному механизму:
Mz+ +nLx- = [M(L)n]z-nx
Дентатность – число донорных атомов лиганда, способных одновременно принимать участие в координации.
Лиганды, образующие только одну σ-связь с атомом –комплексообразователем, называют монодентатными. (Дентантность – от лат. имеющий зубы). Монодентантные лиганды могут «укусить» комплексообразователь только одним «зубом», т.е образовать одну связь. Координационное число комплексообразователя равно числу лигандов только в том случае, если все лиганды монодентанты.
Если 2 связи, то лиганды называются бидентантными. Аналогично тридентантные, тетрадентантные и полидентантные лиганды.
