
11
8Ar + 46H2O → 8Ar ∙ 46H2O,
Ar + 2CH3COCH3 + 17H2O → Ar ∙ 2CH3COCH3 ∙ 17H2O,
Ar + 4C6H5OH → Ar ∙ 4C6H5OH,
Ar + 3C6H4(OH)2 → Ar ∙ 3C6H4(OH)2,
Ar + 2HCl → Ar ∙ 2HCl,
Ar + 2HBr → Ar ∙ 2HBr.
2. Образование эксимерных молекул из возбужденных атомов. Разложение эксимерных молекул сопровождается излучением с малой длиной волны. На этом эффекте работают лазеры, генерирующие излучение 193 нм (ArF) и 558 нм (ArO).
Применение
Используют в качестве защитной атмосферы при сварке, при получении металлов и других металлургических процессах, как наполнитель в газоразрядных трубках и люминесцентных лампах, в тиратронах, в ионизационных счетчиках, в качестве газа-носителя в газовой и газо-жидкостной хроматографии.
© 2013 – 2014 А.А.Сибиркин
12
Криптон История открытия и исследования
Выделен в 1898 году У.Рамзаем и М.Траверсом из сжиженного воздуха. Название происходит от греч. κρυπτον – скрытый, спрятанный.
Строение атома и валентные возможности
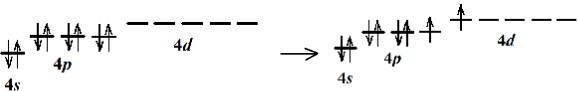
Электронная конфигурация 4s24p6. Достаточно большой размер атома по сравнению с атомами гелия, неона и аргона допускает возможность перемещения 4p-электрона на 4d-орбиталь. Она реализуется при образовании производных криптона (+2).
Изотопный состав |
|
|
|
|
Природный |
криптон |
состоит |
из шести изотопов: |
|
78Kr (0.354 %), |
80Kr (2.27 %), |
82Kr (11.56 %), |
83Kr (11.55 %), |
|
84Kr (56.90 %) и |
86Kr (17.37 %). Эти |
и другие, |
радиоактивные, |
|
изотопы криптона образуются при спонтанном делении ядер урана
235U и 238U.
Нахождение в природе
Содержится в атмосфере 1.14 ∙ 10−4 % (об.). Встречается в газах урансодержащих минералов (2.5 – 3 %).
© 2013 – 2014 А.А.Сибиркин
13
Простое вещество криптон
Получение
Получают фракционной перегонкой жидкого воздуха. Накапливается в жидком кислороде при отделении от него азота. При отгонке кислорода криптон и ксенон накапливаются в оставшихся высококипящих фракциях (криптон-ксеноновый концентрат). Этот концентрат разогревают, с тем чтобы оставшийся в криптон-ксеноновой смеси кислород окислил накопившиеся в этой смеси углеводороды до углекислого газа. После отделения CO2 действием щелочей смесь охлаждают до −80 °С и пропускают через слой активированного угля. Из адсорбера выходит очищенный криптон. Дополнительное количество криптона получается при фракционной десорбции, проводимое постепенным повышением температуры поглотителя.
Строение
Одноатомная молекула.
Физические свойства
Бесцветный газ без запаха. Пл. −157.3 °C, кип. −153.2 °C.
Химические свойства
1. Образование соединений включения с водой и органическими растворителями.
8Kr + 46H2O → 8Kr ∙ 46H2O (15 атм при 0 °С, разл. −28 °C), 2.14Kr + 12C6H5OH → 2.14Kr ∙ 12C6H5OH,
2Kr + CCl4 + 17H2O → 2Kr ∙ CCl4 ∙ 17H2O.
2. Образование эксимерных молекул. Их самопроизвольное разложение на атомы сопровождается излучением с длиной волны
222 нм (KrCl*), 248 нм (KrF*), 420 нм (Kr2F*). Эти процессы используются в эксимерных лазерах.
© 2013 – 2014 А.А.Сибиркин
14
3. Восстановительные свойства. Проявляются по отношению к фтору.
Kr + F2 → KrF2 (ниже −78 °С, электрический разряд)
Применение
Криптон используют для наполнения ламп накаливания, газоразрядных и рентгеновских трубок. Радиоактивный изотоп 85Kr используют как источник β-излучения в медицине, для обнаружения течи в вакуумных установках, как изотопный индикатор при исследовании коррозии металлов, для контроля износа деталей.
© 2013 – 2014 А.А.Сибиркин
|
15 |
|
|
Соединения криптона (+2) |
|
KrF2 |
KrF+ |
Kr2F3+ |
дифторид |
производные |
производные |
криптона |
фторокриптония (II) |
трифтородикриптония (II) |
Получение
1. Взаимодействие простых веществ в условиях ультрафиолетового облучения или электрического разряда при температуре кипения жидкого азота (−196 °С).
Kr + F2 → KrF2.
2. Обменные реакции с бинарными фторидами элементов, обладающими сильными электроноакцепторными свойствами (кислотами Льюиса). В результате взаимодействия от молекулы KrF2 отщепляется ион F−, который переходит в состав аниона. С этим анионом образует ионную связь оставшаяся частица KrF+.
|
AsF5 |
|
(KrF+)[AsF6−] |
|
|
SbF5 |
|
(KrF+)[SbF6−] |
|
KrF2 + |
SbF5 |
→ |
(KrF+)[Sb2F11−] |
(−20 °С) |
NbF5 |
(KrF+)[Nb2F11−] |
(−20 °С) |
||
|
TaF5 |
|
(KrF+)[Ta2F11−] |
(−20 °С) |
|
BrF5 |
|
(KrF+)[BrF6−] |
|
Синтез протекает при доведении сильно охлажденной смеси исходных бинарных фторидов до указанной (комнатной по умолчанию) температуры.
Избыток KrF2 способствует получению производные трифтородикриптония (II) Kr2F3+, являющегося продуктом присоединения KrF2 к иону KrF+.
KrF2 + |
AsF5 |
→ |
(Kr2F3+)[AsF6−] |
SbF5 |
(Kr2F3+)[SbF6−] |
3. Действие дифторида криптона на малоактивные металлы приводит к образованию на первой стадии их фторидов, часто в уникально высоких степенях окисления. Образующиеся на этом этапе бинарные фториды проявляют за счет высокой степени
© 2013 – 2014 А.А.Сибиркин
16
окисления металла свойства кислот Льюиса и вступают далее во взаимодействие с фторидом криптона, проявляющим функцию основания Льюиса (см. п. 2). Общим результатом является образование производных фторокриптония (II).
7KrF2 + 2Au → 2(KrF)[AuF6] + 5Kr (20 °С, в безводном HF)
Строение
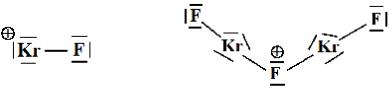
Дифторид криптона – линейная молекула. Такое (аксиальное) расположение атомов обеспечивают три электронные пары атома криптона, занимающие экваториальные положения, что полностью соответствует представлениям Гиллеспи. В кристаллической
тетрагональной решетке молекулы KrF2 образуют слои. |
и |
||
Для |
производных |
фторокриптония (II) |
|
трифтородикриптония (II) характерно образование ионной связи. Первый их этих катионов является линейным, так как он состоит из двух атомов. Второй катион, согласно модели Гиллеспи, должен содержать мостиковый атом фтора в состоянии sp3-гибридизации, что обусловливает угловую форму катиона Kr2F3+. Три электронные пары атома криптона обеспечивают развернутый угол связи F−Kr−F.
Анионы этих ионных производных представляют собой в основном изолированные октаэдры, например, SbF6−, или сдвоенные октаэдры с общей вершиной, например, Ta2F11−.
Физические свойства
Фторид криптона KrF2 – бесцветные кристаллы с резким запахом, возг. –40 °C. Растворяется в жидких HF и BrF5.
Производные фторокриптония (II) и трифтородикриптония (II) несколько более устойчивы, чем дифторид криптона. Так, (KrF)[AuF6] желтого цвета разлагается при 47 °C.
© 2013 – 2014 А.А.Сибиркин
17
Химические свойства
1. Обменные реакции. Дифторид криптона – вещество основной (по Льюису и Усановичу) природы. Это обусловлено невысоким положительным условным зарядом атома крипттона Kr+2, подобным большинству катионов металлов.
1а. Процессы взаимодействия дифторида криптона, проявляющего свойства основного фторида, по отношению к фторидам и оксофторидам элементов, выступающих в роли кислотного начала. Примечательно, что в составе оксофторидных комплексах с к.ч. анионообразующего элемента, равным 6, сохраняется атом кислорода O−2, не затронутый окислением. См. также получение производных Kr+2, п. 2.
SbF5 |
(KrF+)[SbF6−] |
SbF5 |
(KrF+)[Sb2F11−] |
KrF2 + MnF4 |
→ (KrF+)2[MnF62−] |
MoOF4 |
(KrF+)[MoOF5−] |
WOF4 |
(KrF+)[WOF5−] |
1б. Замещение атомов фтора на тефлатный анион. Полученное соединение разлагается с выделением криптона:
3KrF2 + 2B(OTeF5)3 → 3Kr[OTeF5]2 + 2BF3, Kr[OTeF5]2 → Kr + F5TeOOTeF5.
2. Окислительные свойства. Дифторид криптона – сильнейший окислитель, часто превосходящий F2. Это обусловлено его способностью разлагаться с образованием атомов фтора. Продуктом восстановления производных Kr+2 является простое вещество криптон независимо от силы восстановителя.
2а. Внутримолекулярное окисление-восстановление. Так протекает термическое разложение дифторида криптона и его катионных производных. Термический распад обнаруживает прежде всего неустойчивость производных Kr+2, в то время как образующиеся фториды элементов в рекордно высоких степенях окисления сохраняются неразложившимися. По-видимому, выделяющийся при разложении фтор способствует дальнейшему окислению центрального атома аниона.
© 2013 – 2014 А.А.Сибиркин
|
18 |
|
KrF2 → Kr + F2 |
(при достижении 20 °C), |
|
(KrF)[AuF6] → AuF5 + Kr + F2 |
(выше 47 °С), |
|
(KrF)[Pt+5F6] → PtF6 + Kr + F2.
2б. Окисление соединений, содержащих атомы O−2, до простого вещества кислорода. Производные Kr+2 не совместимы с водой и щелочами, очень энергично реагируют с ними.
KrF2 + |
H2O |
→ Kr + O2 + |
HF |
NaOH |
NaF + H2O |
Окисление, по крайней мере частичное, возможно для атомов кислорода O−2 в составе оксофторидов.
(KrF)[AuF6] + 2XeOF4 → [XeOF4 · XeF5][AuF6] + Kr + ½O2.
2в. Окисление простых веществ и низших фторидов. Процесс обычно проводят при непосредственном контакте реагентов или в безводном жидком HF.
|
|
Xe |
|
XeF6 |
|
KrF2 + |
Au |
→ Kr + |
AuF5 |
|
|
Pr |
|
PrF4 |
|
|
I2 |
|
IF7 |
|
KrF2 + |
AgF |
→ Kr + |
AgF3 |
|
MnF2 |
MnF4 |
||
KrF2 + |
ClF3 |
→ Kr + |
ClF5 |
|
ClF5 + AsF5 |
(ClF6)[AsF6] |
|||
(KrF)[AuF6] + O2 → O2[AuF6] + Kr + F2 (20 °C)
Применение
Фторид криптона KrF2 – окислитель и фторирующий агент при получении соединений других элементов в наиболее высоких степенях окисления (например, AuF5), источник атомарного фтора.
© 2013 – 2014 А.А.Сибиркин
19
Ксенон История открытия и исследования
Выделен в 1898 году У.Рамзаем и М.Траверсом из сжиженного воздуха. Название происходит от греч. ξενον – чуждый, странный.
Ксенон является наиболее реакционноспособным среди природных нерадиоактивных инертных газов. Именно для этого элемента впервые для инертных газов были получены соединения с традиционными химическими связями (Н.Бартлетт, 1962).
Строение атома и валентные возможности
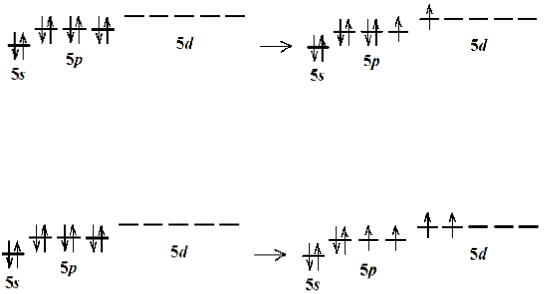
Электронная конфигурация 5s25p6 характеризуется завершенным электронным уровнем. Большой размер атома допускает возможность перемещения 5p-электронов и, далее, 5s- электрона на 5d-орбиталь. Она реализуется при образовании производных ксенона (+2). Атом ксенона Xe+2 обладает тремя неподеленными электронными парами и может образовать ковалентные связи с двумя атомами.
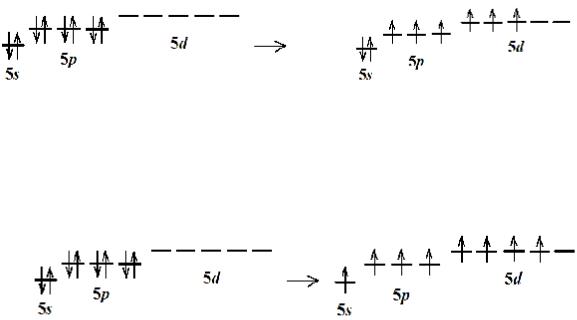
Производные ксенона (+4) образуются при распаривании двух электронов. Атом ксенона Xe+4 обладает двумя неподеленными электронными парами и может образовать ковалентные связи с четырьмя атомами.
Производные ксенона (+6) образуются при распаривании трех электронов. Атом ксенона Xe+6 обладает одной неподеленной электронной парой и может образовать ковалентные связи с шестью атомами.
© 2013 – 2014 А.А.Сибиркин
20
Производные ксенона (+8) образуются при распаривании всех электронов. Атом ксенона Xe+8 не имеет неподеленных электронных пар и, несмотря на то, что он может образовать ковалентные связи с восемью атомами, число соседей Xe+8 обычно не превышает шести.
Изотопный состав |
|
|
|
Природный |
ксенон состоит из девяти изотопов: |
||
124Xe (0.096 %), |
126Xe (0.090 %), 128Xe (1.92 %), |
129Xe (26.44 %), |
|
130Xe (4.08 %), 131Xe (21.18 %), |
132Xe (26.89 %), |
134Xe (10.44 %) и |
|
136Xe (8.87 %). |
Эти и другие, |
радиоактивные, |
изотопы ксенона |
образуются при спонтанном делении ядер урана 235U и 238U при ядерных взрывах.
Нахождение в природе
В атмосфере содержится 8.6 ∙ 10−6 % (об.). Содержится в газовых включениях урансодержащих минералов и в облученном топливе ядерных реакторов.
© 2013 – 2014 А.А.Сибиркин
