
- •38. С понижением температуры скорость реакции уменьшается, потому что с уменьшением температуры энергия активации уменьшается.
- •26. При разбавлении раствора электролита осмотическое давление увеличивается, потому что с разбавлением степень диссоциации и, следовательно, изотонический коэффициент увеличивается.
- •Тема 3. Ионные равновесия в растворах. Гидролиз. Буферные растворы.
- •Тема 4. Биогенные элементы. Строение молекул. Химическая связь.
- •29. Угол н-о-н в молекуле воды равен 104,5, потому что атом кислорода имеет sp2-гибридизацию орбиталей.
- •30. Угол н-с-н в молекуле метана равен 109,28, потому что атом углерода имеет sp3-гибридизацию орбиталей.
Тема 4. Биогенные элементы. Строение молекул. Химическая связь.
ИСПОЛЬЗОВАНИЕ 3%-ГО ВОДНОГО РАСТВОРА ПЕРОКСИДА ВОДОРОДА В МЕДИЦИНЕ ОСНОВАНО НА ЕГО СВОЙСТВЕ
быстро разлагаться при температуре 37С с образованием в первый момент атомарного кислорода
ВАЖНЕЙШУЮ РОЛЬ В БИОХИМИЧЕСКИХ ПРОЦЕССАХ, ПРОТЕКАЮЩИХ В ЖИВЫХ ОРГАНИЗМАХ ИГРАЮТ СЛЕДУЮЩИЕ ЧЕТЫРЕ S-ЭЛЕМЕНТА:
калий, натрий, кальций и магний
ФОРМУЛА ИОНА, КОТОРЫЙ МОЖЕТ СУЩЕСТВОВАТЬ В ЩЕЛОЧНОЙ СРЕДЕ В ЗНАЧИТЕЛЬНЫХ КОЛИЧЕСТВАХ:

В ВОДНОМ РАСТВОРЕ КАТИОН Ag+ МОЖЕТ В ЗНАЧИТЕЛЬНЫХ КОЛИЧЕСТВАХ НАХОДИТЬСЯ СОВМЕСТНО С АНИОНАМИ:

В КИСЛОЙ СРЕДЕ В ЗНАЧИТЕЛЬНЫХ КОЛИЧЕСТВАХ МОЖЕТ ПРИСУТСТВОВАТЬ ИОН:
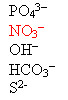
В ЩЕЛОЧНОЙ СРЕДЕ В ЗНАЧИТЕЛЬНЫХ КОЛИЧЕСТВАХ МОГУТ НАХОДИТЬСЯ ИОНЫ:

В ВОДНОМ РАСТВОРЕ СУЛЬФАТ-ИОН В ЗНАЧИТЕЛЬНЫХ КОЛИЧЕСТВАХ МОЖЕТ НАХОДИТЬСЯ СОВМЕСТНО С КАТИОНАМИ:

В ВОДНОМ РАСТВОРЕ, СОДЕРЖАЩЕМ 1 МОЛЬ КАРБОНАТА НАТРИЯ МАКСИМАЛЬНОЕ КОЛИЧЕСТВО ИОНОВ ВОЗМОЖНО ДЛЯ:
![]()
В ВОДНОМ РАСТВОРЕ ХЛОРИД-ИОН В ЗНАЧИТЕЛЬНЫХ КОЛИЧЕСТВАХ МОЖЕТ НАХОДИТЬСЯ СОВМЕСТНО С КАТИОНАМИ:
![]()
ДЛЯ КИСЛОТЫ СПРАВЕДЛИВЫ СЛЕДУЮЩИЕ УТВЕРЖДЕНИЯ:
донор протонов в реакциях со щелочами
сложное вещество, состоящее из катионов водорода и анионов кислотных остатков
электролит, образующий при диссоциации в качестве катионов только ионы водорода
КОМПЛЕКСНЫМ СОЕДИНЕНИЯМ, ПРЕДСТАВЛЕННЫМ В КОЛОНКЕ 1 СООТВЕТСТУЮТ ИОНЫ-КОМПЛЕКСООБРАЗОВАТЕЛИ, ПРЕДСТАВЛЕННЫЕ В КОЛОНКЕ 2:

ответ: 1 → г 2 → г 3 → б 4 → д 5 → а
ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СЕРЫ, УГЛЕРОДА И АЗОТА В РЯДАХ ПРЕДСТАВЛЕННЫХ В КОЛОНКЕ 1, ИЗМЕНЯЮТСЯ В ЗАВИСИМОСТИ, ПРЕДСТАВЛЕННОЙ В КОЛОНКЕ 2:

ответ: 1 → а 2 → в 3 → б 4 → б
ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СЕРЫ, УГЛЕРОДА И АЗОТА В РЯДАХ ПРЕДСТАВЛЕННЫХ В КОЛОНКЕ 1, ИЗМЕНЯЮТСЯ В ЗАВИСИМОСТИ, ПРЕДСТАВЛЕННОЙ В КОЛОНКЕ 2:

ответ: 1 → б 2 → д 3 → б 4 → в
ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА СЕРЫ, УГЛЕРОДА И АЗОТА В РЯДАХ ПРЕДСТАВЛЕННЫХ В КОЛОНКЕ 1, ИЗМЕНЯЮТСЯ В ЗАВИСИМОСТИ, ПРЕДСТАВЛЕННОЙ В КОЛОНКЕ 2:

ответ: 1 → в 2 → г 3 → в 4 → б
СВЯЗЬ В МОЛЕКУЛЕ ЙОДА:
одинарная
-типа
ковалентная неполярная
НАИМЕНЕЕ ПРОЧНАЯ СВЯЗЬ Э-Н В МОЛЕКУЛЕ ВОДОРОДНОГО СОЕДИНЕНИЯ:
![]()
ПОЛЯРНОСТЬ СВЯЗИ ЭЛЕМЕНТ-ХЛОР В РЯДУ СОЕДИНЕНИЙ

убывает
РЯД, В КОТОРОМ ПЕРЕЧИСЛЕНЫ ВЕЩЕСТВА С МОЛЕКУЛЯРНЫМ СТРОЕНИЕМ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ (н.у.):
хлор, азот, водород, сера ромбическая
В МОЛЕКУЛЕ ПЕРМАНГАНАТА КАЛИЯ ПРИСУТСТВУЮТ СВЯЗИ:
ионные
ковалентные полярные
ДЛЯ ВОДОРОДНОЙ СВЯЗИ СПРАВЕДЛИВЫ СЛЕДУЮЩИЕ СВОЙСТВА:
повышает температуру кипения вещества
обусловлена электростатическим взаимодействием
КАК МНОГОЦЕНТРОВУЮ И НЕЛОКАЛИЗОВАННУЮ МОЖНО ОХАРАКТЕРИЗОВАТЬ … СВЯЗЬ:
металлическую
НА ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ АТОМА ВЛИЯЮТ:
число неспаренных электронов в основном состоянии атома
число вакантных орбиталей
число неподеленных пар электронов в атоме
КАТИОН ЛИТИЯ (Li+) И АНИОН ВОДОРОДА (Н) СОДЕРЖАТ ОДИНАКОВОЕ ЧИСЛО ЭЛЕКТРОНОВ. РАДИУС Li+ …. Н:
больше
КАТИОНЫ, АНИОНЫ ИЛИ НЕЙТРАЛЬНЫЕ МОЛЕКУЛЫ, СПОСОБНЫЕ ОТДАВАТЬ ЭЛЕКТРОННЫЕ ПАРЫ НАЗЫВАЮТ:
основаниями Льюиса
донорами электронной пары
КАТИОНЫ, АНИОНЫ ИЛИ НЕЙТРАЛЬНЫЕ МОЛЕКУЛЫ, СПОСОБНЫЕ ПРИНИМАТЬ ЭЛЕКТРОННЫЕ ПАРЫ,
кислотами Льюиса
акцепторами электронной пары
ЭЛЕКТРОННАЯ ФОРМУЛОЙ 1s22s22p6 СПРАВЕДЛИВА ДЛЯ ЧАСТИЦ:
![]()
ПОЛЯРНОСТЬ СВЯЗИ Э-О В ОКСИДАХ ЭЛЕМЕНТОВ III ПЕРИОДА ПСХЭ МЕНЯЕТСЯ СЛЕДУЮЩИМ ОБРАЗОМ:
полярность связи уменьшается
ПОЛЯРНЫМИ ЯВЛЯЮТСЯ МОЛЕКУЛЫ СЛЕДУЮЩИХ ВЕЩЕСТВ:

только в, г, д, ж;

