
- •1. Изолированные (нет обмена ни веществом, ни энергией с окружающей средой). Пример – герметичный сосуд с газом с теплоизоляционной оболочкой,
- •2. Замкнутые (нет обмена веществом с окружающей средой). Пример – герметичный сосуд.
- •3. Открытые (есть и энерго- и массообмен с окружающей средой). Пример – костер, человек.
- •Второй закон Рауля
-
Основные понятия термодинамики. Интенсивные и экстенсивные параметры. Функция состояния. Внутренняя энергия. Работа и теплота – две формы передачи энергии. Типы термодинамических систем (изолированные, закрытые, открытые). Типы термодинамических процессов (изотермические, изобарные, изохорные). Стандартное состояние.
I. Энергия - это такая характеристика движения и взаимодействия тел, которая связана с их способностью совершать изменения в состоянии системы и внешней среды.
II. Термодина́мика— раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника.
Термодинамическая система – это ограниченная область пространства, занятая ее элементами. Элементы системы (подсистемы) считаются однородными. Граница системы может быть и физической (стенки сосуда) и мысленной. Все, что вне системы – окружающая среда
Термодинамические системы бывают трех видов:
1. Изолированные (нет обмена ни веществом, ни энергией с окружающей средой). Пример – герметичный сосуд с газом с теплоизоляционной оболочкой,
2. Замкнутые (нет обмена веществом с окружающей средой). Пример – герметичный сосуд.
3. Открытые (есть и энерго- и массообмен с окружающей средой). Пример – костер, человек.
III. Параметры термодинамической системы
Параметры состояния системы – это свойства, однозначно характеризующие однородные части системы.
Параметры делятся на интенсивные и экстенсивные. Интенсивные параметры не зависят от количества вещества в системе (давление, температура, напряженность электрического поля и др.), а экстенсивные - зависят (объем, масса, заряд и др.)
IV. Характеристики системы:
-
Параметры(измеряемы) Т, Р, С, V и т д
-
Функции состояния U,H,S
Функции состояния – энергетическая характеристика системы, изменения которой не зависят от пути, каким система перешла из одного состояния в другое
Состояния системы: -равновесное(свойства постоянны,нет потоков веществ и энергии)-термодинамически обратимое(равновесны все промежуточные стадии) -стандартное.
Внутренняя энергия-совокупность всех видов энергии всех состовляющих частиц (кроме потенциальной и кинетической энергий всех системы)
Работа-упорядоченная форма передачи энергии,с изменением параметров состояния системы.
Теплота-неупорядоченная форма пердачи.
Процессы:-изотермические(Т постоянная)-изобарные(Р постоянно)-изохорные(v постоянно).
н. у. : 1атм = 760 мм. рт. ст. = 101325 Па; t = 25С = 298К ν = 1моль
-
Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции. Закон Гесса. Применение первого начала термодинамики к биосистемам.
Первый закон термодинамики (закон сохранения энергии) Энергия не возникает из ничего и не исчезает бесследно, переход из одной формы в другую в эквивалентных количествах.
Кол-во е в космосе=const
Внутренняя Е в изолированной системе = const
в закрытой системе Qv=ΔU+W (теплота в изохорных условиях идет на изменение внутренней Е) Q –хаотичная форма передачи Е, W - направленная
Qp = ΔU+p*ΔV = ΔH (теплота, подведенная к системе в изобарных условиях – изменение энтальпии – теплосодержания)
Тепловой эффект: кол-во теплоты, выделяемой или поглощаемой реагирующей сис-мой.
Тепловой эффект=изменению внутренней Е сис-мы при изохорном процессе и изменению энтальпии
при изобарном.
Реакции по тепловому эффекту:
-
экзотермические ΔH<0
-
эндотермические ΔH>0
Тепловой эффект зависит от: природы реаг. в-в, условий и кол-ва в-ва
н. у. : 1атм = 760 мм. рт. ст. = 101325 Па; t = 25С = 298К ν = 1моль
Энтальпия: функция состояния, приращение которой = теплоте, полученное сис-мой в изобарном процессе. Н=Е+рV
Стандартная энтальпия образования вещества (∆H0f) – тепловой эффект, образования 1 моль вещества в стандартных условиях из простых веществ, взятых в устойчивых модификациях. (отрицательная – экзо; положительная – эндо)
Стандартная энтальпия сгорания вещества (∆Н0с) - теплота окисления в избытке кислорода 1 моль вещества, взятого в стандартном состоянии, до конечных продуктов окисления: оксида углерода(IV), воды, азота, оксида серы(IV).
Закон Гесса: з-н аддитивности тепловых эффектов – теплота(энтальпия) хим р-ции, протекающей при р или V=const определяется только природой исходных в-в и продуктов р-ции и не зависит от числа и последовательности промежуточных стадий
1)теплота образования в-ва=теплоте его разложения, взятой с обратным знаком. ΔHпрям.= -ΔHобр.
2)энтальпия образования=разности сумм энтальпий образования продукта р-ции и исходных в-в
3)энтальпия сгорания=разности сумм энтальпий сгорания исходных в-в и продуктов р-ции.
Стандартная энтальпия хим. р-ии = сумме…с учетом стехиометрических коэффициентов
Термохимическое ур-е: ур-е в котором помимо формул исходных в-в и продуктов р-ции указан отвечающие этой р-ции тепловой эффект.
Поступление пищи обеспечивает энергию, которая используется для выполнения различных функций организма или сохраняется для последующего использования. Пищевые вещества окисляются вплоть до конечных продуктов, которые выделяются из организма.C6H12O6 + 6O2 = 6CO2 + 6H2O
Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. эндергоническая:(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).
-
Второе начало термодинамики. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия. Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов.
2 з-н термодинамики (о возможности прогнозир. протекания(направления) хим. р-ии)
Второй закон термодинамики:
-
Невозможен самопроизвольный переход от тела менее нагретого к более нагретому.
-
Невозможно превратить теплоту в работу не приводя никакого другого действия, кроме охлаждения источника тепла.
-
Вечный двигатель 2-го рода невозможен, т. е. такой двигатель, результатом которого было бы получение работы за счет тепла окружающей среды.
-
Все самопроизвольные процессы в макроскопических сис-мах протекают в направлении от менее вероятного к более вероятному состоянию сис-мы.
Для изолир. систем идут р-ии с увеличением энтропии (из менее вероятного в более вероятное) S=k*lnW
k = 1.38*10^-23
lnW – логарифм термодинамической вероятности
Энтропия: мера вероятности данного состояния в-ва или системы. Характеризует меру беспорядка в расположении и поведении частиц составляющих сис-му, а также меру стремления частиц занять как можно больший V. Чем больше беспорядка, тем выше энтропия.
При достижении равновесия S изолированной сис-мы максимальна.
Для закрытой системы: критерий самопроизвольного протекания – изменение G(E Гиббса)
ΔG = ΔH-TΔS если Т≠298К
ΔH<0 – изменение энтальпии (стремление к мин. Е)
ΔS – изменение энтропии (стремление к увелич. беспорядка)
Энергия Гиббса: часть внутренней Е сис-мы которая может быть использована для работы.
В самопроизвольной реакции: ΔG<0 ;ΔS>0
По объед. 1 и 2 з-ны: самопроизвольно идут р-ии с увеличением Егиббса (экзэргонические процессы) ΔGх.р.=ΣΔGпрод. –Σ ΔGреаг. если Т=298К
Обратимые – такие термодинамические процессы, при которых возвращение системы в первоначальное состояние не требует затраты энергии извне и связанных с этим изменений в окружающей среде.
Необратимые – термодинамические процессы, при которых возвращение системы в исходное состояние возможно лишь при условии затрат внешней энергии, что влечет за собой определенные изменения в окружающей среде.
Процесс называется самопроизвольным, если он осу–ществляется без каких-либо воздействий, когда
система предоставлена самой себе.
Существуют процессы, при которых внутренняя энер–гия системы не меняется (ΔЕ = 0). К таким
процессам относится, например, ионизация уксусной кислоты в воде.
Целый ряд самопроизвольных процессов протекает с увеличением внутренней энергии (ΔЕ > 0). Сюда
отно–сятся, в частности, типичные реакции образования био–неорганических соединений альбумина
(белок плазмы крови) с ионами металлов, например Сu2+.Изменение внутренней энергии АЕ для
закрытых сис–тем не может служить критерием самопроизвольного про–текания процессов.
Энтальпийный и энтропийный факторы
Из приведенного выражения следует, что самопроизвольное течение реакции может контролироваться как энтальпийным (∆H), так и энтропийным фактором (T∆S).
Очевидно, что для реакций, характеризующихся ∆Hr < 0 и ∆Sr > О, энергия Гиббса должна обязательно убывать, т. е. ∆Gr < 0, и такие реакции могут протекать самопроизвольно при любых температурах, так как оба фактора способствуют протеканию процесса. Пример такой реакции — гидролиз белка.
Наоборот, при ∆Hr > 0 и ∆Sr < 0 самопроизвольное течение реакций всегда невозможно, так как энергия Гиббса должна обязательно возрастать. Оба фактора препятствуют протеканию реакции. Пример — фотосинтез, т. е. образование глюкозы и кислорода из углекислого газа и воды.
Несогласованное действие факторов наблюдается в двух случаях:
1) ∆Hr > 0 и ∆Sr > 0 — самопроизвольному протеканию реакции способствует энтропийный фактор, отрицательное значение изменения энергии Гиббса возможно при соотношении |∆Sr |> |∆Hr |, т. е. при достаточно высоких температурах. Примером процессов этого типа является тепловая денатурация белков;
2) ∆Hr < О и ∆Sr < О — благоприятствующим фактором является энтальпийный, соотношение AGT < 0 наблюдается при |∆Hr | > |∆Sr |, т. е. при достаточно низких температурах. Пример процессов этого типа — гидратация белков
-
Термодинамические условия равновесия. Стандартная энергия Гиббса образования вещества, стандартная энергия Гиббса биологического окисления вещества. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме.
Термодинамические условия равновесия:
ΔG0х.р = -RT*lnKp
ΔG0=0 Kравн=1
ΔS=0 ΔH=Т*ΔS
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объём,энтропия) в условиях изолированности от окружающей среды.
Критерии термодинамической устойчивости различных систем:
-
Изолированая (абсолютно не взаимодействующая с окружающей средой) система — максимум энтропии.
-
Замкнутая (обменивается с термостатом только теплом) система — минимум свободной энергии.
-
Система с фиксированными температурой и давлением — минимум потенциала Гиббса.
-
Система с фиксированными энтропией и объёмом — минимум внутренней энергии.
-
Система с фиксированными энтропией и давлением — минимум энтальпии.
стандартная энергия Гиббса образования вещества – изменение энергии Гиббса системы при образовании 1 моль сложного вещества из простых веществ, устойчивых при 298 К и 100кПа.
Стандартная энергия Гиббса окисления вещества – изменение энергии гиббса системы при окислении 1моль вещества.
Стандартная энергия Гиббса реакции При любых температурах определяется по уравнению Гиббса:G = H - ТS
В биологических системах термодинамически невыгодные (эндергонические – фотосинтез) реакции могут протекать лишь за счёт энергии экзергонических реакций(самопроизвольно идут с увеличением энергии гиббса и соответственно с увелич. энтропии). Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора. Рассмотрим подробнее энергетику сопряжённых реакций на примере фосфорилирования глюкозы. Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической:(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы.(2) АТФ +Н20→ АДФ + Н3РО4 (ΔG = -30,5 кДж/моль).При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой (см. раздел 7), фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима:(3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль).
-
Химическое равновесие. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия в изолированных и закрытых системах. Константа химического равновесия. Уравнения изотермы химической реакции. Прогнозирование смещения химического равновесия. Понятие о гомеостазе и стационарном состоянии живого организма.
Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции. Обратимая реакция - химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях. Необратимой называется реакция, которая идет практически до конца в одном направлении.
Константа химического равновесия - величина, определяющая для данной хим. р-ции соотношение между термодинамич. активностями исходных в-в и продуктов в состоянии хим. равновесия.
(Связь Егиббса и константы хим. равновесия по уравнениям изотермы Вант-Гоффа)
Уравнение изотермы химической реакции позволяет рассчитать величину ΔG (ΔF) при переходе из любого состояния системы в равновесное, т.е. ответить на вопрос, будет ли химическая реакция протекать самопроизвольно при данных концентрациях Сi (давлениях Рi) реагентов:
ΔG0х.р характеризует глубину протекания процесса
ΔG0х.р = -RT*lnKp
если ΔG0<0 – идет прямая реакция Kравн>1
если ΔG0>0 – идет обратная реакция реакция Kравн>1
если ΔG=0 то Кравн = 1 – истинное термодинамическое равновесие
lnKравн
=
 R=8,31Дж/моль*К
R=8,31Дж/моль*К
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации.. Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
Гомеостаз-совокупность сложных приспособительных реакций организма животного и человека, направленных на устранение или максимальное ограничение действия различных факторов внешней или внутренней среды организма. Стационарное состояние - это типичное состояние живых объектов. Оно характеризуется постоянным уровнем энергии, а изменение энтропии стремиться к нулю. Все основные физиологические процессы реализуются при стационарном состоянии системы.
-
Предмет и основные понятия химической кинетики. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции, средняя скорость реакции в интервале, истинная скорость.
Молекулярность элементарного акта реакции. Кинетические уравнения. Порядок реакции. Период полупревращения.
Кинетика: раздел физ химии, изучающий скорость и механизмы хим реакций. Термодинамика говорит о принципиальной возможности протекания хим. р-ии, а кинетика – о возможности во времени. Скорость – это число актов химического взаимодействия в ед времени в единице объема или площади, определяют как изменение концентрации одного из реагирующих веществ в ед времени. Скорость химической реакции зависит от
- природы веществ(ст. Еактив. р-ии, Еактив=40-120 кДж/моль
если <40 – взрыв
если >40 - незаметно
от концентрации(чем больше концентрация, тем больше скорость хим. р-ии), температуры, от присутствия катализаторов и ингибиторов, для вещества в твердом состоянии – от поверхности реагирующих веществ.
Последовательность и характер стадий хим реакций называют механизмом реакции. По механизму различают простые и сложные реакции. Простые реакции осуществляются посредством однотипных элементарных актов. Под элементарным актом понимают единичный акт взаимодействия или превращения частиц, в результате которого образуются новые частицы продуктов реакции или промежуточных веществ. Для осуществления сложных реакций необходимы разнотипные (не менее двух) элементарные акты. Сложная реакция протекает в несколько стадий (Например, разложение озона) Все биохимические реакции – сложные.
Различают гомогенные и гетерогенные реакции. В гомогенные реакциях все исходные вещества находятся в одной фазе (2N2O5 -> 4NO2 + О2). В гетерогенных реакциях исходные вещества находятся в разных фазах (С(т)+О2(г)=СО2)
Молекулярность – число молекул, одновременным взаимодействием которых осуществляется элементарный акт химического превращения. Она может характеризоваться только целыми числами.
Кинетические уравнения.
Зависимость скорости химической реакции от концентрации описывается кинетическим уравнением. Например, для реакции:
аА + ЬВ → продукты
v = k*c(A)*с(B),
(v слож. р-ий прямо пропорц. концентрации реагента в степенях, равных порядку реакции по данному реагенту
к — константа скорости реакции. Константа скорости зависит от тех же факторов, что и скорость химической реакции, но не зависит от концентрации.

Порядок реакции – число, равное сумме показателей степеней концентраций реагирующих веществ в кинетическом уравнении реакции. Порядок реакции характеризует формально кинетическую зависимость скорости реакции от концентрации реагирующих веществ, а молекулярность – элементарный механизм отдельных стадий сложного процесса.
-
Зависимость скорости реакции от концентрации. Кинетические уравнения реакций первого, второго и нулевого порядков. Экспериментальные методы определения скорости и константы скорости реакций.
Закон действующих масс(Гультберг, Вааге):
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
V=kCaA*CbB
k – константа скорости хим р-ции (отвечает за природу химических веществ, агрегатное состояние)
С – молярная концентрация
Зависимость скорости химической реакции от концентрации описывается кинетическим уравнением. Например для реакции:
aA
+ bB
продукты
V=kc(A)в степени p * c(B) в степени q
Где p,q – найденные экспериментальным путем коэффициенты
k-константа скорости реакции, размерность которой зависит от значений p,q
C-концентрации реагентов А и В
a, b – стехиометрические коэффициенты
Константа скорости есть величина постоянная, не зависящая от концентрации реагентов.
При представлении концентрационной зависимости скорости в виде закона действующих масс предполагается, что скорость зависит от концентрации реагентов А и В. Физический смысл константы скорости реакции нетрудно установить – она численно равна скорости реакции, в которой концентрации реагирующих веществ равна 1 моль\ л или их произведения равно единице:
Если (А) = (В) = 1 моль\л = V = k *1 * 1 , т.е. V = k.
Это скорость данной реакции в стандартных условиях.
Порядок реакции - это число равное сумме показателей степеней концентраций реагирующих веществ в кинетическом уравнении реакции. Порядок реакций характеризует формально кинетическую зависимость скорости реакции от концентрации реагирующих веществ. Реальный порядок реакций устанавливается экспериментальным путем и часто не совпадает с теоретическим.
Реакции нулевого порядка:
-dc/dt =k откуда С0 – Сt =kt
По нулевому порядку проходят следующие процессы:
-фотохимические реакции, скорость которых определяется количеством поглощенного света.
- каталитические реакции, скорость которых зависит от концентрации только катализатора
-реакции, в которых убыль исходного вещества постоянно восполняется его поступлением из другой фазы.
Прямая идет параллельно оси абсцисс, tg( альфа )=0, т.е. p + q =0
V

C
![]() (II.5)
(II.5)
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Реакции первого порядка: в том случае если угол наклона прямой на графике составляет 45 градусов, tg= 1
-dc/dt=kc


v
c
Реакции первого порядка характеризуются кинетическим уравнением вида V=K1Ca= -DT/DC После интегрирования выражения lnC= -KT+g Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со.
Ln C= ln Co -KT

Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени. K= - tg a
K=1/t + ln Co/C
период полупревращения t1/2– время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. T1/2=ln2/k
Реакции второго порядка:
-dc/dt=kt(в квадрате)
График кривая
Для реакций второго порядка кинетическое уравнение имеет следующий вид V=K*Ca*Cв= -DT/DC после интегрирования 1/С=KT+1/Co
для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени: K=1/T(1/C-1/Co)
Порядок химической реакции есть формально-кинетическое понятие, физический смыслкоторого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции. Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика которой изучается в лабораторном практикуме по физической химии:
СН3СООС2Н5 + Н2О ––> СН3СООН + С2Н5ОН
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:
![]() (II.23)
(II.23)
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
1) Избыток воды:
![]() (II.24)
(II.24)
![]() (II.25)
(II.25)
2) Избыток этилацетата:
![]() (II.26)
(II.26)
![]() (II.27)
(II.27)
В этих случаях мы имеем дело с т.н. реакцией псевдопервого порядка. Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.
-
Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Понятие о теории активных соударений. Энергетический профиль реакции. Энергия активации, уравнение Аррениуса. Роль стерического фактора. Понятие о теории переходного состояния.
-
Правило Вант-Гоффа: скорость большинства реакций увеличивается приблизительно в 2-4 раза при увеличении температуры на 100С: Vt2=Vt1*γt2-t1/10, где γ – температурный коэффициент константы скорости реакции(in vitro - в стекле, стакане, вне γ=(2-4), in vivo – внутри γ=(15-9))
-
Уравнение Аррениуса для константы скорости: устанавливает зависимость константы скорости химической реакции
 от температуры
от температуры  .
d*lnKр/dT
= А*e(-E/RT)
k=Ae-Ea/RT,
где Еа
(энергия
активации Дж/моль) и А – постоянные, не
зависящие от температуры величины, R
– универсальная газовая постоянная,
Т – абсолютная температура.
.
d*lnKр/dT
= А*e(-E/RT)
k=Ae-Ea/RT,
где Еа
(энергия
активации Дж/моль) и А – постоянные, не
зависящие от температуры величины, R
– универсальная газовая постоянная,
Т – абсолютная температура.
Уравнение, которое часто используют для различных расчетов, получают путем неопределенного интегрирования : k=А*e(-E/RT), где k – константа (моль*л/сек), А – предэкспотенциальный множитель, где Еа - энергия активации (Дж/моль).
Теория активных соударений (Аррениус):
-
Реакционноспособными являются не все молекулы, а только те, которые находятся в особом активном состоянии.
-
Активные молекулы образуются из обычных в результате протекания обратимого процесса поглощения энергии.
-
Активные молекулы превращаются в молекулы конечного продукта со скоростью, не зависящей от температуры.
-
Влияние температуры на скорость химического процесса сводится к смещению равновесия между обычными и активными молекулами в сторону увеличения концентрации последних.
Энергия активации – это тот энергетический барьер, который должны преодолеть исходные вещества по пути превращения в продукты реакции.
cтерический фактор– фактор, отражающий влияние на скорость химической реакции определенного расположения молекул реагентов в момент соударения. он зависит в силу этого от температуры (возрастает скорость соударения молекул реагентов и ускоряется реакция), от давления (при высоком давлении в среде, где происходит реакция расстояния между молекулами реагентов меньше)
Суть теории переходного состояния (активированного комплекса): 1) частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии; 2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации; 3) переходное состояние находится в равновесии с реагентами; 4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.
-
Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции. Особенности каталитической активности ферментов.
Скорость
многих реакций зависит от присутствия
веществ, не расходующихся в ходе реакции;
такие реакции называются каталитическими.
Под катализом
понимают изменение скорости химических
реакций в присутствии веществ, которые
после завершения реакции остаются в
неизменном виде и количестве. Увеличение
скорости реакции называют положительным
катализом, уменьшение — отрицательным
катализом, или ингибированием.
Катализаторами
называют вещества, которые вызывают
положительный катализ; вещества,
замедляющие реакции, называют ингибиторами.
Термины «катализ» и «катализаторы»
введены в химию шведским химиком И.
Берцелиусом (1835 г.).
Механизм действия катализатора заключается в изменении пути процесса превращения реагентов в продукты. Новый путь характеризуется меньшим энергетическим барьером, т. е. меньшей энергией активации . Различают гомогенный и гетерогенный катализ. Ускорение реакции диспропорционирования пероксида водорода в водном растворе в присутствии дихромат-ионов является примером гомогенного катализа (катализатор образует одну фазу с реакционной смесью), а в присутствии оксида марганца(1У) — примером гетерогенного катализа.
Все каталитические реакции подразделяются на гомогенные и гетерогенные. Если реагирующие вещ-ва и катализатор наход-ся в разных фазах, катализ наз-ся ГЕТЕРОГЕННЫМ1 (пример: синтез аммиака из азота и водорода в присутствии металлического железа). Если реагирующее вещ-во и катализатор нах-ся в одной фазе, катализ наз-ся ГОМОГЕННЫМ! (пример: разложение водородопероксида в присутствии солей Fe(II) в водных растворах. РЕАКЦИЯ: 2Н2О2→2H2О + O2 над стрелочкой Fe2+ (1)
Все
реакции каталитического разложения
представляют собой сложные многостадийные
процессы. Роль каталитических реакций
велика при жизнедеятельности организмов;
большинство реакций в организмах
протекает при участии биологических
катализаторов-ФЕРМЕНТАХ. Характерной
особенностью Ф явл. их специфичность:
свойство изменять скорость реакции
одного типа и не влиять на многие др
реакции, протекающие в клетке! В состав
большинства ферментов входит ион
металла, поэтому эти биологические
катализаторы наз-ся металлоферментами!
Типичным ферментом явл-ся КАТАЛАЗА!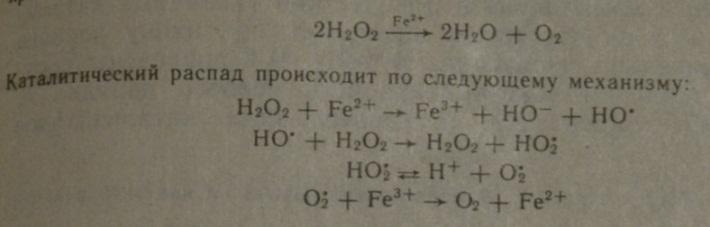
Особенностями ферментов явл: 1) высокая активность 2) высокая специфичность, т.е избирательность действия 3) тонкий механизм регулировки активности деят-ти ферментов с помощью ЭФФЕКТОРОВ (активаторы, ингибиторы) 4) высокая чувств-ть к внешним условиям!
Большинство ферментативных реакций описывается кинетическими уравнениями нулевого порядка.
-
Кислоты и основания. Основные положения теории кислот и оснований Бренстеда-Лоури: молекулярные и ионные кислоты и основания, сопряженная протолитическая пара, амфолиты. Водородный показатель рН. Основные положения теории кислот и оснований Льюиса.
кислота - водородсодержащее соединения, при электролитической диссоциации которого вводе образуются ионы водорода и анионы, а основание-соед., диссоциирующее с отщеплением ионов гидроксила и катионов.
По Брёнстеду, кислота - донор протона, а основание - акцептор его. По Льюису, кислота - вещество, которое может использовать неподеленную электронную пару электронов атома другие молекулы для образования устойчивой электронной группировки одного из своих атомов, основание - вещество, обладающее неподеленной парой электронов, которая может быть использована для образования устойчивой электронной группировки др. атома
Протон может выделяться только в том случае, если в химической системе есть основание, способное присоединить этот протон. Поскольку размеры протона во много раз меньше размеров других ионов, то он создает вокруг себя электрическое поле большой
интенсивности, в которое втягиваются полярные молекулы воды. Поэтому в водных растворах не существует свободных протонов:
Процесс отщепления - присоединения протона является обратимым: каждой кислоте соответствует свое основание и каждому основанию -
своя кислота. Эту пару сопряженных веществ называют кислотно-основной или протолитической парой. Каждый отдельный компонент этой пары называется протолитом. Кислота и основаниеодной протолитической пары называются сопряженнымипротолитами (сопряженными кислотой и основанием)
Амфолиты - амфотерные электролиты, т. е. вещества, молекулы которых содержат одновременно и кислотные, и основные группы, и поэтому в водных растворах диссоциируют и как кислоты с отщеплением водородных ионов Н +, и как основания с отщеплением гидроксильных ионов ОН-. К амфолитам относятся биологически важные вещества: аминокислоты (см.), пептиды (см.), белки (см.) и др. Кислотные свойства этих веществ обусловлены наличием в них карбоксильных групп СООН, а основные свойства — содержанием аминогрупп NH2. Амфолиты образуют растворы с хорошими буферными свойствами. Благодаря способности к выборочной ионизации они противодействуют изменению pH при добавлении кислоты или основания
Водородный
показатель (рН) величина, характеризующая
активность или концентрацию ионов
водорода в растворах. Водородный
показатель обозначается рН.
Водородный
показатель численно равен отрицательному
десятичному логарифму активности
или концентрации ионов водорода,
выраженной в молях на литр:
pH=-lg[ H+ ]
В
воде концентрация ионов водорода
определяется электролитической
диссоциацией воды по
уравнению
H2O=H++OH-
Константа
диссоциации при 22° С составляет
![]() Пренебрегая
незначительной долей распавшихся
молекул, можно концентрацию
недиссоциированной части воды принять
равной обшей концентрации воды, которая
составляет: С[H2O
]=1000/18=55,55моль/л.
Тогда: C[ H+ ]
·C[ OH- ]=K·C[H2O]=1,8·10-16·55,55=10-14
Для
воды и ее растворов произведение
концентраций ионов Н+ и ОН- величина
постоянная при данной температуре. Она
называется ионным произведением воды
КВ и
при 25° С составляет 10-14.
Постоянство
ионного произведения воды дает возможность
вычислить концентрацию ионов H+если
известна концентрация ионов OH-
и
наоборот:
Пренебрегая
незначительной долей распавшихся
молекул, можно концентрацию
недиссоциированной части воды принять
равной обшей концентрации воды, которая
составляет: С[H2O
]=1000/18=55,55моль/л.
Тогда: C[ H+ ]
·C[ OH- ]=K·C[H2O]=1,8·10-16·55,55=10-14
Для
воды и ее растворов произведение
концентраций ионов Н+ и ОН- величина
постоянная при данной температуре. Она
называется ионным произведением воды
КВ и
при 25° С составляет 10-14.
Постоянство
ионного произведения воды дает возможность
вычислить концентрацию ионов H+если
известна концентрация ионов OH-
и
наоборот: ![]() .
Понятия
кислая, нейтральная и щелочная среда
приобретают количественный смысл. В
случае, если [ H+ ]
=[ OH- ]эти
концентрации (каждая из них) равны
.
Понятия
кислая, нейтральная и щелочная среда
приобретают количественный смысл. В
случае, если [ H+ ]
=[ OH- ]эти
концентрации (каждая из них) равны ![]() моль/л,
т.е [ H+ ]
=[ OH-]=10-7моль/л
и среда нейтральная, в этих растворах
pH=-lg[
H+ ]=7 и
рОН=-lg[ OH-]=7
Если [ H+ ]>10-7моль/л,
[ OH-]<10-7моль/л
-среда кислая; рН<7.
Если [ H+ ]<10-7 моль/л,
[ OH-]>10-7моль/л
-среда щелочная; рН>7.
В
любом водном растворе рН + рОН =14, где
рОН=-lg[ OH-]
Величина рН имеет большое
значение для биохимических процессов,
для различных производственных процессов,
при изучении свойств природных вод и
возможности их применения и т.д.
моль/л,
т.е [ H+ ]
=[ OH-]=10-7моль/л
и среда нейтральная, в этих растворах
pH=-lg[
H+ ]=7 и
рОН=-lg[ OH-]=7
Если [ H+ ]>10-7моль/л,
[ OH-]<10-7моль/л
-среда кислая; рН<7.
Если [ H+ ]<10-7 моль/л,
[ OH-]>10-7моль/л
-среда щелочная; рН>7.
В
любом водном растворе рН + рОН =14, где
рОН=-lg[ OH-]
Величина рН имеет большое
значение для биохимических процессов,
для различных производственных процессов,
при изучении свойств природных вод и
возможности их применения и т.д.
-
Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обусловливающие ее уникальную роль как единственного биорастворителя. автопротолиз воды. Константа автопротолиза воды. зависимость растворимости веществ в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий на растворимость. Термодинамика растворения.
Вода состоит из
атомов водорода (в трех изотопах 1,2,3)
и кислорода (в трех изотопах 16,17,18).
Составляет основную часть внутренней
среды организма, обеспечивает процессы
всасывания, передвижения питательных
веществ и продуктов обмена по организму.
Кроме того, вода участвует в процессе
терморегуляции (потоотделение) и в
процессе дыхания (человек может дышать
абсолютно сухим воздухом, но не долго).
Свойства:
1)Вода - единственное известное вещество, которое встречается в естественных условиях в твердом, жидком и газообразном состоянии.
2)Вода - уникальный растворитель, т.к. диэлектрическая проницаемость воды (Е в единицах СГСЭ) 81,0 при 20 гр..С. У большинства других тел она находится в пределах 2 - 3, за исключением ряда кислот (муравьиная - 58, ацетон - 21) и цианистого водорода, у которого диэлектрическая проницаемость 107.
3)Воду очень трудно окислить, сжечь или разложить на составные части. Вода - химически стойкое вещество.
4)Вода имеет редкую способность при замерзании расширяться, вследствие чего лед плавает на воде, остающейся в жидкой фазе. Только немногие вещества (висмут, галлий, германий и др.) имеют такую же аномалию, при которой твердая фаза легче жидкой.
5)Вода в форме сферических капель имеет наименьшую поверхность при заданном объеме. Поверхностное натяжение (на границе с воздухом при 20 гр. С равно 72,75 дин/см) является необходимым условием капиллярных процессов, столь важных для жизнедеятельности растений и животных.
6)Вода обладает способностью поглощать большое количество теплоты и сравнительно мало при этом нагреваться.
7) Поверхностное натяжение - это степень сцепления молекул воды друг с другом. Чем ниже поверхностное натяжение, тем выше растворяющая способность воды, тем лучше вода выполняет свои основные функции. В том числе и роль транспортной системы. Чем ниже поверхностное натяжение, тем выше растворяющие свойства, тем выше текучесть. 8) Кислотно-щелочное равновесие воды. Основные жизненные среды (кровь, лимфа, слюна, межклеточная жидкость, спинномозговая жидкость и др.) имеют слабощелочную реакцию. При сдвигах их в кислую сторону, меняются биохимические процессы, организм закисляется. 9) Структура воды. Вода представляет собой жидкий кристалл. Диполи молекулы воды ориентируются в пространстве определенным образом, соединяясь в структурные конгломераты. Это позволяет жидкости составлять единую биоэнергоинформационную среду. Когда вода находится в состоянии твердого кристалла (льда), молекулярная решетка жестко ориентирована. При таянии разрываются жесткие структурные молекулярные связи. И часть молекул, высвобождаясь, образует жидкую среду. В организме вся жидкость структурирована особым образом. 10) Информационная память воды. За счет структуры кристалла происходит запись информации, исходящей от биополя. Это одно из очень важных свойств воды, имеющее большое значение для всего живого.
Растворимость различных веществ в определённом растворителе зависит от внешних условий, прежде всего - от температуры и давления. Давление наиболее сильно сказывается на растворимость газов. Изменение внешних условий влияет на растворимость в соответствии с принципом смещения равновесий Ле-Шателье: воздействие какого-либо фактора (t, c, p) на равновесную систему стимулирует смещение равновесия в таком направлении, которое способствует восстановлению первоначальных характеристик системы.
Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
H2O + H2O= H3O+ + OH–
Это равновесие называется равновесием автопротолиза воды.
Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как Kw. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Влияние давления.При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
Влияние концентрации. При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции. При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Согласно второму началу термодинамики при р, Т = const вещества самопроизвольно могут растворяться в каком-либо растворителе, если в результате этого процесса энергия Гиббса системы уменьшается, т. е. ΔG = (ΔН – TΔS) < 0.
Величину ΔН называют энтальпийным фактором, а величину TΔS – энтропийным фактором растворения.
При растворении жидких и твердых веществ энтропия системы обычно возрастает (ΔS > 0), так как растворяемые вещества из более упорядоченного состояния переходят в менее упорядоченное. Вклад энтропийного фактора, способствующий увеличению растворимости, особенно заметен при повышенных температурах, потому что в этом случае множитель Т велик и абсолютное значение произведения TΔS также велико, соответственно возрастает убыль энергии Гиббса.
При растворении газов в жидкости энтропия системы обычно уменьшается (ΔS < 0), так как растворяемое вещество из менее упорядоченного состояния (большого объема) переходит в более упорядоченное (малый объем). Снижение температуры благоприятствует растворению газов, потому что в этом случае множитель Т мал и абсолютное значение произведения TΔS будет тем меньше, а убыль энергии Гиббса тем больше, чем ниже значение Т.
В процессе образования раствора изменение энтальпии процесса растворения нужно рассматривать в соответствии с законом Гесса как алгебраическую сумму эндо– и экзотермических вкладов всех процессов, сопровождающих процесс растворения. Иначе говоря, изменение энтальпии представляет собой алгебраическую сумму изменения энтальпии ΔНкр в результате разрушения кристаллической решетки и изменения энтальпии ΔНсол за счет сольватации (взаимод. молекул растворенного в-ва с молекулами р-рителя) частицами растворителя:
ΔНраств = ΔНкр + ΔНсол, где ΔНраств – изменение энтальпии при растворении.
При растворении твердых веществ с молекулярной кристаллической структурой и жидкостей молекулярные связи не очень прочные, и поэтому обычно ΔНсол > ΔНкр Это приводит к тому, что растворение, например, спиртов и сахаров представляет собой экзотермический процесс (ΔНраств < 0).
При растворении твердых веществ с ионной решеткой соотношение энергий Екр и Есол могут быть различным. Однако в большинстве случаев энергия, выделяемая при сольватации ионов, не компенсирует энергию, затрачиваемую на разрушение кристаллической решетки, следовательно, и процесс растворения является эндотермическим.
-
Коллигативные свойства разбавленных растворов неэлектролитов и электролитов. Закон Рауля и следствия из него: понижение температуры замерзания раствора, повышение температуры кипения раствора. Криоскопия и эбулиоскопия. Константа ионизации слабого электролита. Закон разведения Оствальда.
Коллигативные свойства растворов- такие свойства растворов, которые зависят в основном от концентрации растворенных частиц и в значительно меньшей степени от их размера, молярной массы и других свойств. Проникновение воды через животную мембрану из конц. раствора, т.е. то, что мы называем осмосом, впервые описал Ноле. Блегден установил, что понижение температуры замерзания растворителя зависит от массы растворенного вещества. Оба явления-понижение температуры замерзания растворителя и осмос – следствия проявления общего закона, в соответствие с которым давление насыщенного пара растворителя над раствором нелетучего вещества меньше давления насыщенного пара над чистым растворителем при тойже температуре.
Закон Рауля: Первый закон Рауля
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль, где
p — давление пара над раствором, ПА;
p0 — давление пара над чистым растворителем;
χр-ль —— мольная доля растворителя.
Для растворов электролитов используют несколько другую форму уравнения, позволяющую добавить в неё изотонический коэффициент:
Δp = i · p0 · χв-ва, где
Δp — собственно изменение давления по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе
