
30 сент 2013
.docxЗакон Рауля.
Насыщенный пар-пар, находящийся в равновесии с его жидкостью.
Рис 1














 Рис
2 C1 C2 C3
Рис
2 C1 C2 C3


 p
p


 C
C
Давление насыщенного пара раствора равна молярной дои растворителя.
Форм 1
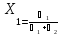 Давление
можно измерить в паскалях, в мм. рт. ст.,
и т.д.
Давление
можно измерить в паскалях, в мм. рт. ст.,
и т.д.
Понижение разности давления.
Форм 2.
ΔP=P0-P X1-мольная доля растворителя
 2 X2-мольная
доля растворенного вещества
2 X2-мольная
доля растворенного вещества
X1+X2=1
Относительное понижение давление насыщенного пара растворителя над раствором = мольная доля растворенного вещества.
Относительное давление насыщенного пара приводит к
Температура кипения - температура, при которой происходит уравновешенность внутреннего давления.
Если раствор кипит при более высокой температуре, то давление повышено.
-
Следствие – повышение температуры кипения прямо пропорционально моляльности раствора.
Моляльность показывает, сколько моль вещества приходится на 1 кг растворителя.
-
Метод определения моляльных масс по температуре понижения раствора носит название криоскопия.
Форм 3.
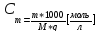
Форм 4.

Электролиты в результате электролитической диссоциации распадаются на ионы
Электролит диссоциацией называется самопроизвольно распад на ионы в растворе или расплаве. Вследствие диссоциации увеличивается число частиц. Для того чтобы закон Рауля и следствие из него, закон вант-Гоффа для осмоса можно было использовать для электролитов, надо ввести поправочный коэффициент , который показывает во сколько раз увеличивается число частиц вследствие электролитической диссоциацией.
Электролиты распад на ионы. Обозначим:
этот закон можно применять для электролитов.
Коэффициент можно определить экспериментально, нужно поделить Р осмоса электролита на Р осмоса неэлектролита.
Для сильных электролитов вводится кажущийся коэффициент диссоциации.
При бесконечном разбавлении стремится к 1. Показ число молекул, стремящихся к ней. NaCl (2)
Растворимость газа в жидкостях(закон Генри Дальтона)
Зависимость растворимости газа от давления.
Растворимость газов прямо пропорциональна давления газа над раствором .
Дальтон добавил: растворимость каждого элемента прямо пропорциональна его парциальному давлению.
Форм 6.
P(i)=Pобщ *N(i)
C(x)=C0(x)*e-K0*С(электролита )
коэффициент пропорциональности называется константой генри имеет размерность(Па/л)
Мало растворяется закон генри дальтона используется в терапевтических целях(лечение в барокамерах более 2 атмосфер О2)
Закон генри дальтона имеет и отрицательные явления.
Растворение газов в растворах электролитах называется законом Сеченого.
Газы в растворах электролитов растворяются хуже чем в чистой воде.
Форм 7.
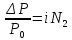 ΔTкип=i*Cm*Eобр
ΔTкип=i*Cm*Eобр
ΔTзам=i*Cm*Eкриос
Зависимость степени диссоциации слабого электролита от концентрации раствора.
Возьмем уксусную кислоту. Форм 8.

 CH3COOH
CH3COO-
+ H+ Ka
– степень разведения
CH3COOH
CH3COO-
+ H+ Ka
– степень разведения
Ka=
Если диссоциация очень незначительна, 1-альфа стреми к 1.
Математическая запись закона разведения Остфальда.
Форм 9
 отсюда С растет, а Ka
уменьшается
Аррениус считал, что различие
между слабыми с сильными электролитами
только в степени диссоциации.
отсюда С растет, а Ka
уменьшается
Аррениус считал, что различие
между слабыми с сильными электролитами
только в степени диссоциации.
Если степень диссоциации меньше 3, то это слабый электролит.
В растворах сильных электролитов молекул нет, есть только ионы.
В растворах сильных электролитов имеются ионы, ионный пары и ионные атмосферы, поэтому создается впечатление, что есть молекулы.
Для того чтобы сделать законы применимыми, была введена активность концентрации.
Рассчитав ионную силу раствора можно высчитать коэф активности.
Дебай и Хюккер сформулировали предельный закон Дибая-Хюккера:
- коэффициент активного иона в разбавленных растворах не завис от его природы, а зависит от заряда и ионной силы раствора.
В уравнении для всех расчётов надо вставлять активность ,а не концентрацию.
Электролитическая диссоциация воды-водородный показатель. Вода является слабым амфотерным электролитом и диссоциации ее может быть записан 2мя способами.
Закон действующих масс диссоциации воды 1,82*10-16.
Форм 11
Kw=Kдис [H2O]=[H+]+[OH-]=10-14
рН-водородный показ и гидрокс показ
форм 12.
pH+pOH=14
Измен рН используется в клиническом анализе.
рН крови=7,35+-0,08
рНжел сок=1-2
рНмоча=4,8-8,0
расчет рН растворов сильных кислот и оснований
форм 13 [H+]=C*α=C√(K_a/C)=√KC
pH=-lg(an) lg[H+]=0,5(lgKa+lgC)
pH=-lg[H+] -lg[H+]=0,5(-lgKa-lgC)
Найти pH 0,001 моль HCl pH=0,5(pKa-lgC)
pH=-log0,001=3 pH=14-0,5(pKa-lgC)
найти pH 0,002M NaOH
pH=14-pOH
сила электролитов характеризуется величиной степени диссоциации.
Форм 14
Kдис >10-2 - сильн
Теория кислот оснований.
В наст время в химии используется теория кислот и основании теоритическая. Кислота -электролит, при диссоциации которого в качестве катиона образ только катионы Н, основание-электролит, при диссоциации которого образ только гидроксид анионы.
Если мы переход к органическое соединение, то большинство этих веществ неэлектролиты либо очень Слаб электролиты.
Протеолитическая теория оснований(бейстет и лоури)
Кислотами называется вещества, отдающие протоны.
Основание- вещества, получающие протоны
кислоты могут быть нейтральными, анионный, катионными. Сильной кислоте (хорошему донору протонов)
Соответствует сильное основание.
Вода проявляет двойственное свойства, она может принимать протоны, так и отдавать протоны.
Аминокислоты и белки являются амфотерными.
3 теория-электронная теория кислот и оснований(льюис)
С точки зрения теории кислотой является молекула, имеющая вакантную орбиталь.
В образ комплексное соединение, катион имеет вакантные орбитали.
между кислотой и основанием образ внутренняя сфера комплекса.
Теория ЖМКО:
кислоты:
-
Жесткие(большой заряд)
-
Мягкие(большой радиус и небольшой заряд)
-
Средней жесткости. Металлы жизни(4 период)
Основания
-
Жесткие
-
Средней жёсткости.
Теория ЖМКО говорит, что наиболее прочные сильные связи между кислотами и основаниями одной классификации.
