
Амины
Классификация и номенклатура
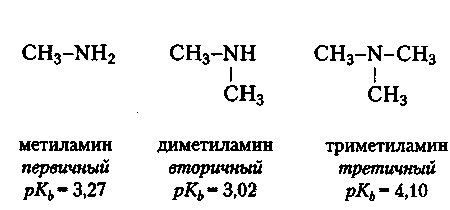
Аминами являются органические производные аммиака, в молекуле которого один, два или три атома водорода заменены радикалами. По этому признаку различают первичные (RNH2), вторичные (R2NH) и третичные (R3N) амины.

![]()
По принципам рациональной номенклатуры название этого класса веществ складывается из названия радикалов при атоме азота, именуемого амином. В названии первичных аминов по международной номенклатуре аминному атому азота присваивается название ами-но, употребляемое с указанием его местоположения перед названием углеводородной цепи. Впрочем, многие амины сохранили.свои тривиальные названия, например, анилин'.
Кроме аминогруппы в молекулах органических веществ могут находиться и иные заместители, как это, к примеру, имеет место в случае сульфаниловой кислоты. Аминный атом азота может быть включен и в насыщенный цикл. К числу насыщенных гетероциклических аминов относится построенный с напряжением трехчленный этиленимин, обладающий сильным мутагенным действием. Этилениминовый цикл входит в состав молекул некоторых лекарств. Без напряжения построены тетрагидропиррольный и пиперидиновый циклы, присутствующие в молекулах ряда алкалоидов (в том числе никотина и анабазина, см. разд. 20.4). С их участием, как и с помощью морфолинового кольца, построены молекулы многих лекарственных средств.




Гетероциклическими ароматическими аминами являются, к примеру, пиррол и пиридин. Наконец, аминогруппа может быть связана и с гетероциклом, что иллюстрируется примером аденина (6-аминопурина) — незаменимого фрагмента нуклеиновых кислот.

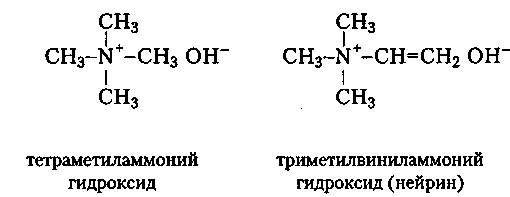
К числу производных аммиака относятся и органические вещества, которые можно построить из солей аммония или его гидроксида замещением всех четырех атомов водорода различными углеводородными радикалами, как это видно на примере тетраметиламмоний гидроксида:

Другим примером тетразамещенных аммонийных производных — четвертичных аммониевых оснований или их солей — служит нейрин, токсичное вещество, образующееся в процессе гниения тканей животного происхождения.
Четвертичный атом азота может входить в состав гетероциклов, например, соответствующей соли из ряда пиридина — N-алкилпиридиниевой соли. К таким четвертичным солям относятся некоторые алкалоиды. Кроме того, четвертичный атом азота входит в состав многих лекарственных веществ и некоторых биомолекул.
Выше приведенные примеры демонстрируют многообразие аминосоединений и их большое медико-биологическое значение. К этому необходимо добавить, что аминогруппа входит в состав таких классов биомолекул, как аминокислоты и белки, нуклеиновые кислоты, присутствует в ряде природных производных углеводов, именуемых аминосахарами. Аминогруппа является важнейшей функциональной группой алкалоидов и многочисленных лекарственных препаратов самого различного назначения. Отдельные примеры таких веществ будут приведены ниже.
24.3.2. Амины как органические основания
![]()
 Наличие
свободной электронной пары азота
сообщает аминам свойства оснований.
Поэтому
характерной особенностью аминов
является реакция с кислотами с
образованием соответствующих
аммониевых солей, что видно из реакции
для первичного предельного амина:
Наличие
свободной электронной пары азота
сообщает аминам свойства оснований.
Поэтому
характерной особенностью аминов
является реакция с кислотами с
образованием соответствующих
аммониевых солей, что видно из реакции
для первичного предельного амина:
Аналогично из анилина образуется анилиниевая соль, из пиридина — пиридиниевая и т.д. Подобно аммиаку, амины в водных растворах создают щелочную среду, согласно уравнению:
![]()
Количественно основность азотсодержащих оснований в водной среде отражается величиной константы равновесия (Кь) (чаще используют величинурКь) илир/Са(ВН+), характеризующей кислотность сопряженной кислоты данного основания.
![]()
Наиболее сильными основаниями будут соединения, содержащие атом азота, у которого неподеленная пара азота находится на неподеленной 5р3-гибридной орбитали (алифатические амины, аммиак, аминокислоты), а наиболее слабыми — те, у которых эта пара участвует в р,п-сопряжении (амиды, пиррол, пиридин).
Электронодонорные заместители, к которым относятся алкильные группы, должны увеличивать основность аминов, поскольку увеличивают электронную плотность у атома азота. Так, метиламин (рКь = 3,27) является более сильным основанием, чем аммиак (рКь = 4,75), а диметиламин (рКь = 3,02) — более сильное основание, чем метиламин. Однако при переходе к триметиламину, вопреки ожиданию, основность несколько падает (рКь = 4,10). Причина этого состоит в том, что с увеличением числа заместителей у атома азота подход протона все более затрудняется. Таким образом, здесь речь идет не об электронном, а пространственном влиянии заместителей. Это воздействие заместителей называют стерическим фактором.
Ароматические амины — более слабые основания, чем предельные, из-за электроноак-цепторного эффекта ароматического кольца. Поэтому невысока основность и пиридина. Накопление фенильных заместителей заметно подавляет активность электронной пары атома азота. Так, рК,, дифениламина составляет 13,12, а трифениламин совсем не проявляет свойств основания.
Чрезвычайно низкая основность пиррола вызвана тем, что в его молекуле электронная пара атома азота вовлечена в образование бл-электронной ароматической связи. На ее связывание с протоном требуется значительная дополнительная затрата энергии. В результате образования пирролиевых солей ароматическая связь, а, следовательно, и стабильность молекулы исчезают. Этим объясняется то, что пиррол в кислой среде быстро осмоляется.
Интересно отметить, что сильный электроноакцепторный эффект, оказываемый пир-рольным циклом на атом азота, приводит к ослаблению связи N-H, в силу чего пиррол способен проявлять свойства слабой кислоты (рКа = 17,5).
![]()
Под действием такого активного металла, как калий, может быть приготовлена его калиевая соль — пиррол-калий.
Кислотные свойства связи N-H пиррольного цикла объясняют, в частности, способность порфина и его природных производных к образованию солей с катионами металлов. Два пиррольных кольца молекулы порфирина координируются с катионом за счет электронных пар своих атомов азота, а два других — заменяя атомы водорода, как и молекула самого пиррола при образовании пиррол-калия. Именно такими солями и являются хлорофилл и гемоглобин

