
- •6. Индивидуальные взрывчатые материалы и их производство
- •6.1. С-нитроеоединения. Тротил
- •6.2. О-нитросоединения. Тэн, нитроглицерин, нитроцеллюлоза
- •6.3. N-нитросоединения. Гексоген, октоген
- •7. Смесевые взрывчатые материалы и их производство
- •7.1. Смесевые взрывчатые вещества
- •7.2 Пиротехнические составы
- •7.3. Смесевые твердые ракетные топлива
- •7.4. Бездымные пороха
- •8. Принципы и пути снижения опасности производства взрывчатых материалов
- •8.1. Основные требования к размещению объектов производства взрывчатых материалов
- •8.2. Автоматизация производства
- •8.3. Минимизация объемов загрузки производства взрывчатыми материалами
- •8.4. Экологические аспекты производства взрывчатых материалов
- •9. Применение взрывчатых веществ
- •9.1. Применение взрывчатых веществ в боеприпасах
- •9.1.1. Артиллерийские снаряды и мины
- •9.1.2. Применение взрывчатых веществ в авиабомбах и головных частях ракет
- •9.1.3. Применение взрывчатых веществ в противотанковых и зенитных средствах поражения
- •9.2. Применение взрывчатых веществ в народном хозяйстве
- •9.2.1. Применение взрывчатых веществ при разработке залежей и добыче полезных ископаемых
- •9.2.2. Применение взрывчатых веществ в строительстве
- •9.2.3. Применение взрывчатых веществ в других областях
- •10. Применение порохов
- •10.1. Применение порохов в военной области
- •10.1.1. Применение порохов в ствольной артиллерии
- •10.1.2. Применение порохов в стрелковом оружии
- •10.2. Применение порохов для гражданских целей.
- •11. Применение твердых ракетных топлив
- •11,1. Применение твердых ракетных топлив в военной области
- •11.2. Применение твердого ракетного топлива для гражданских целей
- •12. Применение пиротехнических составов
- •12.1. Применение пиротехнических составов в военной области
- •12.1.1. Сигнальные и целеуказательные пиротехнические средства
- •12.1.2. Осветительные и фотоосветительные пиротехнические средства
- •12.1.3. Пиротехнические составы в средствах зажигания
- •12.1.4. Применение пироеоставов в дымовых маскировочных средствах
- •12.1.5. Иные области применения пиросмесей в военных целях
- •12.2. Применение пиротехнических составов и изделий в народном хозяйстве
- •Литература
- •. К части II
- •Содержание
- •1. Общая характеристика взрывчатых материалов 9
- •2. Виды превращений взрывчатых материалов ,. 45
- •3. Возбуждение взрывчатого превращения 113
- •4. Мощностные характеристики взрывчатых материалов 142
- •10. Применение порохов 281
- •11. Применение твердых ракетных топлив 324
- •12. Применение пиротехнических составов 351
6. Индивидуальные взрывчатые материалы и их производство
Взрывчатые материалы представляют собой индивидуальные химические вещества или смесевые составы.
К индивидуальным ВМ, применяемым в практической деятельности, относятся штатные бризантные взрывчатые вещества (БВВ) и компоненты бездымных порохов (НЦ и НГ):
2,4,6-тринитротолуол (тротил, тол, ТНТ), (I);
4,3,5-тринитро-1,3,5-триаза-цикло-гексан или цикло-три-метилентринитрамин (гексоген, циклонит), (II);
1,3,5,7-тетранитро-3,5,7-тетрааза-цикло-октан или цикло-тетраметилентетранитрамин (октоген), (III);
тетранитрат пентаэритрита (ТЭН, пентрит), (IV);
нитраты целлюлозы (пироксилин №1, №2, пироколлодий, коллоксилин), (V);
тринитрат глицерина (нитроглицерин), (VI)

К смесевым ВМ относятся многочисленные промышленные ВВ, состоящие или из смеси бризантного ВВ с окислителем, или из смеси невзрывчатого горючего и окислителя, всевозможные марки дымных и бездымных порохов, ТРТ и пиротехнические составы различного назначения.
Учитывая, что производство индивидуальных и смесевых ВМ имеет значительные отличия по характеру технологических операций и аппаратурному оформлению, целесообразно отдельно рассмотреть принципиальное построение их технологических процессов.
Технологический процесс производства индивидуальных ВМ обычно включает следующие стадии: подготовку сырья; синтез; отделение продукта от реакционной среды и промывку; очистку, стабилизацию; переработку продукта с целью придания необходимых эксплуатационных свойств (чешуирование, грануляция, флегматизация); сушку; развеску, укупорку и переработку отходов производства.
Индивидуальные взрывчатые материалы 1-У1 относятся к классу нитросоединений и получаются путем нитрования соответствующего органического сырья.
В реакции нитрования должны участвовать как минимум два реагента - нитруемый и нитрующий. Нитрующим агентом в промышленном синтезе является азотная кислота (АК) или ее смесь с серной кислотой (серно-азотная кислотная смесь, САКС).
Азотная кислота является сильной минеральной кислотой и представляет собой бесцветную или различной интенсивности желтого цвета жидкость (в зависимости от количества оксидов азота). Плотность, безводной АК 1,52 г/см3, температура плавления минус 41,2°С, температура кипения 86°С.
Серная кислота (СК) представляет собой маслянистую жидкость. Плотность моногидрата (100% СК) 1,86 г/см3, температура кипения 290°С, температура замерзания (94% СК) минус 25°С. Серная кислота является более сильной по сравнению с АК и реакция протолиза при их взаимодействии протекает согласно уравнению:

В условиях промышленного производства ВМ находят применение разбавленная (48-60%) и концентрированная (98%) АК, СК концентрации 94% (купоросное масло), меланж (смесь, содержащая 87-89% АК, 7,5% СК) и олеум различной концентрации (серная кислота, содержащая свободный серный ангидрид).
В производствах периодического режима из АК и СК на стадии подготовки сырья готовится САКС в аппаратах--смесит елях путем слива СК в перемешиваемую АК при температуре не выше 40-50°С.
В непрерывных производствах для создания нитрующей среды кислоты подаются непосредственно в реактор без предварительного смешивания.
Поступающее на производство органическое сырье на стадии подготовки подвергается размельчению, просеиванию, а при волокнистом характере сырья - рыхлению. Затем сырье высушивается до требуемого уровня влажности. Причем сушка, как правило, совмещается с транспортировкой сырья путем подачи горячего воздуха в транспортную магистраль -пневмотрубу, различного рода ленточные, ковшевые, шнековые транспортеры.
Все виды поступающего на производство сырья в обязательном порядке подвергаются входному анализу с выдачей заключения о соответствии его предъявляемым требованиям.
Стадия синтеза заключается в проведении реакции превращения сырья в нитросоединение. В приведенном перечне 1-У1 индивидуальных ВМ присутствуют нитропроизводные различных классов: С-нитросоединение (тротил), в котором нитро-группа присоединена к атому углерода; М-нитросоединения или нитрамины, в которых нитрогруппа находится у атома азота аминной группы (гексоген, октоген) и Онитросоединения или нитроэфиры спиртов, в которых нитрогруппа присоединена к кислороду гидроксильной группы спирта (ТЭН, НГ, НЦ).
Все они получаются в результате реакции взаимодействия исходного вещества с АК по уравнению

В настоящее время доказано, что реагирующей частицей в реакции нитрования является нитроний катион (NО2+), который образуется в результате самоионизации азотной кислоты или ионизации азотной кислоты в среде серной кислоты.
Самоионизация азотной кислоты идет в соответствии со схемой:

где N02+- нитроний катион; Н2NОз+- yитроцидий катион; НзО+-гидроксоний катион.
В безводной АК при минус 40 °С ионизировано 3,4 % HNО3 (концентрация N02+ составляет 1,2%), а при комнатной температуре - 2% НNО3 (концентрация NО2+ составляет 0,7%). При добавлении воды в абсолютную АК степень ионизации резко сокращается и при 5-8% Н2О обнаружить физическими методами наличие нитроний катиона не удается. Однако при взаимодействии АК такой концентрации с ароматическими углеводородами наблюдается образование нитропроизводных, что косвенно свидетельствует о наличии нитроний катиона.
Наличие серной кислоты способствует ионизации АК с образованием нитроний катиона. Реакция ионизации в этом случае идет в соответствии со схемой:

В табл. 6.1 приведена степень ионизации АК и концентрация нитроний катиона в САКС различного состава.
Таблица 6.1 - Степень ионизации азотной кислоты в смесях с серной кислотой

Данные табл. 6.1 показывают, что концентрация нитроний катиона в этом случае значительно превышает таковую в одной азотной кислоте.
Принимая во внимание то, что скорость реакции находится в прямой зависимости от концентрации реагента (в данном случае нитроний катиона), о СК можно говорить как об ускорителе реакции. Кроме того, СК способствует протеканию реакции нитрования в качестве агента, связывающего выделяющуюся воду.
Реакция нитрования ароматических углеводородов относится к реакциям эдектрофильного замещения (SЕ). Механизм ее выражается трехступенчатым взаимодействием согласно схеме:
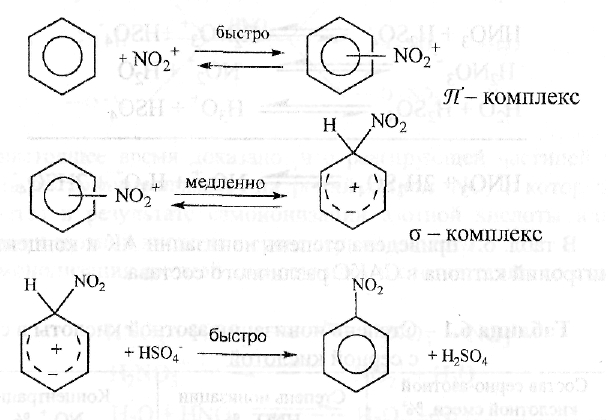
На первой стадии образуется Л - комплекс за счет взаимо-дейстия К- электронной системы ядра и !ЧО2+. На второй стадии происходит перестройка Я'- комплекса, при которой >Ю2+ взаимодействует с определенным углеродным атомом ядра с образованием о - комплекса. На завершающей стадии происходит де-протонизация с - комплекса и связывание протона бисульфат анионом (или нитрат анионом при нитровании одной азотной кислотой).
В реакциях К- и О-нитрования атаке нитроний катиона подвергаются имеющие свободные пары электронов атомы азота и кислорода нитруемого соединения. В результате образуются промежуточные комплексы, которые депротонируются при действии аниона:

Исход реакции образования нитросоединений зависит от нитрующей активности смеси кислот и реакционной способности нитруемого органического соединения.
Активность нитрующей смеси принято выражать через фактор нитрующей активности (Ф), который представляет концентрацию серной кислоты в смеси кислот при условии полного израсходования азотной кислоты на нитрование. Рассчитывается фактор нитрующей активности по формуле

где 8 и N - концентрации СК и АК в исходной кислотной смеси.
