- •Вопросы теории нитрования
- •Лекция 1
- •Принципиальная схема цеха по получению нитросоединений
- •РЕАКЦИОННЫЙ УЗЕЛ (СТАДИЯ НИТРОВАНИЯ)
- •1. Тип реакции нитрования
- •Нитрующие системы и нитрующие агенты
- •Уксусно-ангидридные нитрующие смеси
- •Нитрующая активность уксусно-ангидридных смесей на примере циклических мочевин
- •Нитрующие смеси на кислотной основе
- •Механизм нитрования
- •Образование иона нитрония
- •Образование нитроний иона в серно-азотных смесях
- •Лекция 2
- •Серная кислота и ее гидраты
- •Азотная кислота и ее гидраты
- •Ионно-молекулярный состав серной кислоты
- •Функции кислотности
- •Физический смысл и меры основности в газовой фазе
- ••В зависимости от концентрации минеральной кислоты, характер специфической сольватации непрерывно меняется. Избыточные протоны,
- ••Гаммет и Дейруп: серия органических соединений, обладающие максимально сходной молекулярной структурой, так называемых
- ••Функция кислотности Н0 с успехом применяется для количественного сравнения слабых оснований, протонирование которых
- ••Кроме функций Нo и Hr существуют функции построенные на других рядах индикаторов: амидах
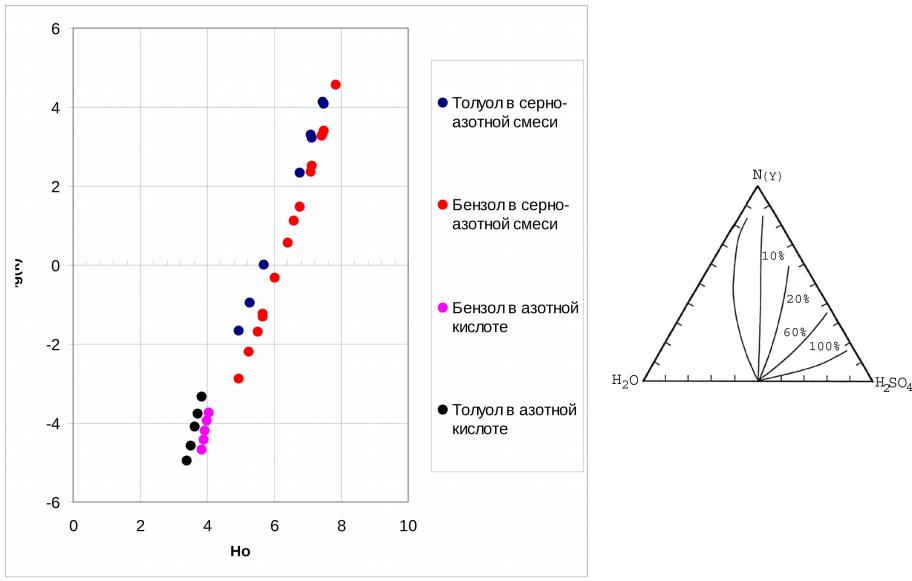
- •Образование иона нитрония в растворах азотной кислоты в водной серной кислоте.
- •• Лекция 3
- •Химическая кинетика и химическая динамика: иерархия времён
- •Смесь №1 54,53% HNO3, 20,31% H2SO4, 25,16% H2O Смесь №2 3,6% HNO3, 67,47%
- •Е, кДж/моль
- •Кинетика нитрования 6-гидрокси-2-метилпиримидин-4(3Н)-она и 2-метокси-2-метилимидазолидин-4,5-диона
- •7.6.Схема нитрования биурета
- •Примеры обработки
- •Определение pKa 4-фенил-1,2,4-триазол-5-она
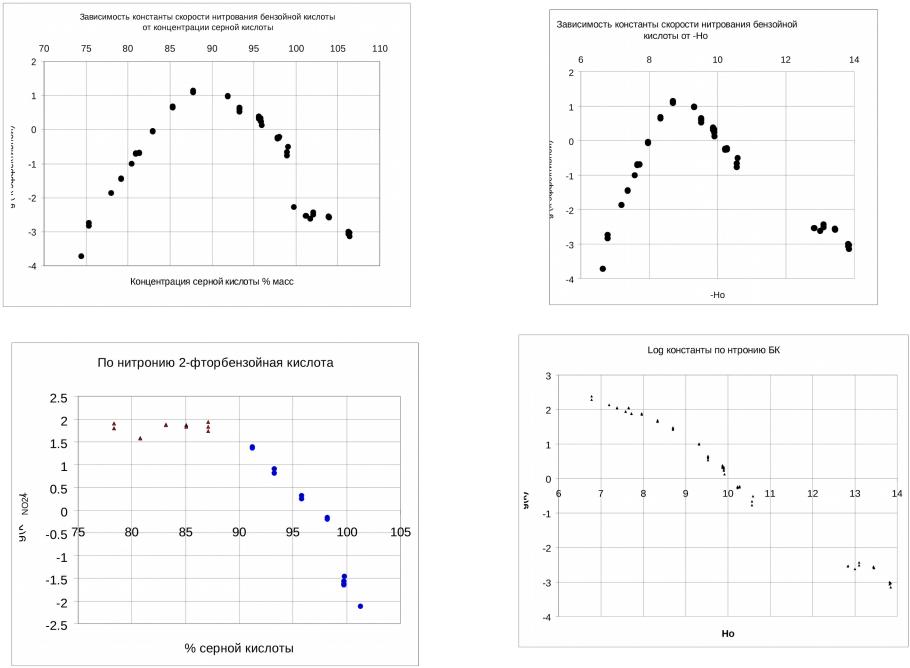
- •Зависимость констант скоростей нитрования
- •Зависимость констант скорости образования НТО и N-НТО рассчитанных по модели № 3 от
- •Рис. Зависимость эффективной константы скорости
- •ТЕПЛОВЫЕ ЭФФЕКТЫ ПРИ НИТРОВАНИИ
- ••Суммарный тепловой эффект нитрования при получении
- •Тепловой эффект основных реакций идущих при получении
- •Кинетика гетерогенных процессов
- •Влияние азотистой кислоты
- ••Изучение кинетики каталитического процесса строго доказало первоначальное нитрозирование с последующим быстрым окислением С-нитрозосоединения
- •Влияние оксидов азота на скорость нитрования замещенных пиримидинов в среде 72-82% серной кислоты
- •Кинетика нитрования ГМП до 6-гидрокси-2-метил-5- нитропиримидин-4(3Н)-она в 72-82% H2SO4
- •Определение констант основности ГМП
- •Зависимость истинных констант скоростей второго порядка нитрования ГМП от концентрации серной кислоты
- •Зависимость эффективных констант скоростей процесса нитрования барбитуровой кислоты от концентрации H2SO4 при 25°С,
- •Порядок реакции нитрования ГМП по азотной кислоте в 79% H2SO4
- •Порядки реакции нитрования ГМП по азотной кислоте и нитриту натрия в 72% H2SO4
- •Последующие исследования показали, что при каталитическом действии низших оксидов азота не всегда происходит
- ••В 70-80-е годы образование относительно стабильных катион-радикалов (КР) спектральными методами или в форме
- •По ион-радикальному механизму с переносом электрона протекает реакция с тетранитрометаном. Ее применяют для
Химическая кинетика и химическая динамика: иерархия времён
|
|
, сек |
Техника |
КИНЕТИКА |
105 |
– 102 |
Контроль проб |
102 – 10-2 |
Струя |
||
|
10-2 |
– 10-4 |
Остановленная струя |
|
10-4 |
– 10-8 |
Молекулярные пучки |
|
10-8 – 10-11 |
лазерные технологии |
|
ДИНАМИКА |
10-12 – 10-15 |
Современные лазеры |
|
|
|||
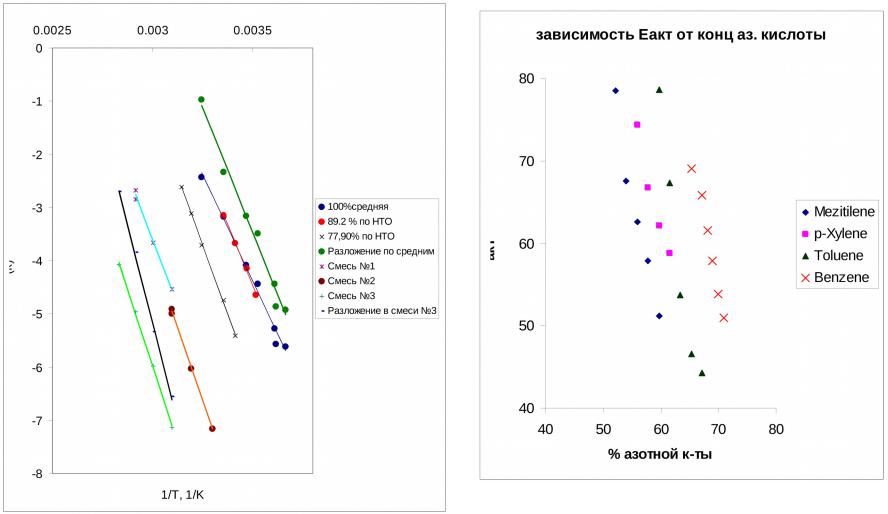
Смесь №1 54,53% HNO3, 20,31% H2SO4, 25,16% H2O Смесь №2 3,6% HNO3, 67,47% H2SO4, 28,93% H2O Смесь №3 3,2% HNO3, 89,05% H2SO4, 7,75% H2O
Е, кДж/моль |
Е, ккал/моль |
HNO3 |
77,9% |
86,0 |
20,53 |
HNO3 |
89,27% |
76,5 |
18,27 |
HNO3 |
100% |
66,8 |
15,94 |
Разложение в 100% HNO3 |
76,5 |
18,27 |
|
Смесь №1 (54,53% HNO3, 20,31% H2SO4) |
89,96 |
21,47 |
|
Смесь №2 (3,6% HNO3, 67,47% H2SO4) |
82,1 |
19,6 |
|
Смесь №3 (3,2% HNO3, 89,05% H2SO4) |
96,8 |
23,1 |
|
Разложение в смеси №3 |
123,8 |
29,55 |
|
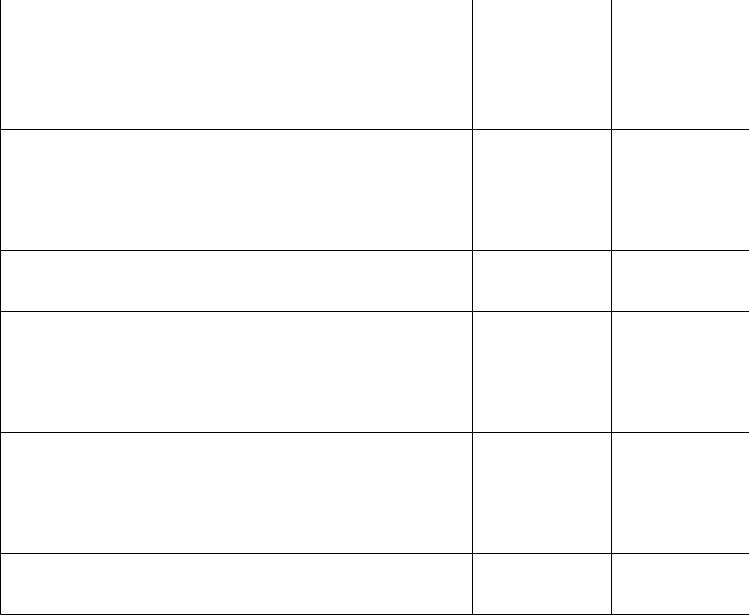
Кинетика нитрования 6-гидрокси-2-метилпиримидин-4(3Н)-она и 2-метокси-2-метилимидазолидин-4,5-диона
Метод исследования
Максимумы поглощения (λ) и величины молярных коэффициентов экстинкции (lg (ε)) компонентов, присутствующих в реакционных массах при нитровании
|
|
|
Соединение |
|
|
|
Параметр |
6-гидрокси-2- |
6-гидрокси-2- |
2-(динитрометилен)- |
|
|
|
метил-5- |
5,5-динитро- |
|
|
|
||
|
метилпиримидин- |
тринитрометан |
|
ДАДНЭ |
||
|
нитропиримидин- |
пиримидин- |
|
|||
|
4(3Н)-он |
|
|
|
||
|
4(3Н)-он |
4,6(1Н,3Н,5Н)-дион |
|
|
|
|
|
|
|
|
|
||
λ, нм |
252 |
324 |
336 |
352 |
278 |
348 |
lg (ε) |
4,07 |
3,80 |
4,32 |
4,07 |
3,78 |
4,05 |
Нитрование ГМП. Пробы до гидролиза |
Нитрование ММИД. Пробы после гидролиза |
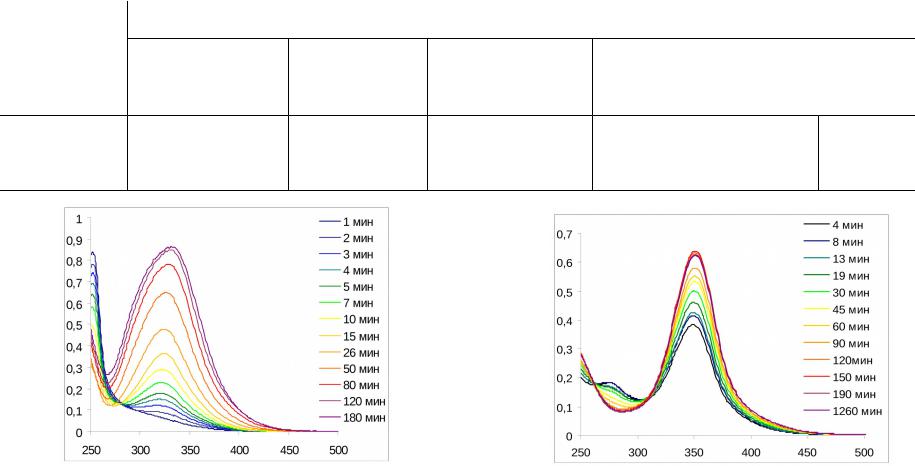
|
|
|
Пример кинетической кривой нитрования в |
|||||||
|
серно-азотной нитрующей смеси, содержащей |
|||||||||
|
|
|
|
73,5% серную кислоту, при 60оС. |
|
|||||
|
|
|
Модель:D=A+B*exp(-k*t) |
|
|
w k[TO][HNO ]n |
||||
|
d=1,08693-1,079*exp(- |
|
0 ,015064*t |
), 316 нм |
n |
? |
3 |
|||
|
|
|
||||||||
|
1,2 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
1,0 |
|
|
|
|
|
|
Концентра- |
Константа |
Константа |
|
|
|
|
|
|
|
|
ция |
первого |
второго |
|
0,8 |
|
|
|
|
|
|
азотной |
порядка к1, |
порядка, |
|
|
|
|
|
|
|
|
кислоты, |
c-1 |
л/моль.с |
|
|
|
|
|
|
|
|
моль/л |
|
|
D |
0,6 |
|
|
|
|
|
|
1,84 |
0,0555 |
0,0300 |
|
|
|
|
|
|
|
|
|||
|
0,4 |
|
|
|
|
|
|
1,84 |
0,0544 |
0,0295 |
|
0,2 |
|
|
|
|
|
|
0,48 |
0,0151 |
0,0312 |
|
0,0 |
|
|
|
|
|
|
0,48 |
0,0171 |
0,0359 |
|
0 |
40 |
60 |
80 |
120 |
160 |
200 |
|
|
|
|
|
|
20 |
100 |
140 |
180 |
n 1 |
|
||
|
|
|
|
|
t, мин |
|
|
|
||
|
|
|
|
|
|
|
|
|
||
O O |
+NO + k |
|
|
O O |
|
+NO + k |
|
|
|
O |
|
|
O |
||||||||||||||||
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HN |
|
|
|
|
|
|
|
|
H2N N NH2 |
|
|
|
|
|
H2N N |
NH |
|
|
|
|
|
|
N NH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
H |
|
+H k-1 |
|
|
|
|
H |
NO |
|
+H+ k-2 |
|
|
NO |
H |
|
|
NO |
||||||||||
|
|
+ |
|
|
|
|
|
2 |
2 |
|
2 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
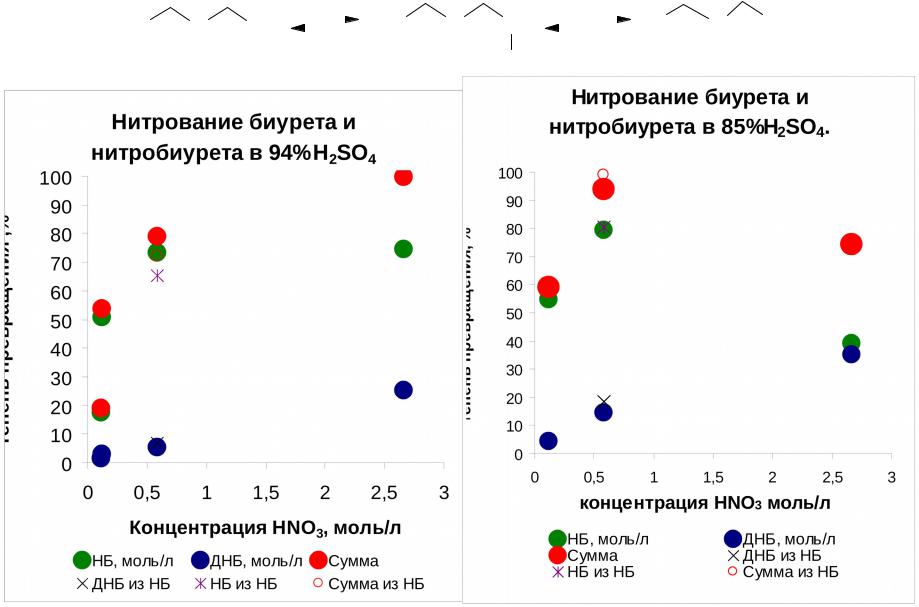
7.6.Схема нитрования биурета
O O |
+NO + k |
|
O |
O |
+NO2+ k2 |
|
O |
|
O |
|||||||||||||||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
H2N N NH2 |
|
|
|
|
|
H2N N |
NH |
|
|
|
|
HN |
|
N NH |
||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||
|
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
NO2 |
H |
|
|
NO2 |
||||||||
|
|
|
|
|
|
+H+ k-1 |
|
|
NO2 |
|
|
+H+ k-2 |
|
|
|
|||||||||||||||
К |
|
[НБ] |
[Н ] |
К2 |
[ ДНБ] |
[Н ] |
|
||||
1 |
|
|
|
|
|||||||
|
|
|
|||||||||
|
|
[Б] [NO ] |
|
[НБ] [NO2 ] |
|||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
[NO2 ] IHNO |
[HNO3 |
] |
1) |
||||||||
|
|
|
|
3 |
|
|
|
(IHNO |
|||
|
|
|
|
|
|
|
|
3 |
|
|
|
IHNO3 |
|
[NO ] |
|
|
|
|
|
|
|||
|
|
2 |
- степень ионизации HNO3 |
||||||||
|
|
||||||||||
|
|
|
[HNO3 ] |
|
|
|
|
|
|
||
Lg I = -1.27∙ HR – pKa HNO3
HR- функция кислотности
H0- функция кислотности
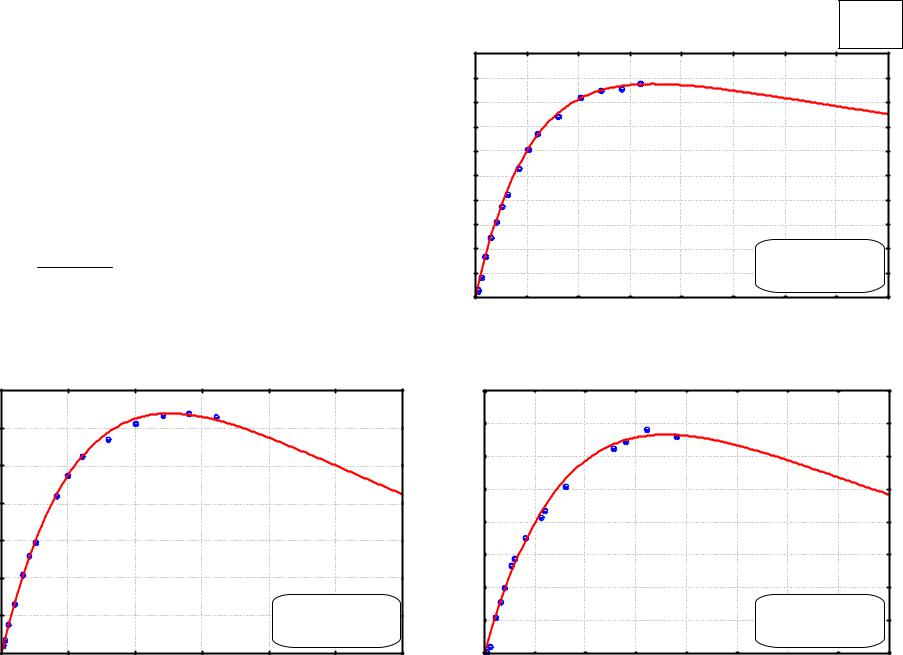
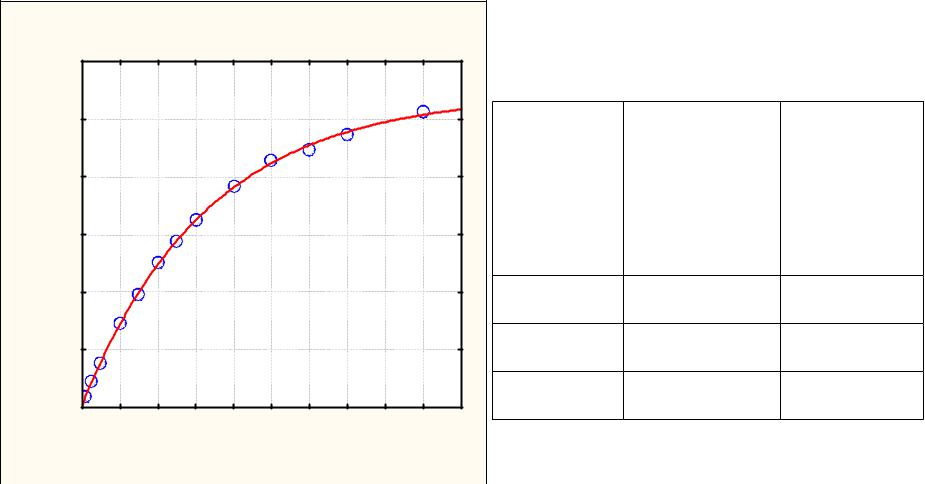
Примеры обработки |
|
|
0.020 |
||||||
|
|
|
|||||||
кинетических данных по |
|
0.018 |
|||||||
|
0.016 |
||||||||
|
|
уравнению для |
|
|
0.014 |
||||
|
|
|
|
|
|||||
|
последовательных |
|
|
0.012 |
|||||
|
|
C |
0.010 |
||||||
|
|
|
реакций |
|
|
|
|
0.008 |
|
|
|
|
|
|
|
|
0.006 |
||
c k1 c0 |
|
|
|
|
|
|
|||
exp( k1 t) exp( k2 |
t) |
|
0.0020.004 |
||||||
k |
2 |
k |
|
|
|
|
|
|
0.000 |
|
1 |
|
|
|
|
|
|
||
|
|
Модель:C=(k1*0,02117/(k2-k1))*(exp(-k1*T)-exp(-k2*T)) |
|
|
|
|
|
|
|
c=((,013881)*0,02117/((,004006)-(,013881)))*(exp(-(,013881)*t)-exp(-(,004006)*t |
)) |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
0.014 |
|
|
|
|
|
|
|
|
0.0040 |
0.012 |
|
|
|
|
|
|
|
|
0.0035 |
|
|
|
|
|
|
|
|
|
|
0.010 |
|
|
|
|
|
|
|
|
0.0030 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.0025 |
0.008 |
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
C |
0.0020 |
0.006 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.0015 |
0.004 |
|
|
|
|
|
|
|
|
0.0010 |
|
|
|
|
|
|
|
|
|
|
0.002 |
|
|
|
|
|
85 % |
|
0.0005 |
|
|
|
|
|
|
|
|
|||
0.000 |
|
|
|
|
|
|
0.0000 |
||
|
|
|
|
|
|
|
|
||
0 |
|
50 |
100 |
150 |
200 |
250 |
300 |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
Модель:C=(k1*Co/(k2-k1))*(exp(-k1*T)-exp(-k2*T)) |
|
|
|
20 |
||
c=((,018647)*(,020383)/((,875e-3)-(,018647)))*(exp(-(,018647)*t)-exp(-(,875e-3) |
|
|
|
|||||
|
|
|
*t)) |
|
|
|
||
|
|
|
|
|
|
80 % |
|
|
0 |
50 |
100 |
150 |
200 |
250 |
300 |
350 |
400 |
|
|
|
|
T |
|
|
|
|
|
|
Модель:C=(k1*0,02210/(k2-k1))*(exp(-k1*T)-exp(-k2*T)) |
|
|
|
|
|
|
|
c=((,002486)*0,02210/((,010559)-(,002486)))*(exp(-(,002486)*t)-exp(-(,010559)*t |
|
|
|
|
|
||
|
|
|
)) |
|
|
|
|
|
|
|
|
|
|
|
93 % |
|
|
0 |
50 |
100 |
150 |
200 |
250 |
300 |
350 |
400 |
|
|
|
|
T |
|
|
|
|