
- •3.1. Физико-химические и взрывчатые свойства ……………………
- •Физические свойства ……………………………………………
- •Химические свойства …………………………………………...
- •Взрывчатые свойства ……………………………………………
- •Таблица 1.2
- •Компоненты,%
- •Наполнитель
- •Свойства триаминотринитробензола
- •Детонационные характеристики ТАТНБ
- •Метансульфокислота
- •2.2. Получение в лаборатории и в промышленности
- •Стадия аминирования
- •2.3. Использование
- •3.1. Физико-химические и взрывчатые свойства
- •Рис.3.1. Пространственная структура нитротриазол-5-она (β-форма):
- •–атом азота, – атом углерода, – атом кислорода, – атом водорода
- •Таблица 3.5
- •Чувствительность НТО к различным видам воздействия
- •Позднее [131] условия синтеза были изменены: смешение компонентов проводили при 65 – 700С и мольном отношении ТО : НNО3 = 1: 4 – 8, и выход превысил 80%.
- •Схема получения ГНС из ТНТ при использовании NaOCl
- •Состав продуктов взаимодействия ТНТ с гипохлоритом натрия
- •Соединение
- •Содержание,%
- •Хроматография
- •ВЭЖХ*, время выхода, мин
- •6.3. Применение
через 30 минут реакцию смесь разбавляли водой, отфильтровывали выпавший осадок и высушивали. Выход технического НТО – 43 – 68% (после перекристаллизации из воды); т.пл. 265 – 2680С, образец помещали в блок, нагретый до 2500С. При медленном нагревании вещество не плавится до 3200С.
Метод нитрования в среде 70% HNO3, разработанный в США [99], первоначально предполагал смешение ТО с азотной кислотой при 200С и нагрев реакционной смеси до начала выделения оксидов азота. Далее реакция проходила в автотермическом режиме. Однако выход продукта был недостаточным.
Позднее [131] условия синтеза были изменены: смешение компонентов проводили при 65 – 700С и мольном отношении ТО : НNО3 = 1: 4 – 8, и выход превысил 80%.
Описан процесс, в котором чистый ТО не выделяют. Для получения НТО к 230 мл 85% муравьиной кислоты добавляли 223 г СК, и смесь при перемешивании нагревали до полного растворения последнего. Затем отгоняли избыток муравьиной кислоты до начала кристаллизации, добавляли 300 мл воды и продолжали дистилляцию, пока смесь станет почти сухой. Остаток охлаждали и к нему постепенно при охлаждении приливали 500 мл 70% HNO3. Реакционную смесь нагревали до 55–600С, выдерживали при этой температуре до завершения процесса, при котором образуется много оксидов азота, и охлаждали на ледяной бане до 50С. Отфильтрованный НТО промывали ледяной водой. Чистый НТО получали после перекристаллизации из воды и сушки в течение 24 ч при 700С. Выход не приводится.
Аналогичный синтез НТО описан в [133]. Конденсацию СК с 85% муравьиной кислотой проводили при 600С, и полученный продукт нитровали 99% азотной кислотой при 600С. Выход НТО – 73%.
75
Получение НТО на укрупненной лабораторной установке описано в патенте [131] в 2 вариантах: периодическом и непрерывном.
В периодическом процессе в реактор вместимостью 12 л загружают 6,67 л 70% азотной кислоты (6, 38 моль на 1 моль ТО) и нагревают ее до 650С. В течение 1 ч к этой кислоте постепенно присыпают 1,484 кг ТО при 65–700С, выдерживают еще 1 ч при этой температуре, охлаждают до 100С
иотфильтровывают НТО. Выход по ТО составляет 90%.
Внепрерывном процессе по окончании присыпания ТО к азотной кислоте в реакционную смесь, полученную аналогично периодическому процессу, начинают одновременно дозировать азотную кислоту (6,672 л/ч.)
иТО (1,484 кг/ч.) при 65–700С. Полученная суспензия непрерывно поступает в кристаллизатор, где охлаждается до 100С, и насосом прокачивается через фильтр. Выход НТО после сушки составил 83%.
П.Маречек с сотрудниками [134] при разработке процесса получения НТО сочли, что выделение оксидов азота при температуре выше 600С является недопустимым, и поэтому остановились на нитровании ТО концентрированной азотной кислотой, взятой в количестве 7,7 моль на моль ТО, при температуре 20–250С. Время реакции 2,5 ч. Кристаллизацию НТО проводят из воды. Другие данные о процессе не приводятся.
Использование для нитрования вместо азотной кислоты серноазотных кислотных смесей обычного состава приводит к резкому снижению выхода НТО из-за катализируемого кислотами расщепления цикла. Так в 50% серной кислоте за 40 мин при 1300С гидролизуется половина исходного НТО [135]. Этим объясняется отказ от использования серно-азотных кислотных смесей для нитрования ТО в течение длительного периода времени. Однако в последнее время появился ряд сообщений о получении НТО в среде серно-азотных кислотных смесей с
76
низким содержанием серной кислоты [93]. Указывается, что в таких системах обеспечиваются лучшие условия кристаллизации НТО [136] .
Во всех этих процессах выход НТО не превышает 90%. Чтобы выяснить природу потерь, в РХТУ были проведены работы по определению растворимости НТО в отработанной кислоте различной концентрации (см. рис 3.2) и по скоростям кислотного гидролиза НТО. Константы кислотного гидролиза НТО в среде 94,4 и 99,6% HNO3 при 250С составили соответственно 1·10-4 и 32·10-4 мин -1. Следовательно, влияние этого процесса на конечный выход в промышленных условиях незначительно.
Размер и форма частиц НТО и содержащихся в них примесей оказывают сильное влияние на свойства изготовляемых из него взрывчатых составов. При нитровании образуются, как правило, неровные пластинчатые кристаллы (содержащие остатки кислот и исходного ТО), в то время как для снаряжения целесообразно использовать кристаллы округлой формы.
В работе [137] авторы сообщают, что изучали возможность перекристаллизации НТО из различных растворителей, но в экспериментальной части не указали из каких именно. Показано, что склонность растворов к переохлаждению связана со скоростью охлаждения раствора и его пересыщением. Связь ширины метастабильной области Тm со скоростью охлаждения b описывается уравнением:
Тm = с.bl.Трm
где с, l, m – коэффициенты, Тр – равновесная температура. Приводятся значения с= 144,6; l=0,0905; m=-0,47.
Кристаллизация НТО из различных растворителей с использованием и без использования ультразвука рассмотрена в работе
77
[138]. Были изучены вода, метанол, изопропиловый спирт и ДМФА, но только в водных растворах удалось инициировать зародышеобразование под действием ультразвука. В остальных растворителях слишком велико время индукционного периода. В экспериментах без ультразвука растворяли при 400С 14,5 г НТО в 500 г воды и охлаждали со скоростью 200С/ч. Первые кристаллы появляются при 300С, основное осаждение происходит при 280С, средний размер частиц 345 мкм. В аналогичном опыте с использованием ультразвука генератор включали после охлаждения до 350С и уже при 33,50С начиналось образование кристаллов, которое происходило в основном при 31,50С. Получены кристаллы со средним размером 254 мкм и лучшим распределением частиц, кристаллы более прозрачные.
В патенте [139] указывается, что крупные неровные кристаллы НТО, получаемые при кристаллизации из воды, склонны к агломерации и при изготовлении составов резко увеличивают их вязкость, что затрудняет процесс заливки изделий. Мелкие кристаллы НТО с поверхностью 5,5–7,0 м2/см3 получают из обычных кристаллов (поверхность 0,27 м2/см3), если последние растворяют при нагревании в ДМСО и через отверстие малого (менее 0,7 мм) диаметра распыляют в метиленхлориде при 0–250С.
Частицы сферической формы получают при перекристаллизации НТО из низших спиртов (метанола, этанола и др.). НТО растворяют в спирте при температуре выше 40оС, но ниже температуры кипения, и охлаждают со скоростью 6–200С в минуту до +5 – –100С [140].
Подробное исследование процесса получения сферических частиц НТО было проведено в Корее [141]. Работы проводили в лаборатории (объем реактора 300 мл) и на стендовой установке (объем ~ 150 л). В качестве растворителя использовали 11–35% водные растворы NМП. Перед кристаллизацией растворы выдерживали 30 мин при температуре на
78
100С выше температуры насыщения и затем охлаждали с постоянной скоростью при постоянном перемешивании. Полученные кристаллы промывали насыщенным раствором НТО и высушивали при 800С. Сферические кристаллы лучше образуются при высокой скорости охлаждения (100/мин) и большем содержании воды в системе. При скорости 10/мин получаются сростки прямоугольных кристаллов. Средний размер частиц возрастает при понижении концентрации НМП от 50–100 мкм в 35% растворе до 200–300 мкм в 11%.
Так как анализ литературных данных по иностранным источникам не позволял однозначно ответить на вопрос, какой из существующих методов получения НТО в настоящее время является наиболее эффективным, а в научной литературе и патентах отсутствуют описания промышленных установок его производства, в России было проведено подробное исследование процессов получения НТО.
Описано два метода нитрования ТО: в среде концентрированной (98%) азотной кислоты и в среде 70% азотной кислоты.
Исследования, проведенные в РХТУ, показали, что использование 98% азотной кислоты приводит к образованию большего количества отработанных кислот, и реальный расход этой кислоты в 1,5-1,8 раза больше, чем при использовании 70% HNO3.
Так как регенерация отработанной кислоты является одним из наиболее сложных моментов в современном производстве ВВ (особенно с точки зрения защиты окружающей среды), значительно меньшие расходы на ее регенерацию при использовании 70% HNO3 определил оптимальный выбор. Приведенные эксперименты свидетельствуют о значительном влиянии концентрации азотной кислоты и модуля, которые определяют содержание нитрующего агента в системе, на скорость нитрования и,
79
следовательно, выход НТО. Показано, что скорости окислительных процессов низкие, хотя газовая фаза окрашена оксидами азота.
Установлено, что НТО может быть получен при нитровании 64– 70% азотной кислотой при 700С с выходом 80–82%. Выход НТО может быть повышен при повторном использовании отработанной кислоты для синтеза, что позволяет в 1,5 раза сократить количество расходуемой кислоты.
3.4. N-Нитро-1,2,4-триазол-5-он и его свойства
Как указано в разделе 3.3, при нитровании ТО в азотной кислоте с концентрацией выше 80% в первые минуты наблюдается появление
продукта с максимумом поглощения при 270 нм, которому |
было |
приписано строение 1-нитро-1,2.4-триазол-5-она (N-НТО) [142]. |
|
Чтобы установить его строение, продукт синтезировали |
при |
нитровании ТО в уксусно-азотной кислотной смеси и подтвердили его идентичность с соединением, образующимся в HNO3, методами УФспектроскопии и ВЭЖХ.
Структура N-НТО доказана по данным ИК-, ПМР- и хроматомассспектроскопии. В ИК-спектре присутствуют характеристические колебания карбонильной группы – 1773 см-1 и нитрогруппы – 1579 и 1325 см-1. В спектре ПМР присутствует синглет 9,8 м.д. (N-H) и дуплет 7,682 – 7,686 м.д. Наличие расщепления с константой 1,5 Гц указывает на соседнее положение атомов водорода в молекуле. В масс-спектре присутствуют сигналы с m/z 101 и 85, соответствующие отщеплению NO и NO2.
Наличие нитрогруппы в 1–положении подтверждается расчетными данными по теплотам образования промежуточных соединений (метод pm-3), представленными ниже:
80
Положение NO2-группы |
1 |
2 |
3 |
4 |
|
Теплота |
образования, |
|
|
|
|
ккал/моль |
|
201 |
256 |
212 |
205 |
кДж/моль |
|
840 |
1070 |
885 |
857 |
Проведенное недавно подробное квантово-химическое исследование всех возможных изомеров нитротриазолона показало, что продукт нитрования ТО в положение 1 (N-НТО) более стабилен, чем 4- нитротриазолон [143].
N-НТО – светло-желтое кристаллическое вещество – плавится при 100 – 101,50С с разложением, при быстром нагревании вспыхивает со звуком. Горит при атмосферном давлении со скоростью 1 см/с, при 10 МПа
– 10 см/с, приближаясь по этому параметру к инициирующим взрывчатым веществам.
N-НТО отличается низкой химической стабильностью и быстро разрушается как в среде кислот, так и в основных средах.
N-НТО интенсивно разлагается при взаимодействии с водой с выделением N2 (45–55%), N2O (13–19%) и CO2 (32–35%), что свидетельствует о полном расщеплении цикла. Необходимо отметить, что количество N2O, который является основным продуктом при кислотном гидролизе нитраминов, не превышает 0,5 моль на моль исходного продукта.
В сильных кислотах (серная, трифторуксусная), судя по спектрофотометрическим измерениям, N-НТО разлагается очень быстро, а количество образующегося НТО мало. В концентрированной серной кислоте N-НТО разлагается практически мгновенно.
N-НТО является нитрующим агентом. При его взаимодействии с о- и п-нитрофенолами в среде этилацетата он образует 2.4-динитрофенол. При контакте N-НТО с диметиланилином происходит бурная реакция,
81

сопровождающаяся выбросом. При смешении реагентов в среде ТГФ образуется смесь продуктов, включающая п-нитродиметиланилин.
3.5. Применение
Сведения об объеме производства НТО скудны. К 2000 г. его производили во Франции [144], США, Норвегии [145] и ряде других стран. Во Франции к 1993 г. фирма «SNPЕ» производила 25 т НТО в год, выпуская продукт 4 классов со средним размером частиц 450, 320, 68 и 17 мкм. В Норвегии фирма «Dyno» выпускала НТО двух классов партиями по 150 кг, при общей производительности около 10 т в год. Продукт с размером частиц 300 мкм получают перекристаллизацией, второй со средним размером 8 мкм – воздушным распылением.
В США консорциум Olin и Ensign-Bickford имел мощности 500 т в год и предполагал их дальнейшее увеличение. Фирма Dynamit Nobel в ФРГ производила примерно 500 т НТО в год [93]. Широко публикуются материалы об использовании НТО в различных ВС. Основные исследования, связанные с использованием НТО в качестве ВВ, проводятся фирмами «SNPE» (Centre de Recherches du Bouchet) во Франции, «Los Alamos National Laboratory» и «Eglin Air Force Base» в США.
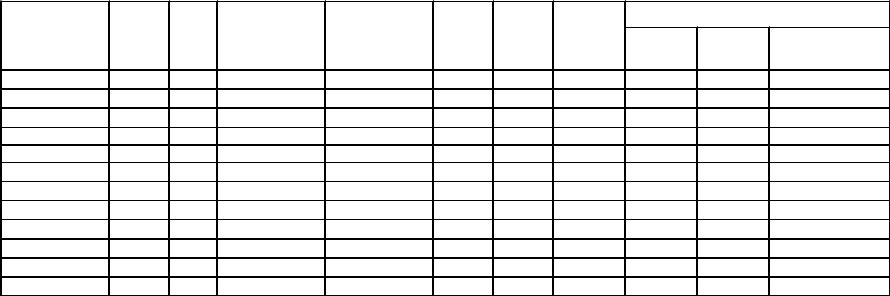
Первоначально основное внимание уделялось литьевым составам на основе НТО и тротила. Некоторые данные об этих составах представлены в табл.3.8.
Из данных таблицы видно, что замена части гексогена на НТО приводит к снижению мощности составов, но одновременно существенно повышает их безопасность.
Использование термопластичной связки в составе ТЕ-Т7005 позволяет осуществлять снаряжение на оборудовании для составов на
82
|
|
|
|
|
|
|
|
Таблица.3.8 |
|
|
|
|
Cостав и взрывчатые свойства литьевых ВС на основе НТО [93,146] |
|
|||||||
Название |
НТО, |
ТНТ, |
Другие |
Связующее, % |
D, м/с |
ρ, г/см3 |
Dкр, |
|
Чувствительность к |
|
состава |
% |
% |
добавки, ,% |
|
|
|
мм |
удару, |
трению, |
электрическому |
|
|
|
|
|
|
|
|
см |
Н |
разряду, Дж |
ТНТО’ |
50 |
50 |
– |
– |
7340 |
1,74 |
<16 |
91,5** |
41,5 |
0,062 |
ТНТО/ОD2’ |
52 |
42 |
– |
СмолаOD2*/6 |
6900 |
1,61 |
<25 |
>200** |
– |
– |
ТНТО I’ |
42 |
34 |
Al , 19 |
Смола D2, 5 |
6670 |
1,76 |
25-51 |
>200** |
– |
– |
ТНТО II’ |
42 |
32 |
Al, 19 |
Смола D2 / 7 |
6840 |
1,74 |
32-35 |
>200** |
53 |
0,040 |
AFX-644’ |
40 |
30 |
Al , 20 |
Смола D2/10 |
6960 |
1,70 |
41-43 |
>200** |
60,8 |
0,040 |
AFX-645’ |
48 |
32 |
Al , 12 |
Ganex / 8 |
– |
– |
– |
– |
– |
– |
GD-1’ |
65 |
35 |
– |
– |
7510 |
1,75 |
– |
– |
– |
– |
GD-2’ |
35 |
35 |
Октоген, 30 |
– |
7870 |
1,76 |
– |
– |
– |
– |
ЮАР – 1 |
40 |
60 |
– |
– |
7280 |
– |
– |
276*** |
– |
0,17 |
ЮАР – 2 |
25 |
50 |
Гексоген, 25 |
– |
7450 |
– |
– |
186*** |
– |
0,17 |
ARX-4002’’ |
50 |
50 |
– |
– |
7370 |
1,71 |
22<d<25 |
225*** |
192 |
>4,5; >4,5(НТО) |
Композиция В |
– |
39,5 |
Гексоген, 59,5 |
Wax / 1 |
7890 |
1,72 |
– |
130*** |
112 |
0,45 (гексоген) |
*озокеритовая смола 85%, нитроцеллюлоза 14%, лецитин 1%,
**- груз 5 кг, 50% взрывов;
*** Rotter Impact, принимается для гексогена -100 ‘ США, ‘’ Австралия
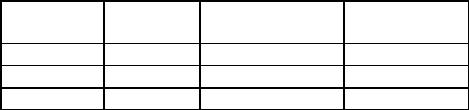
основе ТНТ и облегчает задачу расснаряжения боеприпасов на основе этого состава.
Литьевой состав AFX-645 разработан в США для снаряжения авиабомб [147]. Составы на основе модифицированного гексанитростильбеном тротила и НТО используются в ЮАР для снаряжения артиллерийских боеприпасов [148]. Литьевой состав ARX-4002 предложено применять в различных боеприпасах в Австралии [149]. Предельное содержание НТО в литьевых ВС на основе тротила существенно зависит от формы и размера кристаллов НТО. Обычно получаемый в производстве крупнокристаллический НТО склонен к седиментации и его содержание в составах не должно превышать 50%.
В Польше [150] было проведено сравнение свойств литьевых составов (в мас. %): ТНТ–гексоген–НТО = 30–20–50 (С50) и 30–40–30 (С30) с широко используемой за рубежом «композицией В» (36% ТНТ и 64% гексогена) и составом СВ (40%ТНТ, 60% гексогена). Результаты представлены в табл. 3.9.
Таблица 3.9
Сравнение литьевых составов на основе НТО с составами ТНТ–гексоген
Взрывчатый |
Плотность, |
Скорость |
Теплота взрыва, |
состав |
ρ, кг/м3 |
детонации, D*, м/с |
Q, кДж/кг |
СВ |
1674 |
7830 |
5126 |
С30 |
1717 |
7850 |
4911 |
С50 |
1738 |
7730 |
4700 |
*определена методом аквариума
При исследовании чувствительности к удару на копре с грузом 5 кг было показано, что минимальная высота, при которой при 10 определениях
84
было 10 взрывов, составила для составов СВ, С30 и С50 соответственно 9, 25 и 30 см.
Менее распространены прессуемые составы на основе НТО. В ЮАР в зарядах использовали смеси, содержащие 18,9–69,6% гексогена, 25,8–76,3% НТО и 4,6–5% сополимера этилена и винилацетата. Испытания показали, что эти материалы являются малочувствительными ВС и могут использоваться в промежуточных детонаторах и других изделиях [151].
ВС на основе НТО и полимерного связующего (РВХ–составы) наиболее подробно изучены во Франции (SNPE). Одновременно исследования проводили в США, Англии, Германии и ряде других стран. Некоторые данные из этих работ представлены в табл. 3.10.
Во Франции уже около 20 лет ведутся работы по частичной или полной замене октогена и гексогена в мощных ВС, содержащих 80–93% циклических нитраминов и связующее, на НТО или ТАТНБ [152]. К 1989 г был разработан состав В 2214 (72% НТО, 12% октогена, 16% полибутадиенового каучука) для снаряжения авиабомб и других боеприпасов крупного калибра, и состав В 3017 (74% НТО, 26% активного связующего) – для изделий малого калибра. Последний значительно превосходит по безопасности состав ORA86 (86% октогена и 14% полиуретанового связующего), лишь немного уступая ему по мощности. Замена 55% октогена на НТО (в ВС, содержащем 7% связующего и 92,5% октогена) приводит к снижению скорости детонации ВС с 8700 до 8350 м/ с, но чувствительность к удару снижается от 3,6 до 8,6 Дж.
На основе НТО, выпускаемого в США фирмой «Olin», создан ряд составов широкого использования [153]. К числу наиболее известных относятся PBXW-124 [154] и PBXW-122 [19]. В Индии применяют смесь 60% НТО и 40% ТНТ.
85
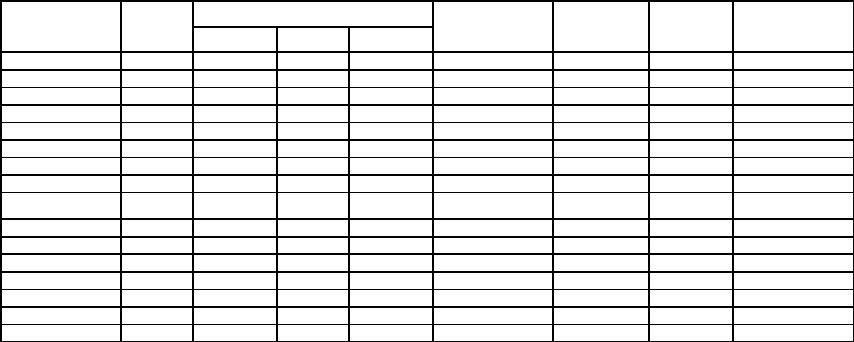
Таблица 3.10
Состав и взрывчатые свойства некоторых литьевых ВС на основе НТО с полимерным связующим
Состав |
НТО,% |
|
Добавка, % |
|
Связующее, % |
D, м/с |
Ρ, г/см3 |
Dкр, мм |
|
|
октоген |
Al |
NH4ClO4 |
|
|
|
|
B 22141 |
72 |
12 |
– |
– |
HTPB, 16 |
7495 |
1,63 |
35(в оболочке) |
B 22331 |
31 |
6 |
10 |
28 |
HTPB, 16 |
– |
– |
– |
B 22481 |
46 |
42 |
– |
– |
HTPB, 16 |
8130 |
1,70 |
11 |
B 30171 |
74 |
– |
– |
– |
ЭС |
7780 |
1,75 |
10-15 |
B 30211 |
50 |
25* |
– |
– |
ЭС |
8100 |
1,77 |
<10 |
PBX -1222 |
47 |
5* |
15 |
20 |
HTPB, 13 |
– |
– |
175 |
PBX -1242 |
27 |
20* |
20 |
20 |
HTPB, 13 |
– |
– |
75-100 |
PBX -1262 |
22 |
20* |
26 |
20 |
Полиуретан, 12 |
6470 |
1,80 |
– |
CPX-4123 |
50 |
30 |
– |
– |
ПНММО, 10*** |
7200 |
1,66 |
– |
CPX-4133 |
45 |
35 |
– |
– |
ПНММО, 10*** |
8150 |
1,74 |
10 |
CPX-4583 |
30 |
30 |
20 |
– |
ПНММО, 10*** |
7680 |
1,85 |
– |
CPX-4603 |
27,5 |
27,5 |
25 |
– |
ПНММО, 10*** |
6420 |
1,88 |
– |
GD-3 |
72 |
12 |
– |
– |
HTPB, 16 |
6840 |
– |
– |
GD-5 |
40 |
43 |
– |
– |
ППГл, 7 |
8030 |
– |
– |
HX |
25 |
47 |
10** |
- |
НТРВ, 18 |
7750 |
1,57 |
– |
CHN-037 |
76 |
– |
– |
- |
ПГА, 24 |
|
|
|
*гексоген, ** - нитрогуанидин, *** - дополнительно 10% смеси динитроэтилбензола и тринитроэтилбензола = 65:35; 1во Франции, 2 в США, 3 в Великобритании;
HTPB – гидратированный полибутадиен, ЭС – энергосодержащий, ППГл – полипропиленгликоль, ПГА – полиглицедилазид, ПНММО – поли-3-нитрометил-3-метилокситан
НТО применяется в энергоемких композициях с различными полимерами (PBX), такими как полиуретан (ПУ), полистирол (ПС), поливинилбутираль (ПВБ), акрилонитрил-стирольный сополимер (AНС), фторкаучуки (ФК246G, ФК2311) в массовом соотношении НТО/полимер = 95/5 [155]. Интенсивность водородной связи снижается в следующем порядке:
NTO/ПУ>NTO/ФК246G>NTO/ФК2311>NTO/ПВБ>NTO/AНС>NTO/ПС.
В последние годы НТО находит широкое применение в качестве компонента газогенерирующих составов для подушек безопасности в автотранспорте и других аналогичных целей [156 –158].
Недавно было обнаружено сильное влияние НТО на фазовые переходы в аммиачной селитре, что может быть использовано при разработке взрывчатых и топливных составов на основе этих соединений [159].
Самостоятельный интерес как ВВ представляют соли НТО. В частности, в последние годы большое внимание уделяется исследованию гидроксиламиновой соли НТО, которая является МЧВВ и предложена для использования в боеприпасах и газогенерирующих составах [160,161]. Металлические соли НТО предложено использовать в качестве регуляторов скорости горения для двухосновных твердых ракетных топлив, содержащих перхлорат аммония и горючее–связующее [162]. Наиболее эффективной оказалась соль железа, которая увеличивает скорость горения при низком значении η [163].
Cинтезированы и исследованы молекулярные структуры и термодинамические характеристики ряда комплексов - солей НТО с металлами [164–174], в том числе Zn(NTO)2 и Co(NTO)2 [171].
87
4. 1,1-ДИАМИНО-2,2-ДИНИТРОЭТИЛЕН
1,1-Диамино-2,2-динитроэтилен (ДАДНЭ, FOX-7, DADNE) был впервые синтезирован в СССР, в ЛТИ им. Ленсовета в 1989 г. [175]. В 1998 г. о его получении сообщило Шведское агентство безопасности (FOI) [176]. В честь последнего это соединение было названо FOX-7. ДАДНЭ – одно из немногих ВВ, для которых в конце ХХ - начале ХХI века были проведены обширные испытания в различных странах. В ходе этих испытаний были определены многие физико-химические и специальные характеристики [177], которые представлены в настоящем пособии. Было установлено, что FOX-7 – малочувствительное к удару мощное взрывчатое вещество с работоспособностью, сопоставимой с гексогеном [178]. Опытное производство его налажено шведской компанией NEXPLO Bofors [179].
4.1 Строение, физические и химические свойства
ДАДНЭ – соединение с поляризованной этиленовой связью, содержащее донорные и акцепторные группы в одной молекуле. Длина этой связи 1.45 Å является промежуточной между одинарной (1.54 Å) и двойной связями (1.34 Å). Одновременно порядок этиленовой связи уменьшается от 2 до ~1.5.
Строение
ДАДНЭ – полиморфное соединение. Четыре его модификации упомянуты в работе [180]. Однако повторные исследования, проведенные совместно «FOI» (Tumba, Швеция ) и «Fraunhofer ICT» (Германия) методами термического анализа – ДСК, TГА, TMA и рентгеновской дифрактоскопии c измерениями при различных постоянных температурах, показали, что в интервале от –70 до 4000С обнаруживаются только 3 модификации: α-, β- и γ-. Переход α-формы в β-форму при нагревании происходит при 1130С (ранее сообщалось о 78–800С) и сопровождается
88
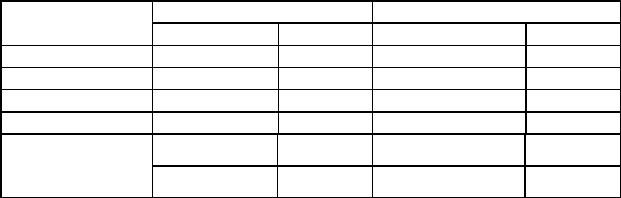
увеличением объема на 1,9% и полностью обратим, хотя образование α-формы при охлаждении происходит при более низкой температуре, чем при нагревании.
При нагревании выше 1600С наблюдается второй модификационный переход: из β- в γ-форму. При первом нагревании до этой температуры пик в ДСK расщеплен, но при циклическом изменении температуры расщепление исчезает. Предполагается, что расщепление пика обусловлено наличием следов растворителя или воды, которые удаляются во время первого цикла. Отмечается, что при последующем охлаждении образование β-формы не наблюдается. Переход γ- в α-форму происходит при низкой температуре (50 – 750С), при этом в продукте сохраняется небольшое количество γ-формы даже при температуре минус 700С. В работе [181] приведены значения теплот модификационных переходов, которые составляют 25 кДж/мол для первого и 20 кДж/моль для второго переходов.
Основные параметры кристаллической решетки α- и β-форм ДАДНЭ представлены в табл. 4.1.
Таблица 4.1
Основные параметры кристаллической решетки ДАДНЭ и коэффициенты линейного расширения (К) по осям
Параметр |
α-форма |
β-форма |
|
|
|
200С, нм |
К, 106/0С |
1300С, нм |
К, 106/0С |
А |
0,6939 |
43,4 |
0,6978 |
8,7 |
B |
0,6631 |
124,9 |
0,6638 |
147,4 |
C |
1,1349 |
26,6 |
1,1660 |
39,5 |
Объем |
0,5222нм3 |
– |
0,5401нм3 |
– |
Кристаллическая |
Моноклинная |
– |
орторомбическая |
– |
группа |
Р2/n |
– |
Р212121 |
– |
89
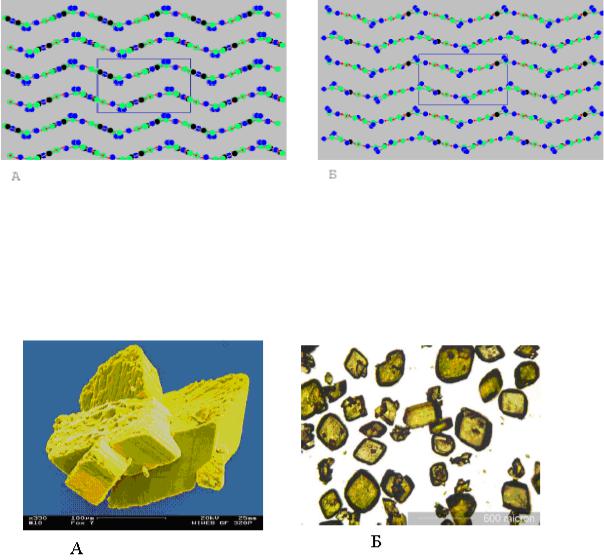
Там же представлены параметры линейного расширения кристаллов α- и β-форм ДАДНЭ по трем кристаллическим осям и удельный объем молекул.
В работе [180] для перехода β- в γ-форму указывается температура 1730С. Кристаллографические параметры для γ-формы в литературе не приведены. Пространственная структура кристаллов этих форм представлена на рис. 4.1.
Рис. 4.1. Проекция структуры α- (А) и β-формы (Б) ДАДНЭ Данные, полученные при исследовании частиц ДАДНЭ на
сканирующем электронном микроскопе и под микроскопом, представлены на рис. 4.2.
Рис.4.2. Фотографии частиц ДАДНЭ, снятые методом сканирующей электронной микроскопии (А) и на микроскопе в видимом свете (Б)
90
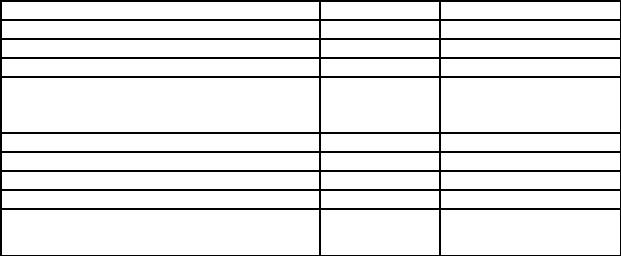
Из фотографий видно, что форма кристаллов не оптимизирована, и возможно дальнейшее снижение чувствительности ДАДНЭ.
Физические свойства ДАДНЭ
ДАДНЭ – желтый кристаллический продукт, по данным [181–183] существует в трех кристаллических модификациях: удлиненные четырехгранные тетраэдрические призмы (из ацетона), шестигранные призмы и кристаллы ромбической формы (из смесей ацетон–вода). Его основные физические и физико-химические характеристики представлены в табл. 4.2, в которой для сравнения приведены данные для образцов, полученных в России и Швеции в различные годы.
Таблица 4.2
Основные характеристики диаминодинитроэтилена [175,176]
Параметры |
ДАДНЭ [175] |
FOX-7 [176] |
I |
II |
III |
Плотность монокристалла, г/см3 |
1,89 |
1,88 |
Размеры кристаллов, мкм |
4 – 10 |
350 – 500 |
Энтальпия образования, ккал/моль |
– 32 |
– 32 |
кДж/моль |
–134 |
–134 |
ккал/кг |
–216 |
–216 |
I |
II |
III |
Температура вспышки, 0С |
279* |
215 |
Теплота взрыва. ккал/кг |
1090 |
1160±15 |
Кислородный баланс |
–11 |
–11 |
Скорость детонации, м/с |
– |
8335 (эксперимент)** |
|
|
8290–8300 [184] |
* с 5-с задержкой; **при плотности 1,76 г/см3
Гравиметрический состав ДАДНЭ может быть проиллюстрирован следующими данными:
Размер частиц, мкм |
<50 |
50– |
100–200 |
200–400 |
400 –800 |
|
|
100 |
|
|
|
Содержание, % |
15,96 |
9,40 |
25,94 |
41,40 |
7,30 |
91
Данные по растворимости ДАДНЭ в различных растворителях представлены в табл. 4.3.
Таблица 4.3
Растворимость ДАДНЭ в различных растворителях
(в 100 мл растворителя при 200С) [185].
Растворитель |
г |
Вода (1000С) |
1,6 |
Ацетон, уксусная кислота, бутанол |
<0,1 |
Этилацетат, нитрометан, вода |
<0,1 |
Ацетонитрил |
< 0,5 |
Циклогексанон |
< 0,5 |
Диметилформамид |
21 |
N-метилпирролидон |
32 |
Диметилсульфоксид |
около 45 |
Показано, что перeкристаллизация из ацетона позволяет повысить плотность монокристалла от 1,877± 0,005 до 1,881± 0,005 г/см3 [185]
Спектральные характеристики ДАДНЭ
В УФ-спектре ДАДНЭ наблюдаются максимумы при 216 нм (С=С- связь, обычно при 165 нм) и при 279 нм, в ИК-спектре – полосы при 3408 и 3330 см-1, относяшиеся к аминогруппе и 1520 и 1472 см-1 – к нитрогруппе [179].
Исследование спектров ЯМР проводили на приборе Bruker DMX 400WB в среде ДМСО–d6 при комнатной температуре (табл. 4.4).
В таблице приведены спектры технического ДАДНЭ и продукта после длительной экспозиции при температуре выше 1600С.
Таблица 4.4
Химсдвиги в ЯМР-спектрах различных форм ДАДНЭ [179]
Продукт |
1Н-химсдвиг, |
13С-химсдвиг, |
15N-химсдвиг, |
|
м.д. |
м.д. |
м.д. |
92

ДАДНЭ |
|
8,55 |
157,9; 129,1 |
–24,0; –276,7 |
|
|
8,64 (СD3Cl) |
158,3, 128,1 |
–24,7; –271,8 |
ДАДНЭ |
после |
8,75 |
158,1; 128,1 |
|
термостатирования |
|
|
90,1±1,2 Hz |
|
ДАДНЭ показал два ожидаемых сигнала в 13C- ЯМР спектре с δ = 157.9 и 129.1м.д., никакого щепления 13C-сигнала не видно. В 15N-ЯМР, азот нитрогруппы проявляется при δ = –24.0 м.д. и азот аминогруппы виден с δ = –276.7 м.д. Протоны NH2 появляются при δ = 8.55 м.д. в ПМР спектре. Для сравнения в табл 4.4. и на рис 4.3 помещен спектр термостатированного FOX-7. Отмечают, что для азота группы NH2 проявляется щепление сигнала в триплет. Это означает, что два протона связаны с азотом.
В масс-спектрах, полученных методом электронного удара (70 и 20 эВ) наблюдается интенсивный пик молекулярного иона, свидетельствующий о высокой стабильности соединения. Пики, связанные с потерей воды (М-18) или NO (М-30), характерные для масс-спектров многих нитросоединений, выражены слабо.
Интенсивная полоса м/е = 86 возможно свидетельствует об отщеплении азотной кислоты, практически отсутствует полоса м/е=46 (нитрогруппа), но имеется интенсивная полоса м/е = 44 (СО2, N2O и др.).
93
|
|
- |
|
|
|
- |
|
400 |
|
-100 |
-600 |
|
A |
|
м.д. |
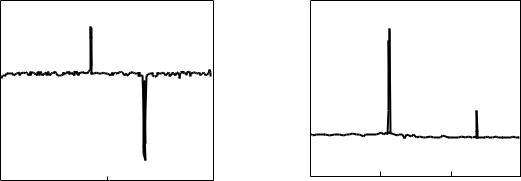
Рис. |
4.3. |
15N-ЯМР спектр |
|
термостатирования (Б) |
|
||
|
|
- |
|
|
|
|
|
- |
|
200 |
|
0 |
-200 |
-400 |
|
Б |
|
м.д. |
|
ДАДНЭ |
(А) |
и |
продукта |
после |
Так как на обычных колонках с обращенной фазой ДАДНЭ часто идет вместе с фронтом, для ВЭЖХ-анализа были выбраны следующие условия определения: колонка Hypersorb 100*3 (Themo Hypersorb), элюенты: 99% воды и 1% трифторуксусной кислоты или 99% ацетонитрила и 1% трифторуксусной кислоты. Cкорость подачи 0,8 мл/ мин [186]. Эти условия обеспечивают успешное проведение анализа.
Химические свойства
Значение рКа для ДАДНЭ составляет 10,6, и при рН 11–13 в водных растворах он существует преимущественно в форме соли. При повышенных температурах в водном растворе КОН ДАДНЭ разлагается с образованием калиевой соли динитрометана с выходом более 75%. В эксперименте, в котором 3 г ДАДНЭ смешали с раствором 5,9 г КОН в 50 мл воды и нагревали 3 ч. при 800С, калиевая соль динитрометана была получена с выходом 87% [179].
При действии на ДАДНЭ раствора гидразина при температуре 20 – 900С происходит замещение одной из аминогрупп и образуется 1-амино-1-
94
гидразо-2,2-динитроэтилен [187]. Аналогично реакция протекает и с рядом алифатических аминов, таких как 3-аминопентан, бензиламин и ряд других. С низшими аминами (1-аминобутан, 2-аминоэтанол и др.) образуется смесь продуктов моно- и дитрансаминирования. При взаимодействии с 1,2-этилендиамином и 1,3-пропилендиамином в среде ДМСО происходит циклизация с образованием пергидропроизводных имидазола и пиримидина. В отсутствие растворителя может происходить замещение не только амино-, но и нитрогрупп. При взаимодействии с гуанидином-основанием образуется только соль [179,188].
При взаимодействии ДАДНЭ c дибромэтаном в сухом ДМФА в присутствии гидрида лития был получен 2-(динитрометилен)- тетрагидроимидазол [176].
4.2. Термическое разложение
При изучении кинетики термического разложения ДАДНЭ было установлено, что разложение со значительными скоростями начинается только при температуре выше 2000С. В ранних работах были получены завышенные по сравнению с другими нитросоединениями энергии активации. Было показано, что энергия активации, измеренная методом ДСК, равна 234 кДж/моль, и обнаружено сильное влияние размера частиц на этот процесс [186].
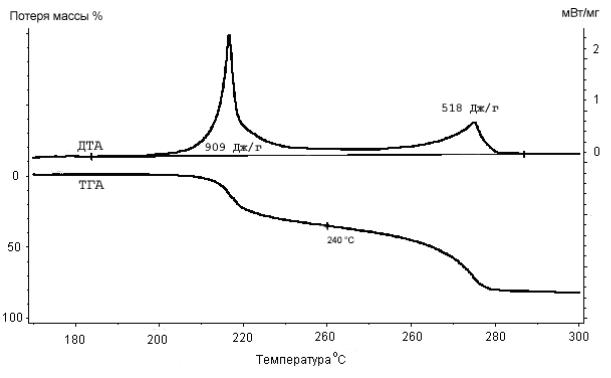
Подробное исследование термического разложения ДАДНЭ методами ДТА – TГA было проведено в Германии [184], типичные кривые представлены на рис.4.4. При нагревании со скоростью 5К/мин разложение становится заметным около 210°C и заканчивается взрывом. При скорости нагрева 1 K/мин наблюдается два экзотермических этапа: на первом, в области около 2200С, выделяется больше тепла, но наблюдается меньшая потеря массы (38 %), чем на втором, в районе 2700С (потеря массы - 45%). Наличие двух пиков отмечается и в ряде других работ [181],
95
причем положение первого пика в области 205–2300С определялось скоростью нагревания, степенью очистки образца и рядом других факторов.
Рис. 4.4. Кривые ТГА и ДТА в области разложения ДАДНЭ при скорости нагревания 1 К/мин
Для определения кинетических характеристик процесса были проведены изотермические опыты при 185 – 2000С. Механизм разложения предложено описывать как сумму двух параллельных процессов А --- B и C---- D, где А и С – различные формы ДАДНЭ. Для описания этих реакций предложены уравнения:
для первой –dα/dt = k (1-α)n · ( 1-α *a), для второй –dα/dt = k (1-α)n.
В этих уравнениях α – степень превращения, измеряемая как потеря массы (или выделение тепла) в данный момент, отнесенная к общей потере массы (или выделению тепла) на стадии. Данные, характеризующие процесс, представлены в табл. 4.5
96
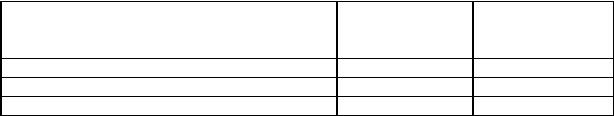
Таблица 4.5
Основные кинетические параметры двух реакций разложения ДАДНЭ
Параметр |
1-я реакция |
2-я реакция |
Предэкспонент |
1,015 · 1023 |
2,305 · 1026 |
Энергия активации, кДж/моль* |
250,1 |
304,5 |
Порядок реакции |
2.853 |
0,462 |
Степень превращения на стадии, % |
41,2 |
42,1 |
Тепловыделение, Дж/г |
909 |
518 |
* В работе [190] приводится энергия активации равная 243 кДж/мол.
При стандартной пробе на стабильность после 48 ч. при 1000С объем выделившихся газов менее 0,1 мл/г. Температура вспышки 215 – 2230С.
Исследования, проведенные в РХТУ им. Д.И.Менделеева, по изучению горения и термического разложения ДАДНЭ в изотермических условиях [191] привели авторов к заключению, что в этих процессах большую роль может играть превращение основной формы соединения в аци-форму с последующим разложением последней с отщеплением азотной кислоты. Параллельное протекание процессов изомеризации и разложения, по мнению авторов, может являться одной из причин завышенного значения энергии активации при распаде ДАДНЭ.
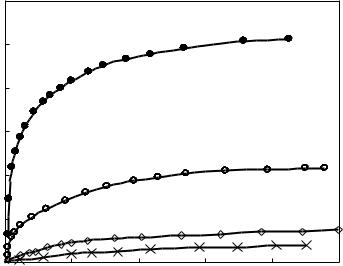
В ходе этих исследований была обнаружена еще одна особенность этого процесса. Как видно из рис. 4.5, кривые накопления газообразных продуктов имеют насыщающийся характер, т.е. чем ниже температура, тем меньшая доля исходного соединения разлагается в процессе. При этом было установлено, что твердый остаток после завершения экспериментов по данным физико-химических методов анализа идентичен исходному ДАДНЭ.
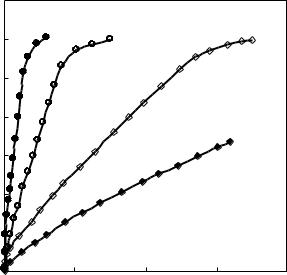
Для предварительно термостатированных образцов изменяется и характер газовыделения (рис. 4.6). Энергия активации близка к указанной выше 232–241 кДж/моль.
97
|
120 |
|
|
|
2070С |
|
|
|
100 |
|
|
|
|
||
|
|
|
|
|
|
|
|
мл/ |
80 |
|
|
|
|
|
|
газов, |
|
|
|
|
|
|
|
60 |
|
|
|
202 |
0С |
|
|
Обьем |
|
|
|
|
|
||
40 |
|
|
|
|
0С |
|
|
|
|
|
|
192 |
|
||
|
20 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
0 |
|
|
|
1870С |
|
|
|
|
|
|
|
|
|
|
|
0 |
50 |
100 |
150 |
200 |
250 |
|
|
|
|
Время,мин |
|
|
|
|
Рис. 4.5. Влияние температуры на объем выделившихся газов при термическом разложении ДАДНЭ (m/V ≈0,001 г/см3)
При повторном нагревании образцов, выдержанных при 210 – 2200С, на кривых ДСК первый экзотермический пик исчезает и разложение начинается вблизи 2700С. Следует отметить, что если термостатированный образец перекристаллизовать из ацетонитрила, он снова ведет себя как нетермостатированный. Для объяснения этого феномена (исходный, перекристаллизованный и термостатированный ДАДНЭ имеют одинаковые рентгеновские-, ИК- и ЯМР-спектры) авторы работы [184] допускают, что технический продукт содержит аморфную и
кристаллическую формы и при низкой температуре |
(210–2300С) |
происходит разложение аморфной формы. |
|
Аналогичные результаты получены и в работе [181]. Степень разложения после термостатирования при 210–2150С в течение 1 ч составила около 35%. Полученный продукт при ДСК разлагается выше 2700С. Авторы предполагают, что при термостатировании происходит образование неизвестного соединения из двух молекул ДАДНЭ, так как
98
при нагревании образца от 20 до 4000С эндотермические пики не |
|||||
зафиксированы. |
|
|
|
|
|
|
700 |
2600С |
|
|
|
|
|
2500С |
|
2400С |
|
|
600 |
|
|
||
|
|
|
|
|
|
мл/г |
500 |
|
|
|
|
|
|
|
|
|
|
газов, |
400 |
|
|
|
0 |
|
|
|
|
232 С |
|
300 |
|
|
|
|
|
Обьем |
|
|
|
|
|
200 |
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
0 |
|
|
|
|
|
0 |
200 |
400 |
600 |
800 |
|
|
|
Время,мин. |
|
|
Рис. 4.6. Влияние температуры на разложение термически обработанного |
|||||
ДАДНЭ: |
|
|
|
|
|
m/V=0,0005 г/см3 |
|
|
|
|
|
В 2004 г. в Швеции было проведено подробное исследование влияния качества перекристаллизованного технического FOX-7 на его термические свойства [192]. Перекристаллизацию проводили из ацетонитрила, γ-бутиролактон (БЛ), водных смесей NМП (50 : 50 по объему) и ДМФА (75:25 по объему) (табл. 4.7). Максимальная температура растворения во всех системах, кроме ацетонитрила, составляла 950С, в последнем – 700С, скорость охлаждения 0,2 – 0,020С в минуту. Кроме того, кристаллы, полученные из БЛ, были перенесены в насыщенный раствор и оставлены на длительное время, что позволило получить крупные кристаллы. Кристаллы из ацетонитрилa, NМП и мелкие кристаллы из БЛ имели двухмерную ромбическую форму, крупные кристаллы трехмерную
99
ромбическую форму, а из ДМФА – форму параллелепипеда. Крупные кристаллы из БЛ и из ДМФА имели более гладкую поверхность.
Таблица 4.7
Зависимость размеров кристаллов от природы растворителя [192]
Растворитель |
Размер частиц, мкм |
N-метилпирролидон/вода |
250 – 400 |
γ -Бутиролактон |
(после <500 |
дополнительной обработки) |
50 – 185 |
γ -Бутиролактон |
|
Диметилформамид/вода |
50 – 110 |
Ацетонитрил |
<50 |
Природа растворителя оказывает заметное влияние на поведение ДАДНЭ при термическом воздействии. При изучении термического разложения образцов методом ДСК для всех очищенных продуктов наблюдали эндотермический пик в области 115–1200С, который идентифицировали как первый модификационный переход, и вблизи 1600С (кроме продукта из ацетонитрила) – как второй модификационный переход. В области выше 2200С наблюдали два экзотермических пика, в ходе которых в газообразные продукты превращается более 80% исходного материала.
В циклических опытах в интервале температур 3–1950С положение эндотермического пика при нагревании сохраняет свое значение (115– 1200), но температура экзотермического пика при охлаждении на 15–200 ниже. Эндотермический пик при 1600 при нагревании сохраняется, но соответствующий ему экзотермический пик при охлаждении не наблюдается (сравнить с. 89).
4.3. Взрывчатые свойства
100
Приведенные данные по термическому разложению ДАДНЭ демонстрируют высокую термическую стабильность этого соединения практически при всех ситуациях при хранении и использовании боеприпасов. Одновременно большое внимание было уделено исследованию поведения ДАДНЭ при различных механических и ударноволновых воздействиях.
Чувствительность ДАДНЭ к удару и трению определяли с использованием BAM-test [178].
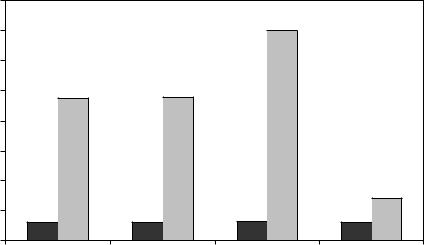
Чувствительность к удару. Данные по энергии, вызывающей взрыв FOX 7, при использования этого метода, представлены на рис. 4.7 в сравнении с другими ВВ.
Энергия,Дж
40
35
30
25
20
15
10
5
0
ДАДНЭ |
Тетрил |
ТНТ |
Гексоген |
Рис. 4.7. Энергия, необходимая для инициирования заряда ДАДНЭ при ударе
На рисунке для каждого продукта слева показана энергия, необходимая для 5% взрывов, справа – для 50% взрывов; для ДАДНЭ эти цифры соответственно равны 3,1 и 23,8 Дж. При падении 5 кг груза энергия при 50% взрывов равна 17,3 Дж [193], у oктогена в тех же условиях – 9,6 Дж. Чувствительность к удару на копре с 2 кг грузом
101
(ВАМ) перекристаллизованного продукта составляет 126–159 см, у гексогена в тех же условиях – 38 см [194]. Из приведенных данных следует, что чувствительность к удару ДАДНЭ лежит в пределах диапазона чувствительности штатных взрывчатых веществ.
Чувствительность к трению. По сравнению с тротилом и тетрилом, которые при этом испытании не чувствительны, ДАДНЭ более опасен. Испытания при максимальном прижатии 360 Н дали 5 взрывов из 6 испытаний. Тем не менее, некоторые исследователи [176] считают его малочувствительным к трению. Для перекристаллизованного из смеси вода-NМП продукта не наблюдали взрывов при 353 Н [193]. Большое влияние очистки на чувствительность ДАДНЭ подтверждается следующими данными: взрыв происходит у неперекристаллизованного образца при прижатии 168–288 Н, у гексогена – при 120 Н, у очищенного ДАДНЭ – выше 350 Н.
Работоспособность определяли методом метания алюминиевой пластины, используя прессованные цилиндрические заряды из чистого ВВ (без флегматизатора) длиной 20 мм, диаметром 21 мм и плотностью 1,7 г/см³ [178]. Пять таких цилиндров собирали в колонку, которую инициировали 10 г гексогена, флегматизировнного воском (95/5). В торце колонки был установлен алюминиевый диск. В эксперименте была измерена скорость свободной поверхности диска при воздействии ударной волны, вошедшей в алюминий при детонации заряда, по двум скоростным меткам. Кроме скорости свободной поверхности диска определяли также скорость детонации заряда. Для измерения последней использовали простые прессованные образцы.
Данные по скорости метания алюминиевого диска, скорости детонации и давлению в детонационной волне представлены в табл. 4.8.
Таблица 4.8
102
Взрывчатые характеристики ДАДНЭ
Параметр |
ДАДНЭ |
ТНТ |
Гексоген |
Октоген |
Скорость детонации, км/с |
8,0 |
6,8 |
8,3 |
8,3 |
Скорость метаемой |
1,3 |
0,94 |
1,3 |
1,4 |
пластины, км/с |
|
|
|
|
Давление в ударной волне, |
26 |
17 |
26 |
28 |
ГПа |
|
|
|
|
В опытах использовали смеси гексогена с воском (95/5) и октогена с воском (97/3) с размером частиц и плотностью такой же, как у ДАДНЭ.
Определение взрывчатых характеристик ряда МЧВВ в идентичных условиях было проведено в работе [179]. Полученные данные приведены в табл. 4.9.
Таблица 4.9
Сравнение рабочих характеристик ряда МЧВВ
Свойство |
ДАДНЭ |
Гексоген |
ТЕХ |
ТАТНБ |
Скорость детонации , м/с* |
9090 |
8800 |
8750 |
8110 |
Давление детонации, ГПа* |
36,6 |
34,7 |
36,5 |
31,1 |
Чувствительность к удару, см (груз 2 |
126 |
38 |
177 |
170 |
кг, 50% взрывов) |
|
|
|
|
Чувствительность к трению (сила |
>36 |
12 |
>36 |
>36 |
прижатия), кг (отсутствие взрыва или |
|
|
|
|
загорания в 5 измерениях) |
|
|
|
|
∙ Расчет по Cheetah v 2.0 |
|
|
|
|
Можно сделать вывод, что в ряду рассмотренных в табл. 4.9 веществ ДАДНЭ по совокупности свойств превосходит остальные.
4.4. Синтез и получение
Известны два принципиально отличающихся подхода к синтезу
ДАДНЭ.
Oдин основан на замещении иода в дииододинитроэтилене на аминогруппы. Эта реакция была осуществлена в 1992 г Баумом с сотрудниками в Швеции для ряда аминов, но не аммиака.
Другой, впервые осуществленный в СССР и затем опубликованный в Швеции в 1998 г. [176], – нитрование гетероциклических соединений,
103
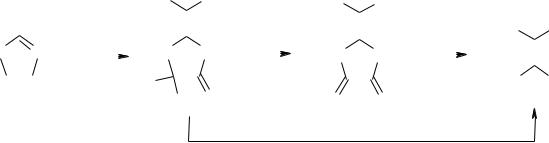
содержащих в цикле фрагмент – NH-CR2-N- до гемдинитросоединений с последующим раскрытием цикла. В качестве исходных соединений в этом методе используют 2-метилимидазол, 2-метилимидазолон, 2-метил-4,6- пиримидиндион (МПД) и ряд других соединений.
Химизм процесса может быть представлен следующей схемой:
|
|
|
|
|
|
|
O2N |
|
|
|
NO2 |
|
|
O N |
|
|
|
|
NO |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
O2N |
NO2 |
|||||
|
|
|
|
HNO |
3 |
|
|
|
|
|
|
-N O |
3 |
|
|
|
|
|
H2O/NH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
HN N |
|
HN |
|
|
|
NH |
2 |
HN |
|
|
|
|
NH |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
O2N |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
H2N |
NH2 |
|
|
|
|
|
|
|
|
NO |
|
|
O |
|
|
|
|
O |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
H2O/NH3 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Как видно из представленной схемы, промежуточным продуктом синтеза является дикетон, разрушение которого приводит к целевому продукту. Наиболее часто используемым нитрующим реагентом в процессе являются серно-азотные кислотные смеси.
Ниже приводятся основные методы синтеза ДАДНЭ.
Синтез ДАДНЭ из ацетамидина через 2-метокси-2-метил-4,5- имидазолидиндион (ММИД) [195]
Первый вариант синтеза Стадия 1. В 2 л колбу помещают 860 мл метанола и 232 мл 30%
раствора метилата натрия в метаноле. 36,48 г (0,38 моль) гидрохлорида ацетамида добавляют при комнатной температуре к перемешиваемому раствору. Диэтилоксалат (55,88 г, 0,38 моль) в метаноле (400 мл) добавляют к смеси в течение 3 ч с последующим перемешиванием еще в течение 1 ч; рН реакции поддерживают около 4 добавлением концентрированной НСl при температуре ниже 300С. Нерастворимые соли удаляют фильтрованием, а фильтрат упаривают досуха при температуре не выше 300С, до образования белого осадка. Последний смешивают с 320 мл кипящего метанола, чтобы удалить остаток солей при горячем
104
фильтровании и частично отгоняют метанол. После охлаждения в течение ночи в холодильнике получают 35,5 г (64%) кристаллического ММИД.
Стадия 2. В колбу помещают 198 мл концентрированной H2SO4, охлаждают ee на ледяной бане и медленно добавляют 35,4 г ММИД. Получают прозрачный желтый раствор, к которому добавляют по каплям
втечение 1 ч при температуре не выше 300С 43 мл 70% HNO3. В конце слива образуется светло-оранжевая суспензия, которую перемешивают еще 30 мин 2,2-динитрометилен-4,5-имидазолидиндион (ДНМИД) – сырец отфильтровывают, высушивают на воздухе (выход 63%) и переносят
вколбу со 120 мл воды.
Стадия 3. К водной суспензии ДНМИД приливают по каплям 30% раствор аммиака при 20 – 300С до достижения рН 9. Суспензию перемешивают при комнатной температуре еще 2 ч, затем осадок отфильтровывают и 4 раза промывают водой. После воздушной и вакуумной сушки получают желтый кристаллический осадок ДАДНЭ. Выход 19,66 г (54,1%).
Суммарный выход по ацетамидину составил 35%.
Позднее 2 и 3 стадия этого процесса были описаны для укрупненных опытов.
Второй вариант синтеза
Отличается использованием свежеприготовленного метилата натрия. Стадия 1. Металлический натрий (7,7 г, 0,34 моль) растворяют в 300 мл метанола и к раствору добавляют 9,6 г (0,1 моль) гидрохлорида
ацетамида. Раствор перемешивают 15 мин, после чего к нему в течение 3 ч добавляют раствор 15,1 г (0,103 моль) диэтилоксалата в 100 мл метанола. Реакционную смесь обрабатывают газообразным НСl до рН 5. Отфильтровывают выпавший осадок NaCl и фильтрат упаривают при 30– 350С до объема 70–80 мл. Из концентрата выпадает белый осадок,
105
содержащий примесь NaCl. Его экстрагируют ацетоном в приборе Сокслета и после перекристаллизации из метанола получают 9,6 г ММИД (выход 64%).
Стадия 2. ММИД (1,4 г) растворяют при 15 – 200С в 9 мл H2SO4 (ρ = 1,84 г/см3) и приливают к нему по каплям в течение 5 мин 1,5 мл концентрированной HNO3 при температуре не выше 300С. Через 10 мин образуется осадок ДНМИД, который отфильтровывают, промывают 3 раза трифторуксусной кислотой (по 5 мл) и сушат в вакууме при комнатной температуре. Выход продукта – 63% от теоретически возможного.
Стадия 3. Проводится так же, как в предыдущем примере. Выход по ацетамидину около 30% [196].
Синтез ДАДНЭ из 2-метилимидазола [176]
В 40 мл концентрированной H2SO4 при 15–200С растворяют 4,1 г (0,05 моль) мелко измельченного 2-метилимидазола. При интенсивном перемешивании и той же температуре в течение получаса к раствору добавляют 8 мл концентрированной HNO3 (ρ =1,52 г/см3). Темный вначале раствор постепенно светлеет до розового. Через 3 ч выпадает белый осадок, который несколько раз промывают трифторуксусной кислотой и высушивают в вакууме при 00 С. Получают с выходом 15% (1,7 г) белый кристаллический ДНМИД.
1,2 г ДНМИД растворяют в 5 мл воды и добавляют 2 мл 25% аммиака для достижения рН 8–9. Через несколько секунд после исчезновения белого продукта выпадают желтые кристаллы ДАДНЭ – сырца, которые промывают водой и сушат при 500С. Получают 0,8 г ДАДНЭ (выход при гидролизе выше 87%, суммарный выход на 2-метилимидазол около 13%).
Синтез ДАДНЭ из 2-метил-4(3Н)-имидазолона [196]
106
2-Mетил-4(3H)-имидазолон добавляют порциями к смеси 2 мл 100% HNO3 и 9 мл 90% H2SO4 при 0 – 50С. Полученный прозрачный раствор медленно в течение часа нагревают до 150С и выдерживают при этой температуре еще 1 ч. Реакционную смесь разбавляют 6 мл трифтор– уксусной кислоты, охлаждают до 50С, осадок отфильтровывают, промывают его трифторуксусной кислотой, сушат и получают с выходом 27% ДHМИД. Дальнейшая обработка по предыдущей прописи.
Синтез ДАДНЭ из 2-метил-4,6-пиримидиндиона [196]
Вариант 1. Растворяют 5,1 г МПД в 40 мл концентрированной H2SO4 при 15–200С, при той же температуре в течение получаса прибавляют 8 мл азотной кислоты (ρ =1,52 г/см3). Через 3 ч реакционную смесь выливают в воду, отфильтровывают блестящие желтые кристаллы, промывают их водой, высушивают при 500С и получают 2,6 г ДАДНЭ (выход 35%).
Вариант 2. [197]. К 38 мл концентрированной Н2SO4 при интенсивном перемешивании и 15–200С порциями прибавляют 12,6 г (0,07 моль) МПД, охлаждают до 5–100С и при этой температуре добавляют 85 г 98% HNO3. Через 1 ч реакционную смесь охлаждают до 0–50С и выливают в 700 мл воды. Через 12 ч выпавший осадок отфильтровывают и перекристаллизовывают из ДМФА. Выход ДАДНЭ 8,1 г (75%), т. пл. 2200 (с разложением).
В работе [186] описана пилотная установка для получения ДАДНЭ, имеющая производительность 7 кг продукта сырца за одну операцию (в день может быть проведено 2 операции). Процесс включает две стадии.
Стадия 1. В аппарате вместимостью 600 л, снабженном рубашкой, змеевиком для охлаждения и нагревания и выносным холодильником для конденсации паров, за одну операцию получают 15 кг МПД. Тот же реактор используют для приготовления раствора МПД в серной кислоте.
107
Стадия 2. Нитрование проводят в 50–литровом реакторе с рубашкой и змеевиком, в которые подается хладагент, способный поддерживать температуру 00С. К раствору МПД в серной кислоте при температуре близкой к 250С начинают дозировку азотной кислоты. Время слива 30 мин, общее время нитрования 2 ч. При повышении температуры в реакторе до 350С дозировка азотной кислоты автоматически прекращается. Выпадение промежуточного продукта начинается после приливания половины HNO3. После завершения выдержки содержимое нитратора выливают при перемешивании в расположенный под ним реактор вместимостью 500 л с водой. Происходит образование ДАДНЭ и СО2. Осадок отфильтровывают, промывают и сушат. Получают порошок со средним размером частиц 25 мкм. Выход на стадии 80%.
Процесс самопроизвольного разложения реакционной смеси начинается при температуре ниже 1000С, суммарный тепловой эффект реакции позволяет повысить ее температуру на 1200С, что может привести к выбросу. Поэтому осуществляется жесткий контроль за температурой и содержанием азотной кислоты в реакторе.
Большое внимание уделялось вопросам перекристаллизации ДАДНЭ для получения продукта высокой плотности и требуемой кристаллической формы. Кроме отмеченных выше работ [192, 195] этой теме посвящен цикл исследований, выполненных в Польше [193,198,199]. Для получения кристаллов с размером 100–300 мкм первоначально стабилизировали «сырой» технический ДАДНЭ, синтезированный нитрованием 2-метил-4,6-пиримидиндиона, кипячением в течение 8 ч. в 0,1% растворе бикарбоната натрия. Затем его перекристаллизовывали из воды или смесей вода – NМР. Гладкие хорошо сформированные частицы образуются в системе вода : NМП = 75:25 при медленном охлаждении (0,30С в минуту) и длительной выдержке (6 –12 ч) при перемешивании и
108
температуре 25 или 600С. Основная часть кристаллов (по массе) имеет размер 220–450 мкм.
4. 5. Применение
Перспективы применения ДАДНЭ, в первую очередь, связаны с его меньшей чувствительностью к механическим воздействиям по сравнению с гексогеном и октогеном при близкой мощности. Необходимо при этом отметить, что продукт плохо прессуется, и следует ожидать, что он будет преимущественно использоваться в смесях с флегматизатором или полимерным связующим.
Подробное исследование одного из таких составов было проведено в работе [175]. Скорость детонации составила 8400 м/с, критическая толщина детонирующего слоя 0,65 мм, метательная способность при плотности 1,86 г/см3 характеризуется скоростью метания стальной пластины – 2265 м/с и несколько ниже, чем у гексогена. При определении ударно-волновой чувствительности методом Gap-test с преградой из оргстекла детонация наблюдалась при толщине преграды 8 мм и отказ при толщине 16 мм; пороговое давление инициирования в ударной волне около 5,5 ГПа. В этой работе показано, что по условиям теплового взрыва ДАДНЭ близок к гексогену.
Рассматривается возможность использования ДАДНЭ в порохах и ТРТ. В связи с этим было проведено изучение его совместимости с такими веществами, как САВ (ацетобутират целлюлозы), Estane (термопластичные полиуретаны), GAP (глицидилазидополимеры), HTPB, Viton (фторированные каучуки), HMDI (гексаметилендиизоцианат), Nena (активное связующее на основе нитроксиэтилнитрамина), K-10 (нитроароматический пластификатор, содержащий 65% 2,4-динитро- и 35% тринитроэтилбензола) и другими, которое показало возможность их одновременного применения [186] . Установлено, что использование для
109
сшивания полимеров изоцианатов также не сказывается на стойкости ДАДНЭ.
Расчеты показали, что в твердотопливных композициях, содержащих металлический алюминий, замена гексогена на ДАДНЭ практически не приводит к снижению импульса [179].
Известно, что в 2001 г. цена на ДАДНЭ составляла 3$ за 1 г [195]; хотя в настоящее время стоимость ДАДНЭ снизилась и составляет 0,5$ за 1 г, она существенно превосходит стоимость гексогена и октогена. Однако разработчики рассчитывают, что простота технологии (фактически одна стадия) при крупном производстве позволит значительно снизить цену и приблизить ее к цене циклических нитраминов, несмотря на более дорогое сырье [184] .
5.. ГЕКСАНИТРОСТИЛЬБЕН
Среди соединений, привлекающих в последние десятилетия внимание специалистов, важное место занимает 2,2’,4,4’,6,6’- гексанитростильбен (ГНС, гексанитродифенилэтилен, 1,2-бис(2,4,6- тринитрофенил)этилен, НNS).
NO2 O2N
O2N




 NO2
NO2
NO2 O2N
Первое сообщение о ГНС было опубликовано в 1912 г. Райхом и др. [200]. Однако через 50 лет было показано, что описанное соединение с т. пл. 2110С является 2,2’,4,4’,6,6’-гексанитродибензилом (ГНДБ), а истинный ГНС был получен впервые в «Noval Advance Laboratory» и имел т.пл. 3170С [201]. Совокупность свойств, а именно: высокие термическая стабильность и устойчивость к электрическим и
110

радиационным воздействиям, малый КДД, высокая восприимчивость к детонации при коротком импульсе давления в сочетании с невысокой чувствительностью к удару определили широкую область применения ГНС в различных взрывчатых составах и изделиях. Из-за этих свойств ГНС относят к числу МЧВВ, несмотря на близость его взрывчатых характеристик к тротилу.
5.1. Физические, химические и взрывчатые свойства
Основные характеристики ГНС представлены в табл. 5.1. Так как в литературе используются обозначения ГНС-1 и ГНС-2, относящиеся к продуктам, полученным по различной технологии (см. ниже), в таблице приводятся данные для обоих продуктов.
Чистый ГНС – светло-желтые игольчатые кристаллы (из нитробензола), т.пл. 319–3230С, плотность 1,74 г/см3, практически нерастворим в воде, петролейном эфире, ограничено растворим в большинстве органических растворителей, удовлетворительно в ДМФА и ДМСО. Его растворимость в ДМФА при 1000С равна 6 мас.%
Таблица 5.1
Физические и термодинамические свойства ГНС [202]
Характеристика |
ГНС-1* |
ГНС-2** |
Температура плавления, 0С |
317 |
319 |
Плотность монокристалла, г/см3 |
1,74 |
1,74 |
Насыпная плотность, г/см3 |
0,32–0,45 |
0,45 –1,0 |
Энтальпия образования, Hf, кДж/моль |
68±10 |
– |
ккал/моль |
16,3±2,5 |
|
ккал/кг |
36 |
|
Теплота сгорания, Дж/г |
14425 |
14425 |
кал/г |
3451 |
3451 |
* получен при кристаллизации из ДМФА, игольчатые кристаллы;
**получен при перекристаллизации из HNO3, орторомбические кристаллы [203]
Данные о строении кристаллической решетки ГНС (для сравнения приведены данные для тротила) представлены в табл. 5.2 .
111
|
|
|
|
|
|
|
Таблица 5.2 |
|
Параметры кристаллической решетки ГНС и ТНТ |
||||||
Соединение |
Характеристики единичной ячейки, Å |
Объемная |
Число |
||||
|
А |
В |
С |
β , 0 |
группа |
молекул в |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
ячейке |
ГНС |
21,159 |
5,585 |
14,693 |
110,04 |
Р2 |
/С |
4 |
ТНТ |
21,230 |
6,08 |
14,958 |
110,12 |
Р2 |
/ С |
8 |
Аддукт* |
10,685 |
5,684 |
14,421 |
104,18 |
– |
|
2 |
*предположительно комплекс 2 ТНТ: ГНС [204]
Краткие сведения о спектральных характеристиках ГНС и основных промежуточных продуктов его синтеза представлены в табл. 5.3.
Таблица 5.3
Характеристические полосы спектров ГНС и промежуточных продуктов его синтеза
|
Тип |
Тринитрохлорбензил |
ГНДБ |
ГНС |
|
|
спектра |
|
|
|
|
|
|
|
|
|
|
|
ПМР, δ , |
CDCl3, 5,13 (2Н,с, |
DMSO-d6 9,05 |
DMSO-d6, 7,15 (с,2H,CH), 9,15 |
|
|
м.д. |
СН2), 8,95(2Н, с, Ar) |
(c,4H,Ar), 3,39 |
(с,4H, Ar) [207]; 7,11 (с,2H,CH), |
|
|
|
|
(c, 4H, CH2 ) [206] |
9,07 (с,4H, Ar) [208] |
|
|
|
|
|
|
|
|
ИК-спектр, |
3110 с, 3070 ср, 3030 с, |
|
3100с, 3010 сл, 2890 |
сл, 1617с, |
|
ссм-1 |
1622 с, 1605с, 1535 ос, |
|
1600 с, 1540 ос, 1466сл, 1405 ср, |
|
|
|
1455 с, 1342 ос, 1278с, |
– |
1349ос, 1087 ср, 959 |
ср, 925 с, |
|
|
1275, 1205 с, 1172с, |
746с,730с,721с |
|
|
|
|
1091с, 929с, 924 с, 803 с, |
|
|
|
|
|
730с, 716 с |
|
|
|
|
|
|
|
|
|
Имеются сведения об использовании для анализа ГНС спектроскопического [205] и хроматографических методов. Так при использовании ВЭЖХ определение проводили на обратимой фазе С-18 с использованием подвижной фазы метанол – вода различного состава. Для смеси 50:50 время выхода составило для ГНС – 2, а для ТАТНБ – 4 минуты. При ТСХ (элюент бензол) для ГНС Rf=0,38.
112
Данные о взрывчатых и других специальных свойствах ГНС представлены в табл. 5.4.
|
|
|
Таблица 5.4 |
Взрывчатые и специальные свойства ГНС [202] |
|||
Характеристика |
|
ГНС-1 |
ГНС-2 |
Чувствительность к удару, 50%, груз 2,5 кг, |
44 |
61 |
|
см |
|
|
|
Термическая стабильность, см3/ (г · ч.) |
при |
1,8/260; |
0,3/260 |
температуре, 0С |
|
2,7/280 |
2,7/280 |
Скорость детонации, м/с при плотности |
7000/1,70; 7130 [209] |
||
г/см3 |
|
|
6150* |
КДД, мм |
|
|
~0,5 мм |
Температура воспламенения, 0С |
|
|
325 |
Теплота сгорания , кДж/кг |
|
|
14460 |
Чувствительность к трению, кг/см |
|
|
440 |
*после 200 ч. экспозиции при 2380С |
|
|
|
ГНС мало чувствителен |
к |
электрической искре, устойчив к |
|
радиационному воздействию, менее чувствителен к удару, чем тетрил.
5.2.Синтез и технология
Влитературе описан ряд методов получения ГНС. Однако следует
рассматривать два принципиально различных направления – с использованием и без использования хлора как окислителя.
В основу первого положены работы К. Шипп [201], согласно которым ГНС получают из ТНТ при обработке его гипохлоритом натрия в щелочных средах.
113
