
вопросыьWord (2)
.docxА. К. Бабко, Н. С. Полуэктов, К. Б. Яцимирский (АН Украины), Г. Л. Старобинец (АН Беларуси), Ю. С. Ляликов (АН Молдовы) и др. В настоящее время научный совет по аналитической химии РАН координирует исследовательские работы в масштабах всей страны. Разносторонние зарубежные связи наших химико-аналитиков осуществляются главным образом через Международный союз чистой и прикладной химии (ИЮПАК). Исследования, посвященные новым методам анализа, проводились не только Институтом геохимии и аналитической химии, но и другими институтами РАН, а также многими вузами. Новые работы систематически публикуются в «Журнале аналитической химии», в журнале «Заводская лаборатория», в сборниках «Проблемы аналитической химии» и на страницах многих других журналов. Труды российских ученых по аналитической химии представляют собой крупный вклад в мировую химическую науку. Сегодняшний день аналитической химии характеризуется многими изменениями: расширяется арсенал методов анализа, особенно в сторону физических и биологических; автоматизация и математизация анализа; создание приемов и средств локального, неразрушающего, дистанционного, непрерывного анализа; подход к решению задач о формах существования компонентов в анализируемых пробах; появление новых возможностей для повышения чувствительности, точности и экспрессности анализа; дальнейшее расширение круга анализируемых объектов. Широко используют теперь компьютеры, многое делают лазеры, появились лабораторные роботы; значительно поднялась роль аналитического контроля, особенно объектов окружающей нас среды. Возрос интерес к методологическим проблемам аналитической химии. Как четко определить предмет этой науки, какое место занимает она в системе научного знания, фундаментальная это наука или прикладная, что стимулирует ее развитие — эти и подобные вопросы были предметом многих дискуссий. Даже в традиционных областях аналитической химии накоплены важные новые данные, которые подчас изменяют устоявшиеся представления о механизме химических реакций, лежащих в основе тех или иных аналитических методов. Аналитическая служба. Значение и области применения аналитической химии В нашей стране аналитическая служба представляет собой совокупность аналитических служб отдельных ведомств, например в области промышленности, геологии, сельского хозяйства, ведомств охраны природы, здравоохранения и др. В США есть государственные аналитические службы, например в агентствах по защите окружающей среды, по аэронавтике и исследованию космического пространства; далее система распадается на подразделения, обслуживающие корпорации; иногда аналитические обслуживающие центры создаются в высших учебных заведениях. В промышленности различают контроль технологических процессов и контроль сырья и готовой продукции. Первый, как правило, должен быть оперативным, часто непрерывным, желательно автоматизированным. Второй, иногда будучи непрерывным (анализ сырья на ленте транспортера, например неразрушающими ядерно-физическими методами), обычно все-таки конкретный, выборочный, но во многих случаях требует точности и определения нескольких компонентов и чаще выполняется в лаборатории. Деятельность аналитических лабораторий предприятий имеет исключительно важное значение для государства в целом. Главная задача производственных лабораторий — в каждодневном обслуживании производства. Многие лаборатории ведут и методическую работу. Для эффективной работы контрольно-аналитические лаборатории должны постоянно получать новые методы, реактивы, приборы. Многие прикладные лаборатории, располагающие квалифицированными кадрами и современным оборудованием, участвуют в научной работе. В крупных лабораториях организуются специальные методические группы, основная цель которых — разработка, поиск, усовершенствование и приспособление к запросам предприятия или организации методов и приемов анализа. Очень важно укреплять такую научную базу на предприятиях, делать производственные лаборатории центрами исследований в области аналитической химии. Помощь развитию научных исследований в заводских лабораториях призваны оказать прежде всего соответствующие лаборатории отраслевых научно-исследовательских институтов, а также вузы и академические научные учреждения. Важен и обмен опытом между лабораториями, особенно в данной отрасли. Нельзя забывать также, что организация и проведение исследований — лучшее средство повышения квалификации работников лабораторий. Все химические анализы в промышленности можно разделить на констатирующие и оперативные, или экспрессные. Результаты констатирующих анализов нельзя непосредственно использовать для корректировки технологического процесса, хотя суммирование результатов таких анализов позволяет выявлять «хронические» дефекты технологии. Результаты констатирующих анализов, как и анализируемые образцы, можно хранить, обрабатывать, перепроверять. Другое дело — экспресс-анализы. Повторить этот анализ обычно невозможно, но, главное, результаты должны быть получены настолько быстро, чтобы их можно было использовать для изменения технологического процесса, если это необходимо. Серьезнейшая задача производственного контроля, особенно экспрессного, — его автоматизация. Есть еще один существенный аспект производственного аналитического контроля — его экономика. Стоимость аналитического контроля обычно невелика. Так, в металлургии она не превышает 1% стоимости продукции, а чаще всего составляет 0,3—0,7%. Дополнительные затраты на химический контроль окупаются повышением качества продукции, достижением большей стабильности технологических процессов. Один из недостатков в организации аналитического контроля — неопределенность решений, которые должны приниматься по результатам анализов, а в связи с этим и недостаточная ясность в вопросе о том, где и когда анализы обязательны. Аналитический контроль в наибольшем объеме требуется при запуске нового производства и его освоения. По мере того как технологические процессы осваиваются и стабилизируются, число точек пробоотбора и частота анализа должны сокращаться. В сущности, контроль должен сохраняться в тех точках, где по тем или иным причинам есть колебания в составе веществ. Аналитические определения необходимы при выполнении каждой научно-исследовательской работы по химии. Кроме того, к аналитическим методам прибегают в процессе выполнения научно-исследовательских работ в области геохимии, геологии, минералогии, металлургии, медицины, биологии, агрохимии и др. Методы аналитической химии широко реализуются в самых разнообразных производствах. Например, в нефтехимии, металлургии, при получении кислот, щелочей, соды, удобрений, органических продуктов и красителей, пластических масс, искусственных и синтетических волокон, строительных материалов, взрывчатых веществ, поверхностно-активных веществ, лекарственных препаратов, парфюмерии. Возрастает роль качественного и количественного анализа для сельского хозяйства, для повышения урожайности сельскохозяйственных культур и продуктивности животноводства. Изучают состав почв, определяют в них макро- и микроэлементы, анализируют удобрения и сельскохозяйственные яды, контролируют качество продукции растениеводства и животноводства. Теоретическую и методическую основу агрохимического анализа составляет аналитическая химия. Расход извести, гипса, азотных, фосфорных и калийных удобрений на единицу площади рассчитывают по химическому составу почвы. Чтобы правильно использовать удобрения, необходимо знать содержание в них главного питательного вещества (например, N2, Р2О5, К2О), которое может изменяться при хранении. В последние десятилетия в связи с расширением производства и применения синтетических пестицидов и гербицидов, микроудобрений и комплексных минеральных удобрений перед аналитической химией возникла необходимость определения микрокомпонентов в почвах, растениях, водах. Пестициды загрязняют окружающую среду. Пищевые продукты, получаемые из обработанных ими растений, могут содержать опасные для здоровья количества токсичных соединений. Успешное решение вопросов гигиены и токсикологии пестицидов и гербицидов возможно только при наличии высокочувствительных и простых аналитических методов определения. Классические химические методы часто малопригодны для этих целей как недостаточно чувствительные, длительные и громоздкие. Знание аналитической химии необходимо при изучении специальных дисциплин: почвоведения, общего земледелия, агрономической химии, физиологии животных и растений, микробиологии, химической защиты растений, процессов переработки продукции сельского хозяйства. Без аналитической химии немыслима правильная постановка агрохимического эксперимента. Экспериментальная работа в области многих сельскохозяйственных наук обычно связана с разработкой новых методов анализа. Например, К. А. Тимирязев, изучая физиологические проблемы дыхания растений, одновременно разработал и использовал новые, более точные методы определения оксида углерода (IV). С помощью метода меченых атомов изучен процесс фотолиза воды в клетках зеленого растения. Доказано, кроме того, что растения поглощают оксид углерода (IV) не только листьями из воздуха, но и корнями из почвы. Кроме сельскохозяйственных наук методами аналитической химии пользуются также биологические, медицинские и технические науки. В настоящее время развивается аналитическая космохимия, которая изучает
|
|
распространение элементов в космических телах. Например, в лунном грунте с высокой точностью определено содержание 65 элементов. Успешно изучается состав других планет Солнечной системы. Современные задачи аналитической химии Задачи аналитической химии можно кратко сформулировать следующим образом: 1. Развитие теории химических и физико-химических методов анализа, научное обоснование, разработка и совершенствование приемов и методов исследования, в том числе автоматических. 2. Разработка методов разделения веществ и методов концентрирования микропримесей. 3. Совершенствование и разработка методов анализа природных веществ, окружающей среды и технических материалов и т.п. 4. Обеспечение химико-аналитического контроля в процессе проведения разнообразных научно-исследовательских работ в области химии и смежных областей науки, промышленности, техники. 5. Поддержание химико-технологических и физико-химических процессов производства на заданном оптимальном уровне на основе систематического химико-аналитического контроля всех звеньев промышленного производства. Одна из важнейших задач современной аналитической химии состоит в контроле чистоты технически важных веществ. В науке и технике используются вещества различной чистоты. 6. Создание методов автоматического контроля технологических процессов, сочетающихся с системами управления на основе использования электронных вычислительных, регистрирующих, сигнализирующих, блокирующих и управляющих машин, приборов и аппаратов. Использованная литература 1. Аналитическая химия: Учебник для студ. сред. проф. учеб. заведений / Ю. М. Глубоков, В. А. Головачева, Ю. А. Ефимова и др.; Под ред. А. А. Ищенко. – М.: Издательский центр «Академия», 2004. 2. Крешков А. П. Основы аналитической химии. Теоретические основы. Качественный анализ, книга первая, изд. 4-е, перераб. М «Химия», 1976. 3. Цитович И. К. Курс аналитической химии. Учебник. 7-е изд стер. – Спб.: Издательство «Лань», 2004. 4. Основы аналитической химии. В 2 кн. Кн. 1. Общие вопросы. Методы разделения: Учебник для вузов / Ю. А. Золотов, Е. Н. Дорохова, В. И Фадеева и др. Под ред. Ю. А. Золотова. – 3-е изд перераб. и доп. – М.: Высш. шк 2004. 5. Аналитический контроль в основной химической промышленности / Н. Ф. Клещев, Т. Д. Костыркина, Г. С. Бескова, Е. Т.
Моргунова. – М.: Химия, 1992 г.
слоты
Электрохимические методы анализа. Потенциометрическое титрование
Способы определения точек эквивалентности с помощью индикаторов (см. § 20) не являются единственными. Во многих случаях изменение окраски индикатора наблюдать трудно, например в мутных и окрашенных растворах. В других случаях индикаторы не обеспечивают необходимой точности измерений. Поэтому все чаще применяют физико-химические методы определения точки эквивалентности. Так, при .электрохимическом титровании наблюдения ведут за изменением электропроводности (кондуктометрическое титрование), окислительно-восстановительного потенциала (потенциометрическое титрование), диффузионного тока (амперометрическое титрование) и т. п. Электрохимические методы определения точек эквивалентности отличаются высокой чувствительностью, быстротой выполнения и объективностью получаемых результатов. В учебнике отражены современные требования ветеринарного законодательства, новейших ГОСТов и технологических инструкции.
Потенциометрическое титрование
Потенциометрический метод титрования основан на измерении потенциала электрода, погруженного в раствор. Величина этого потенциала пропорциональна концентрации соответствующих ионов в растворе. Электрод, по потенциалу которого судят о концентрации определяемых ионов в растворе, называют индикаторным электродом. Потенциал индикаторного электрода определяют, сравнивая его с постоянной величиной потенциала электрода сравнения. Обычно в качестве электрода сравнения применяют нормальный водородный электрод или каломельный электрод.
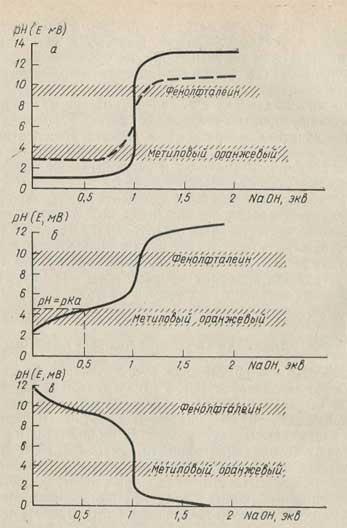
Рис. 17. Кривые потенциометрического титрования.
а - кривая нейтрализации хлористоводородной кислоты едким натром (10-1 и 10-3 н. растворы); б - кривая нейтрализации уксусной кислоты едким натром; в - кривая нейтрализации аммиака хлористоводородной кислотой.
Зависимость величины потенциала индикаторного электрода от концентрации раствора позволяет установить точку эквивалентности при титровании, так как в этой точке концентрация определяемого иона становится ничтожно малой, что в свою очередь приводит к резкому изменению (скачку) потенциала (рис. 17).
Титрование, при котором точка эквивалентности определяется по скачку потенциала электрода, погруженного в раствор, называют потенциометрическим титрованием, Потенциометричеокое титрование может успешно использоваться для титрования окрашенных и мутных растворов, слабых кислот и оснований, смесей кислот или оснований, смесей окислителей или восстановителей в неводных средах, для определения рН исследуемых растворов и т. д. Таким образом, метод потенциометрического титрования имеет ряд существенных преимуществ по сравнению с индикаторным методом.
При кислотно-основном потенциометрическом титровании изменение активности ионов водорода в растворе определяется по изменению потенциала любого электрода, применяемого для измерения величины рН. Наиболее удобной парой являются стеклянный и каломельный электроды. Водородный электрод служит стандартом, на котором основаны все измерения рН, однако этот электрод неудобен в работе, так как легко отравляется и часто дает неверные показания вследствие гидрирования определяемого вещества. Помимо использования в качестве основного стандарта, ценность водородного электрода заключается в возможности применения его для определения веществ, величина рКа которых больше 11-12, так как при значениях рН выше 12 стеклянный электрод неточен. Серебряный электрод в некоторых случаях предпочтительнее каломельного. Хингидронный и сурьмяный электроды применяются относительно редко.
В промышленных и обычных лабораторных работах вместо водородного электрода широко используется стеклянный. Наиболее важной частью стеклянного электрода является тонкостенный стеклянный пузырек, заполненный раствором соляной кислоты определенной концентрации, в которую погружен маленький электрод сравнения (обычно типа Ag-AgCl). Если два раствора с различными концентрациями ионов водорода разделены тонкой стеклянной мембраной, то между ее поверхностями возникает разность потенциалов, пропорциональная разности кислотностей растворов, находящихся по обе стороны стеклянной мембраны. При достаточном усилении эту разность потенциалов можно измерить. На этом и основано действие стеклянного электрода в качестве индикаторного. При высокой концентрации щелочи ионы натрия внедряются в мембрану, что приводит к искажению результатов. Поэтому едкое кали при потенциометрическом титровании со стеклянным электродом предпочтительнее едкого натра. Применение гидрата окиси тетраэтиламмония или другого четвертичного основания дает еще меньшую ошибку. Однако растворы четвертичных аммониевых оснований неудобны для практического применения вследствие их нестойкости.
Стеклянный электрод до и после измерений калибруют по двум (или более) буферным растворам с точно известными значениями рН. При этом значение рН хотя бы одного из контрольных растворов должно лежать близко к области измерения. Измерения проводят на приборе, который называется рН-метром. Показания прибора должны быть устойчивыми все время проведения анализа, что проверяется контрольными замерами по буферным растворам. Для обеспечения стабильных показаний рН-метра необходимы стабилизация напряжения на входе в прибор, а также заземление корпуса прибора и металлической оплетки коаксиального кабеля стеклянного электрода. После включения и предварительного прогрева прибора в течение 30 мин его проверяют по встроенному стандартному элементу и цепь уравновешивают по стеклянному и каломельному электродам, погруженным в рекомендованный в инструкции к прибору буферный раствор с точно известным значением рН. Через час показания прибора должны повториться без какой-либо дополнительной подстройки с точностью, указанной в паспорте прибора (обычно 0,05-0,01 рН). Толчок или вибрация могут нарушить настройку рН-метра. Поэтому прибор лучше устанавливать на массивном столе на коврике из пористой резины. Наиболее распространенными моделями отечественных рН-метров общего назначения являются лабораторный рН-метр ЛПУ-01, рН-метр-милливольтметр рН-121, рН-метр-милливольтметр рН-340, лабораторный рН-метр-милливольтметр рН-673, обеспечивающие измерение с точностью до 0,05 единицы рН. Наиболее старой из перечисленных моделей является ЛПУ-01. Прибор предназначен для определения активности ионов водорода ^ водных растворах. Шкала прибора градуирована в единицах рН и милливольтах и позволяет проводить непосредственный отсчет измеряемой величины. Для регистрации показаний к прибору ЛПУ-01 может быть подключен автоматический потенциометр типа ЭПП-09, ЭПД, ПС. рН-метр рассчитан на применение в заводских лабораториях.
рН-метры-милливольтметры рН-121, рН-340, рН-773 являются более современными приборами. Они предназначены для измерения активности ионов водорода (рН) и окислительно-восстановительного потенциала (Eh) растворов, а также для использования в качестве высокоомного ноль-индикатора и милливольтметра. При использовании электродов, селективных к одновалентным катионам, приборы могут быть применены для измерения активности (концентрации) этих ионов (например, pNa, pAg и т. п.).
При работе с блоком автоматического титрования приборы могут быть использованы для массового однотипного титрования.
Приборы позволяют производить измерения как в отдельных пробах, так и непосредственно в установках.
Прибор рН-340 может быть использован также в составе лабораторного автоматического титратора для титрования и записи кривых титрования. Переходная коробка, входящая в комплект прибора, позволяет одновременно в одной измерительной ячейке производить определение величины рН и окислительно-восстановительного потенциала. рН-673 является первым отечественным прибором подобного типа, выполненным целиком на интегральных микросхемах и транзисторах.
В дополнение к оказанному о приборах рН-121 и рН-340 прибор рН-673 может использоваться для титрования под током с двумя поляризованными электродами,, в частности при определении влаги методом Фишера. Кроме того, прибор имеет больший, чем другие модели, набор комплектующих запасных частей и принадлежностей, в частности термостатированную ячейку, герметизированную ячейку с платиновыми электродами, ячейку для микроизмерений, набор электродов и т. п.
Все приборы снабжены подробными техническими описаниями и детально разработанными инструкциями по эксплуатации.
Описанные приборы предназначены для использования в научно-исследовательских институтах, а также в заводских и цеховых лабораториях различного профиля.
Применение специальных приборов для автоматического титрования оправданно лишь при очень большом числе однотипных анализов.
Неустойчивость работы прибора в некоторых случаях может быть вызвана наличием переменного магнитного поля от расположенных вблизи электромоторов и другого электрооборудования.
Титрант можно добавлять либо из бюретки (в том числе из микробюретки) либо из микрошприца. Последнее особенно ценно при очень малых объемах титранта. Обычно установку для титрования оборудуют несколькими бюретками: отдельно для щелочи, кислоты. Особое внимание следует обращать на защиту титрованных растворов щелочи от углекислоты воздуха. В ряде случаев титрование необходимо вести в токе азота. Для получения достоверных результатов требуется строгий контроль температуры.
Большое значение имеет правильный выбор концентрации для титрования. Обычно точные условия указаны в методике. В других случаях можно руководствоваться следующими общими указаниями.
Если растворимость вещества позволяет, предпочтительно титровать его в 0,01 моль/л концентрации, так как при этом коэффициент активности мал и его можно не учитывать. Если принимать во внимание поправку на активность, то можно использовать растворы 0,1 моль/л концентрации. В тех случаях, когда необходимо фиксировать не только количество вещества, пошедшее на титрование, но и точное значение рН, надо обращать внимание на ионную силу раствора и разбавление раствора при титровании. Разбавление раствора титрантом вносит лишь небольшую ошибку, если выполнены следующие условия: титрант должен быть не менее чем в 10 раз более концентрированным, чем титруемый раствор; расчеты должны базироваться на концентрации, соответствующей средней точке титрования. При использовании титранта, в 100 раз более (концентрированного, чем титруемый раствор, разбавление можно не учитывать, но точность измерения объема титранта приобретает особое значение. Неточность измерения объема титранта является одной из наиболее общих ошибок. Это может быть вызвано либо неопытностью титрующего, либо ошибкой самой бюретки. Другой источник ошибки при определении заключается в наличии неучтенных примесей в анализируемом веществе, в связи с чем в растворе его присутствует меньше, чем предполагает исследователь. Самой распространенной примесью является вода или остатки растворителя, из которого вещество было выделено. Причиной может быть недостаточно тщательная сушка или небрежное хранение вещества. Неудовлетворительные результаты получаются в тех случаях, когда вещество разлагается в процессе титрования. Причиной ошибки может быть наличие таутомерии при различной реакционной способности таутомерных форм. Равновесие между таутомерами может устанавливаться медленно.
При титровании смеси кислот (оснований) или многоосновных кислот (оснований) на кривых титрования будет несколько перегибов, соответствующих точкам эквивалентности титруемых кислот. Появление четких скачков потенциала наблюдается только в тех случаях, когда отношение между константами диссоциации не менее чем 1000-10000. Если рКа обеих групп различаются меньше чем на 3 единицы, то обычно применяемые методы расчета не могут дать точных результатов. В этом случае титрование второй группы начинается прежде, чем заканчивается титрование первой, и кривые титрования имеют "смазанный" вид. Приближенные значения в этом случае могут быть получены путем нахождения положения максимального прироста рН при добавлении равных количеств титранта через равные промежутки времени. Удовлетворительный результат может быть получен при правильном подборе дифференцирующего растворителя (см. § 20) и соответствующего титранта.
При титровании по осаждению (например, титрование ионов галогена) в качестве индикаторного используют серебряный электрод. При титровании смеси анионов галогенов вследствие различной растворимости галогенидов серебра на кривой титрования будет несколько перегибов.
При окислительно-восстановительном титровании индикаторным электродом служит гладкий платиновый электрод.
При потенциометрическом титровании в неводных средах используют те же индикаторные электроды, что и в водных растворах.
