
- •3 Понятие химической связи. Состав и структура вещества. Аллотропия
- •Вещества
- •4.Изотопы. Радиоуглеродный метод.
- •Закон радиоактивного распада.
- •Коллоидные частицы не препятствуют прохождению света.
- •13. Основания. Щелочи. РОн.
- •15. Качественный количественный и структурный анализ.
- •16. Аналитическая реакция. Аналитический сигнал. Дробный и систематический анализ.
- •26. Электрохимические методы анализа. Принцип метода. Классификация.
- •27. Потенциометрический метод.
- •28. Кондуктометрический метод.
Закон радиоактивного распада.
t/t⅟₁₂
N(t)= N(0)*(1/2)
N(t) – количество атомов оставшихся после радиоактивного распада к времени t
N(0) –изначальное количество радиоактивного элемента
t – время
t⅟₁₂ -период полураспада ( время, за которое радиоактивному распаду подвергается половина вещества.) она Const
6. Понятие количества вещества. Моль. Эквивалент. Фактор эквивалентности.
Молекула - Наименьшая частица вещества, обладающая его химическими свойствами. (заряда не имеет)
Элемент – это вид атомов с определенным зарядом ядра.
Атом состоит из ядра (образованного из протонов и нейтронов) и электронов( вращающихся вокруг ядра)
Ядро имеет + заряд за счет протонов
Протон (Р) положительная частица.
Заряд ядра численно равен порядковому номеру элемента.
А́томная едини́ца ма́ссы (обозначение а. е. м.), она же углеродная единица[1] —единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц.
Атомная единица массы выражается через массу нуклида углерода 12C и равна 1/12 массы этого нуклида.
1 а.е.м =1 дальтон (da)
М (Н₂О) = А (0)+ 2А (Н)=16+ 2*1 = 18
Кол-во вещества v, n (моль)
Моль – кол во вещ-ва, которое, содержит столько же структурных единиц (атомов, молекул, ионов), сколько атомов углерода содержится в 12 г изотопа углерода С¹²
Молекулярная
масса - n
=
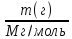
А.е.м. – безразмерная величина.
Эквивалент(э) – к-во вещества, эквивалентное в химических реакциях одному иону водорода Н⁺ или одному электрону.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ).
Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1.
эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
7. Способы выражения концентрации вещества.
Концентрацию веществ в растворах можно выразить разными способами. Прежде всего, необходимо прояснить одну очень важную особенность концентрации в любом ее выражении – концентрация всегда имеет размерность. Нередко концентрацией именуют то, что на самом деле ею не является. Например, содержание спирта 5% по объему – это не концентрация, это доля. Проценты – не размерность. Размерность – всегда что-то одно, деленное на что-то другое, например: г/моль, моль/литр и т.д. Рассмотрим кратко основные способы выражения концентрации.
Концентрация — величина, характеризующая количественный состав раствора.
1. Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
![]()
где:
m1 — масса растворённого вещества, г;
m — общая масса раствора, г.

Масса компонента
Масса смеси
Массовое процентное содержание компонента, m%

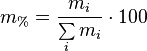
2. Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация на практике гораздо чаще выражают в моль/л или ммоль/л.
C=
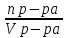 = (моль/с)
= (моль/с)
где:
n — количество растворённого вещества, моль;
V — общий объём раствора, л.
3. Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
С
=
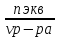 =[
=[
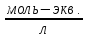 ]*
Н
]*
Н
,
где:
N — количество растворённого вещества, моль;
V — общий объём раствора, литров;
н — число эквивалентности (фактор эквивалентности
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
8. Классификация химических соединений
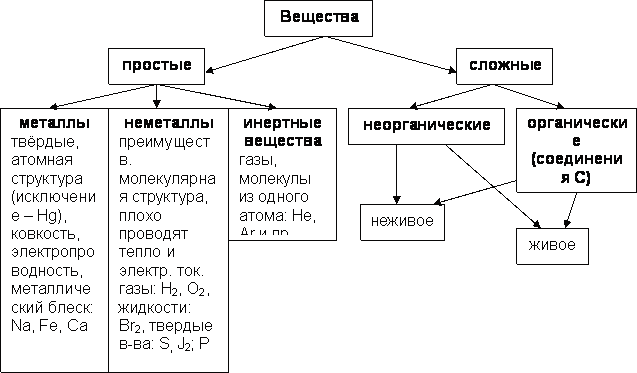
Неорганические:
Кислоты (НСL)
Основания(гидроксиды) группы ОН –щелочи
Соли kat⁺An¯ (KHSO4)
Оксиды СО2,СuO2
9. Основные классы органических веществ. Изомерия.
2 больших группы выделяют :
Органические:
Углероды:
1. предельные углеводороды СН4(метан)
2. непредельные углеводороды – ацитилен С2Н5
3. ароматические углеводороды

-бензол



-Нафталин


Спирты:
Этанол С2Н5ОН
Метанол СН3ОН
Карбонильные соединения:
- альдегиды (уксусный альдегид)
-кетоны(ацетон)
Карбоновые кислоты:
-карбоксильная группа
-уксусная к-та
Нитросоединения:
NO2
(Тротил)
Галогенорганические соединения:
-Наl
CHCL3
Амины
NH2
Анилин
Изомеры –вещества, имеющие одинаковую молекулярную формулу, а само явление – изомерия.
Типы изомерии:
1. структурная
С2Н6О(брутто-формула) С2Н5ОН
Н Н


Н – С – С – ОН


Н Н
СН3ОСН3 – диметиловый эфир
2. Геометрическая изомерия



 Н Н СН3
Н
Н Н СН3
Н



 С=С С
= С
С=С С
= С
СН3 СН3 Н СН3
Цис-изомер транс –изомер
3. Пространственная изомерия
Зеркальные изомеры
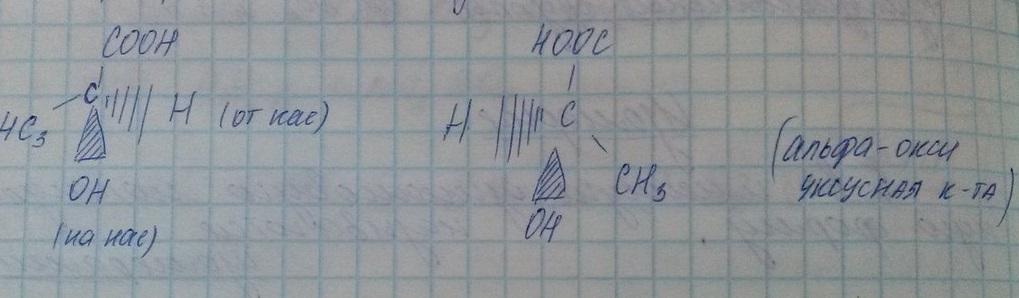
10. Оптическая изомерия. Использование D/L-изомерии для определения возраста умерших организмов.
Оптические изомеры (энантиомеры) – это пара изомеров, представляющая собой, зеркальное отражение друг друга, не совмещаемые в пространстве.
Оптические изомеры поворачивают луч света в разные стороны.
Следует обратить внимание на существование органических соединений, имеющих одинаковый состав, одинаковое строение и свойства, но по-разному относящихся к плоскополяризованному свету. Так, при пропускании через такие соединения луча поляризованного света происходит отклонение плоскости поляризации на определенный угол. Соединения, которые вращают плоскость поляризации, называют оптически активными. Изомер, вращающий плоскость поляризации света против часовой стрелки, называют левовращающим [L(–)-форма] , а по часовой стрелке – правовращающим [D(+)-форма] . Такие изомеры называются оптическими, или зеркальными изомерами (оптическими антиподами, энантиомерами). Оптическая изомерия обусловлена наличием асимметрического атома углерода С*, связанного с четырьмя различными заместителями. Привести примеры оптических изомеров. Так, например, оптические изомеры молочной кислоты отличаются друг от друга как предмет от своего зеркального изображения. D(+) молочная кислота L(-) молочная кислота (Тпл. = 26 0С, [α] = +3,8) (Тпл. = 26 0С, [α] = -3,8) Молекулы, которые нельзя совместить в пространстве и которые относятся друг к другу как предмет к своему зеркальному изображению, называют хиральными (от греческого «хейрос» – рука) , а явление существования таких веществ называется хиральностью. Смесь равных количеств L- и D-форм называется рацематической смесью. Рацематическая смесь оптически неактивна, т. к. действие одного антипода компенсирует
11. коллоидные системы. Отличие эмульсии от раствора.
Коллоидные системы это разновидность дисперсной системы.
Дисперсная система - любая двухкомпонентная система.
Свойства:
