
Тетрадь для лабораторных
.pdfфедеральное государственное бюджетное образовательное учреждение высшего образования «Тюменский государственный медицинский университет» Министерства здравоохранения Российской Федерации
(ФГБОУ ВО ТюмГМУ Минздрава России)
ТЕТРАДЬ
для отчётов по лабораторным работам по химии
студента_______________________________________
группы №_________
Тюмень, 2016

Тематический план лабораторных и практических занятий по дисциплине «Химия»
I семестр
№ |
Тематика занятий |
час |
занятия
Модульная единица 1.1.
Основы химической термодинамики и кинетики, свойства растворов, Редокс-процессы
1.1.1. |
Введение в курс химии. Окислительно-восстановительные |
3 |
|||
|
реакции. Электродные процессы. |
|
|
|
|
1.1.2. |
Основы химической термодинамики и биоэнергетики. |
3 |
|||
|
Термодинамика химического равновесия. Лабораторная |
|
|||
|
работа №1 «Качественные опыты по химическому |
|
|||
|
равновесию» |
|
|
|
|
1.1.3. |
Растворы. Коллигативные свойства растворов. Лабораторная |
3 |
|||
|
работа №2 «Определение осмотической концентрации и |
|
|||
|
изотонического коэффициента раствора электролита» |
|
|||
1.1.4 |
Протолитические |
реакции. |
Буферные |
растворы. |
3 |
|
Лабораторная работа № 3 «Свойства буферных растворов». |
|
|||
1.1.5. |
Химическая кинетика и катализ. Лабораторная работа №4 |
3 |
|||
|
«Изучение зависимости скорости реакции от концентрации и |
|
|||
|
температуры». Тестирование по модульной единице 1.1. |
|
|||
Модульная единица 1.2.
Биологически активные неорганические соединения (строение, свойства, участие в функционировании живых систем). Физико-химия поверхностных явлений и свойства дисперсных систем
1.2.1. |
Химия биогенных элементов. Химия биогенных элементов s- |
3 |
|
блока. Лабораторная работа № 5 «Химические свойства s- |
|
|
элементов, их применение в медицине». |
|
1.2.2. |
Химия биогенных элементов p-блока. Лабораторная работа |
3 |
|
№ 6 «Химические свойства p-элементов и их соединений». |
|
1.2.3. |
Химия биогенных элементов d-блока. Лигандообменные |
3 |
|
процессы. Строение металлоферментов, биокомплексных |
|
|
соединений. Лабораторная работа №7 «Химические свойства |
|
|
d-элементов». |
|
1.2.4. |
Физико-химия поверхностных явлений в функционировании |
3 |
|
живых систем. Лабораторная работа №8 «Адсорбционные |
|
|
процессы» |
|
1.2.5. |
Физико-химия дисперсных систем в функционировании |
3 |
|
живых систем. Лабораторная работа №9 «Свойства |
|
|
коллоидных растворов». Тестирование по модульной |
|
|
единице 1.2. |
|
Модульная единица 1.3. Низкомолекулярные биорегуляторы и биологически активные высокомолекулярные соединения (строение, свойства, участие в
2

функционировании живых систем)
1.3.1. |
Полифункциональные соединения (многоатомные спирты и |
|
3 |
|||
|
фенолы, полиамины, двухосновные карбоновые кислоты). |
|
|
|||
|
Лабораторная работа № 10 «Свойства одно-и-многоатомных |
|
|
|||
|
спиртов и фенолов» |
|
|
|
|
|
1.3.2. |
Гетерофункциональные соединения (аминоспирты, гидрокси- |
|
3 |
|||
|
и аминокислоты, оксокислоты. |
|
|
|
||
1.3.3. |
Биологически |
важные ароматические и гетероциклические |
|
3 |
||
|
соединения. |
|
|
|
|
|
1.3.4. |
Важнейшие α-аминокислоты, пептиды. Лабораторная работа |
|
3 |
|||
|
№11 «Химические методы обнаружения аминокислот и |
|
|
|||
|
белков» |
|
|
|
|
|
1.3.5. |
Углеводы. Лабораторная работа №12 «Качественные реакции |
|
3 |
|||
|
на углеводы и их функциональные группы» |
|
|
|
||
1.3.6. |
Нуклеиновые |
кислоты. Лабораторная работа №13 |
|
3 |
||
|
«Определение |
состава |
нуклеопротеидов». |
Зачёт: |
|
|
|
практические умения |
|
|
|
|
|
1.3.7. |
Высшие жирные кислоты. Липиды. Тестирование по |
|
3 |
|||
|
модульной единице 1.3. |
|
|
|
|
|
|
Зачёт: теоретическая подготовка (итоговое тестирование) |
|
|
|||
|
|
|
ПРАВИЛА |
|
|
|
|
техники безопасности при работе в химической лаборатории |
|
||||
1.Непременным условием безопасной работы в химической лаборатории является знание свойств тех веществ, с которыми предстоит работать. В связи с этим предварительно необходимо знакомиться с ними. Неаккуратность, невнимательность, незнание свойств химических соединений, с которыми ведется работа (огне-, взрывоопасности, возможной токсичности) могут привести к несчастному случаю.
2.С легколетучими жидкостями, токсичными соединениями необходимо работать только в вытяжном шкафу.
3.Нельзя пробовать какие либо вещества на вкус, в лаборатории запрещается принимать пищу.
4.При определении запаха веществ нельзя наклоняться над сосудом, следует лишь движением руки направлять к себе пары, исходящие от химического соединения.
5.Особую осторожность необходимо соблюдать при работе с металлическим натрием или калием:
- нельзя брать металлы руками, следует резать их на фильтровальной бумаге, пользоваться пинцетом -работать только с малыми количествами (не превышающими объем спичечной головки)
-пользоваться только сухой посудой, избегать попадания металла в воду
3
-обрезки натрия или калия нельзя выбрасывать в мусорное ведро, бросать в банку со сливом или раковину, их нужно уничтожать путем добавления небольших порций этилового спирта до полного исчезновения.
6.Любой химический сосуд, пробирку следует нагревать постепенно, открытый конец пробирки должен быть направлен в сторону от себя и работающих рядом студентов. Необходимо пользоваться нагревательными приборами с закрытой спиралью, нужно избегать открытого пламени.
7.Во избежание разбрызгивания нельзя наливать воду в серную кислоту, при приготовлении растворов кислот и щелочей пользоваться только фарфоровой посудой.
8.В лаборатории запрещается хранить большие количества легколетучих жидкостей (более 1 л), емкости с такими веществами закрываются корковой или винтовой крышкой, но не крышкой со шлифом.
9.Емкости с кислотами нужно хранить в поддонах с песком, который выбрасывается в случае вытекания кислот.
10.Для исключения возможности попадания на лицо концентрированных щелочей и кислот их нельзя устанавливать на уровне выше груди.
11.Все реактивы должны быть снабжены этикеткой с легко читаемой надписью, в противном случае реактивы выбрасываются.
12.Склянки со сливом должны после работы быть вынесены из лаборатории и вылиты в специально обустроенные ямы. Кислоты и щелочи должны сливаться в разные банки.
Меры первой помощи
1.При химических ожогах нужно удалить вещество, вызвавшее ожог, а затем обработать кожу соответствующим образом:
-при ожогах кислотой или щелочью вытереть кожу тряпкой, затем промыть струей воды и нейтрализовать остатки кислоты 1% раствором бикарбоната натрия, при ожогах
щелочью - 1% раствором уксусной кислоты;
-при ожогах бромом пораженное место обрабатывают 10% раствором гипосульфита натрия, затем все смывают большим количеством воды
-при ожогах фенолом кожу растирают глицерином, обмывают водой с мылом 2. При загораниях выключают вытяжную систему, гасят пламя песком или
накрывают негорючим одеялом.
3. При отравлениях газами пострадавшего выводят на свежий воздух и вызывают врача.
4
ФОРМА ОТЧЕТА по лабораторным и практическим занятиям
1.Название работы. Цель работы.
2.Номер и название опыта.
3.Химизм происходящих процессов (уравнения реакций).
4.Краткая методика эксперимента.
5.Наблюдения (описывается аналитический эффект реакции: изменение окраски, выпадение осадка, выделение газа, появление характерного запаха и др.).
6.Выводы (в выводах осмысливается и указывается значение реакции или ее продуктов для медицины, возможности обнаружения каких-либо соединений в биологическом материале и т.д.).
7.Ответы на вопросы.
Лабораторная работа оформляется в общей тетради для лабораторно-
практических занятий. Каждая следующая лабораторная начинается с нового листа. Обязательны поля, на которых после собеседования с преподавателем можно внести правку в наблюдениях и выводах. Лабораторная работа считается зачтенной после ее личного практического выполнения и защиты (знания химизма, ответов на вопросы). Частью лабораторной работы может являться выполнение эксперимента с элементами исследовательской работы (УИРС). Эксперимент по УИРС, как правило, предлагается студентам, успешно справившимся с опытами лабораторной работы.
Занятие 1.1.2.
ТЕМА: Основы химической термодинамики и биоэнергетики. Термодинамика химического равновесия.
ЦЕЛЬ: Научиться формулировать и применять основные положения термодинамики к физическим и химическим процессам.
Лабораторная работа №1 Качественные опыты по химическому равновесию
Цель: Изучить влияние изменения концентраций и температуры на состояние химического равновесия. Сравнить результаты наблюдений с прогнозом на основе принципа Ле Шателье.
Оборудование. Химические стаканы вместимостью 100 и 250 мл, пробирки одинакового диаметра в штативе, пипетки глазные или капельницы, спиртовка.
Реактивы: Насыщенные растворы FeCl3, KNCS, раствор дийода (с=0,05моль/л), 0,5%-ный раствор крахмала, КС1(крист).
Выполнение эксперимента Опыт 1. Смещение химического равновесия при изменении концентрации реагентов
Для опыта воспользуемся реакцией образования железа (III) тиоцианата:
FeCl3+ 3KNCS Fe(NCS)3 + ЗКС1
5
(точнее, в данной реакции получаются тиоцианатные комплексы железа (III) с числом тиоцианатных групп у атома железа от 1 до 6).
Железо (III) тиоцианат интенсивно окрашен в красный цвет, раствор FeCl3 - в желтоватый, а растворы KNCS и КС1 бесцветны. При изменении концентрации Fe(NCS)3 окраска раствора изменяется, что позволяет визуально установить направление смещения равновесия.
К 20 мл воды в небольшом стакане прибавьте по 1-2 капли насыщенных растворов FeСl3 и KNCS. Полученный раствор разлейте в четыре пробирки. Затем в 1-ю пробирку прибавьте несколько капель концентрированного раствора FeСl3. Что наблюдаете? Запишите в таблицу наблюдаемое изменение окраски и укажите направление смещения равновесия (стрелка вправо или влево).
Затем во 2-ю пробирку прибавьте несколько капель концентрированного раствора KNCS. Снова отметьте наблюдения и запишите в таблицу наблюдаемое изменение окраски и укажите направление смещения равновесия. Наконец, в З-ю пробирку прибавьте немного кристаллического КС1. Сравните окраску в З-й пробирке после прибавления КС1 с окраской раствора в пробирке сравнения, запишите изменение окраски в таблицу и укажите направление смещения равновесия. Запишите, соответствуют ли наблюдаемые смещения химического равновесия принципу Ле Шателье.
Про |
Добавлено в |
Наблюдение - |
Вывод - направление |
бирк |
пробирку |
изменение |
смещения равновесия |
а |
|
интенсивности |
|
|
|
окраски |
|
1 |
FeCl3 (р) |
|
|
2 |
KNCS (р) |
|
|
3 |
KCl (т) |
|
|
4 |
|
|
|
Опыт 2. Смещение химического равновесия при изменении температуры.
В стакане вместимостью 250 мл нагрейте воду (почти до кипения). В две пробирки внесите по 4-5 мл крахмала и прибавьте туда же по 3-4 мл раствора дииода. Запишите наблюдения (цвет образовавшегося раствора). Нагрейте одну из пробирок, опустив ее на несколько минут в стакан с горячей водой. Вторую пробирку оставьте для сравнения. Наблюдайте изменение окраски. Как изменяется окраска раствора в нагретой пробирке по сравнению с холодной? Запишите наблюдения. Охладите нагретую пробирку. Что происходит?
Запишите уравнение изученного равновесия: |
|
||
I2 + |
крахмал |
|
I2 ×Крахмал] |
желтый |
бесцветный |
|
синий |
Наблюдения:
____________________________________________________________________
__________________________________________________________________
6
____________________________________________________________________
__________________________________________________________________
Основываясь на результатах наблюдений, сделайте вывод о направлении смещения равновесия в системе при ее нагревании и охлаждении. Исходя из принципа Ле Шателье, ответьте на вопрос: - экзоили эндотермической является реакция образования иодокрахмала и реакция его диссоциации?
Выводы:
____________________________________________________________________
__________________________________________________________________
____________________________________________________________________
__________________________________________________________________
Вопросы к защите работы
1.Запишите выражение констант равновесия работе (ЗДМ), изученных вами реакций.
____________________________________________________________________
__________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
__________________________________________________________________
2.Сформулируйте принцип Ле-Шателье.
____________________________________________________________________
__________________________________________________________________
____________________________________________________________________
__________________________________________________________________
____________________________________________________________________
__________________________________________________________________
3.Влияет ли катализатор на положение равновесия? Зависит ли числовое значение константы равновесия от катализатора?
____________________________________________________________________
__________________________________________________________________
____________________________________________________________________
__________________________________________________________________
4.При увеличении температуры увеличиваются скорости как прямой, так и обратной реакций. Почему же наблюдается смещение равновесия?
Изменяется ли при этом константа химического равновесия?
____________________________________________________________________
__________________________________________________________________
____________________________________________________________________
__________________________________________________________________
7
5.В какую сторону сместится равновесие СО(г) + Н2О(г)↔СО2(г) + Н2, Н0 =-43 кДж а) при уменьшении концентрации воды______________
б) при увеличении температуры____________________
в) при уменьшении давления_______________________
6. Изменяется ли константа химического равновесия при смещении равновесия в результате изменения концентрации какого-либо компонента системы?
____________________________________________________________________
__________________________________________________________________
____________________________________________________________________
__________________________________________________________________
Занятие 1.1.3. ТЕМА: Растворы. Коллигативные свойства ратворов
ЦЕЛЬ: Изучить коллигативные свойства растворов и приобрести навыки криометрических измерений.
Лабораторная работа №2 Определение осмотической концентрации и изотонического коэффициента
раствора электролита
Цель: Приобрести навыки физико-химических измерений и обработки результатов эксперимента на примере криометрического определения осмотической концентрации и изотонического коэффициента 5%-ного раствора натрия сульфата.
Оборудование: Прибор для криометрических измерений. Термометр для измерения температуры в области ее отрицательных значений с ценой деления
0,1 К.
Реактивы: Дистиллированная вода, лед колотый (снег), натрий хлорид технический, исследуемый раствор.
Выполнение эксперимента: Получите у лаборанта прибор для криометрических определений.
Прибор (рис. 1) состоит из широкой стеклянной пробирки 1, закрытой пробкой, в которую вставлены термометр 2 и металлическая мешалка 3. Пробирку помещают в толстостенный стакан 4, в котором готовят охлаждающую смесь.
Приготовьте охлаждающую смесь из 3 ч. снега или льда и 1 ч. NaCl. Поместите смесь в сосуд 4. Измерьте термометром температуру охлаждающей смеси. Она должна быть около -5°С. Охлаждающая смесь должна заполнять стакан примерно на 3/4 его объема.
8
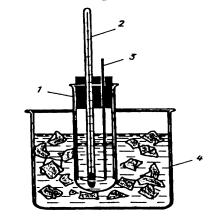
Рисунок 1
В пробирку 1 налейте такой объем дистиллированной воды, чтобы полностью покрыть резервуар термометра, закройте пробирку пробкой с термометром и мешалкой и поместите пробирку в стакан с охлаждающей смесью. Непрерывно помешивая воду мешалкой 3 (старайтесь не касаться мешалкой термометра), следите за изменением температуры. Следите, чтобы термометр не касался дна и стенок пробирки 1. Обычно температура опускается немного ниже точки замерзания воды, затем начинается кристаллизация, выделяется энергия и столбик ртути или спирта резко поднимается вверх и затем застывает на значении температуры кристаллизации воды (около 0°С). Отметьте температуру замерзания воды, запишите ее в журнал с точностью, которую позволяет зафиксировать используемый вами термометр. Выньте пробирку из охлаждающей смеси и, подогревая ее рукой, полностью растворите образовавшиеся кристаллы льда. Снова опустите пробирку в охлаждающую смесь и повторите определение температуры замерзания воды. Получите у преподавателя склянку с анализируемым раствором и запишите в журнал данные о растворе. Сполосните пробирку 1 анализируемым раствором и заполните ее раствором так же, как и при измерении температуры замерзания воды. Закройте пробирку пробкой, вставьте в нее термометр и мешалку (предварительно и то и другое должно быть сполоснуто анализируемым раствором). Определите температуру начала замерзания раствора, как определяли температуру замерзания воды. Все измерения запишите в лабораторный журнал. После работы разберите прибор для криоскопических измерений. Вылейте раствор из пробирки 1. Сполосните водопроводной и дистиллированной водой. Вымойте стакан 4.
Обработка результатов эксперимента:
1. |
Рассчитайте |
температуру |
понижения замерзания раствора |
по |
|
|
сравнению с чистым растворителем: |
|
|
||
|
|
Тзам = ТН2О – Тр-ра |
|
|
|
2. |
Рассчитайте |
моляльную |
концентрацию 5%-ного |
раствора |
|
|
(теоретическое значение bтеор). |
|
|
||
|
|
|
9 |
|
|
3.Используя экспериментально найденную величину понижения температуры замерзания исследуемого раствора вычислите практическое значение моляльной концентрации (bпракт).
4.Определите изотонический коэффициент анализируемого раствора электролита.
5.Сравните полученное значение изотонического коэффициента с возможно максимальным для раствора данного вещества. Объясните вероятные причины отклонений.
Расчёты:
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
Выводы:
____________________________________________________________________
____________________________________________________________________
_________________________________________________________________
10
