
- •Титриметрический метод определения общей щелочности и карбонатной жесткости воды
- •3.1 Титриметрический анализ. Основные понятия
- •3.2 Растворы, применяемые в титриметирическом анализе
- •3.3 Классификация методов титриметрического анализа Методы титриметрического анализа классифицируются по типу химической реакции, лежащей в основе определяемого вещества.
- •3.5 Индикаторы в кислотно-основном титровании
- •Характеристики перехода кислотно-основных индикаторов
- •Приготовление растворов индикаторов. Метиловый оранжевый (0,1% в воде): 0,01 г красителя растворяют в 10 мл воды; применяют в количестве 3-4 капель на 25 мл титруемого раствора.
- •3.6 Техника титрования
- •3.8 Выполнение работы
- •Задание 3. Стандартизация (определение точной концентрации) раствора хлорводородной кислоты по навеске щелочи
- •3.9 Порядок оформления отчета
- •Задание 2. Стандартизация (определение точной концентрации) раствора щелочи по точному раствору хлорводородной кислоты
- •Задание 3. Стандартизация (определение точной концентрации) раствора хлорводородной кислоты по навеске щелочи
3.5 Индикаторы в кислотно-основном титровании
В реакции нейтрализации при достижении точки эквивалентности происходит изменение значения рН раствора. Поэтому для фиксирования точки эквивалентности используют вещества – индикаторы, окраска которых меняется в зависимости от изменения рН. Наиболее часто используемые индикаторы приведены в таблице 3.1.
Таблица 3.1
Характеристики перехода кислотно-основных индикаторов
|
Индикатор |
Интервал рН перехода |
Изменение окраски
|
|
Метиловый оранжевый |
3,1—4,4 |
оранжево - желтая |
|
Метиловый красный |
4,2- 6,2 |
красная - желтая |
|
Фенолфталеин |
8,2—10,0 |
Бесцветная - красная |
|
Бромтимоловый синий |
6,0-7,6 |
желтая- синяя |
Приготовление растворов индикаторов. Метиловый оранжевый (0,1% в воде): 0,01 г красителя растворяют в 10 мл воды; применяют в количестве 3-4 капель на 25 мл титруемого раствора.
Метиловый красный (0,2% в 60% этаноле): 0,02 г красителя растворяют в 10 мл 60% этанола; применяют в количестве 2-3 капель.
Фенолфталеин (1% в 60% этаноле): 0,1 г красителя растворяют в 10 мл 60 % этанола; применяют в количестве 2 капель.
Бромтимоловый синий (0,1% в 20% этаноле). 0,01 г красителя растворяют в 10 мл 20% этанола.
Смешанные индикаторы. В некоторых случаях вместо одного индикатора лучше применять смесь двух индикаторов. Примером служит индикатор Ташира, представляющий собой смесь метилового красного (0,1 % в воде) и метиленового синего (0,1% в этаноле). При значениях рН раствора, меньших 4,0, цвет этого индикатора фиолетовый, а при значениях, больших 6,0 - зеленый.
3.6 Техника титрования
Т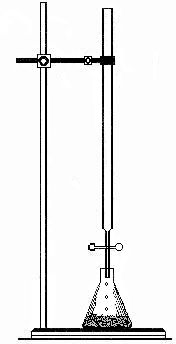 итрование
производится в конических колбах. Размер
колбы подбирается так, чтобы общий объем
жидкости в конце титрования не превышал
половину объема колбы. Сам процесс
титрования состоит в прибавлении
титранта из бюретки к анализируемому
раствору, находящемуся в колбе. Раствор
из бюретки прибавляют до тех пор, пока
количество прибавленного вещества не
будет эквивалентно количеству вещества,
находящемуся в колбе. Этот момент
называется конечной точкой титрования
(КТТ).
итрование
производится в конических колбах. Размер
колбы подбирается так, чтобы общий объем
жидкости в конце титрования не превышал
половину объема колбы. Сам процесс
титрования состоит в прибавлении
титранта из бюретки к анализируемому
раствору, находящемуся в колбе. Раствор
из бюретки прибавляют до тех пор, пока
количество прибавленного вещества не
будет эквивалентно количеству вещества,
находящемуся в колбе. Этот момент
называется конечной точкой титрования
(КТТ).
Рис. 3.3. Положение колбы при титровании.
Перед началом титрования заполняют бюретку раствором и доводят уровень жидкости до нулевой черты. В коническую колбу помещают точный объем анализируемого раствора, и добавляют нужное количество индикатора. Затем проверяют правильность установки уровня жидкости в бюретке на нулевое деление. Это надо делать обязательно перед самым началом титрования.
Подставляют колбу с титруемым раствором под бюретку. Правильное положение при титровании показано на рис. 3.3. Под колбу кладут лист белой бумаги, чтобы точнее заметить момент изменения цвета раствора. Колбу держат в правой руке, а левой открывают и закрывают кран, выпуская жидкость из бюретки.
При титровании раствор должен вытекать по каплям, сначала быстро, а вблизи конечной точки очень медленно. Во время титрования раствор в колбе следует все время перемешивать вращательными движениями.
Когда изменение окраски раствора покажет, что наступил конец титрования, прекращают прибавление раствора и определяют объем рабочего раствора, затраченного на титрование по показаниям бюретки .
Если при титровании нельзя сказать с уверенностью, что достигнута конечная точка, то следует записать показания бюретки, прибавить еще одну каплю раствора и наблюдать, происходит ли изменение в окраске титруемого раствора.
Записывают результаты титрования с точностью до второго десятичного знака, например: 10,53 мл; 11,20 мл; 9,00 мл.
Необходимо брать такое количество анализируемого раствора, чтобы объем рабочего раствора, затраченного на титрование, составлял не менее 1/3 объема бюретки. Наиболее точные результаты получаются в том случае, когда при титровании из бюретки вместимостью 25 мл прибавляют от 10 до 20 мл рабочего раствора, а из бюретки вместимостью 50 мл—от 20 до 40 мл рабочего раствора.
Чтобы убедиться в правильности результатов титрования проводят параллельное определение. Для этого в другую коническую колбу помещают такое же количество титруемого раствора, наполняют бюретку рабочим раствором и повторяют титрование. Если результаты двух определений расходятся не более чем на 0,1 мл для бюреток вместимостью 25 или 50 мл, то их можно считать правильными. В случае расхождения полученных результатов титрование повторяют. В ответственных случаях проводят 3 параллельных определения. Для расчета берут среднее арифметическое полученных результатов.
3.7 Вычисление результатов титриметрических определений
С пособы
выражения концентраций в титриметричеком
анализе. Молярная
концентрация вещества A
(с (А))
– это количество растворенного вещества
A
в молях, содержащееся в одном литре
раствора:
пособы
выражения концентраций в титриметричеком
анализе. Молярная
концентрация вещества A
(с (А))
– это количество растворенного вещества
A
в молях, содержащееся в одном литре
раствора:
где n(A)- количество растворенного веществ А, моль; V(A)- -объем раствора, л; m(A) – масса растворенного вещества А, г; M(A) – молярная масса растворенного вещества А, г/моль. Молярная концентрация измеряется в моль/л.
М олярная
концентрация эквивалентаc(1/zA),
или нормальность (старое название) –
это количество растворенного вещества
А
в молях, соответствующее эквиваленту
A,
содержащееся в одном литре раствора:
олярная
концентрация эквивалентаc(1/zA),
или нормальность (старое название) –
это количество растворенного вещества
А
в молях, соответствующее эквиваленту
A,
содержащееся в одном литре раствора:
где 1/z - фактор эквивалентности, который рассчитывается для каждого вещества на основании стехиометрии реакции; n(1/z A) – количество вещества, равное эквиваленту А в растворе, моль; M(1/z A) – молярная масса эквивалента растворенного вещества А, г/моль. Молярная концентрация эквивалента измеряется в моль/л.
Т
![]() итр
Т(А)
растворенного вещества А – это масса
растворенного вещества , содержащегося
в одном миллилитре раствора:
итр
Т(А)
растворенного вещества А – это масса
растворенного вещества , содержащегося
в одном миллилитре раствора:
где V(A) - объем раствора (мл). Титр измеряеися в г/мл или в мкг/мл.
При проведении титрования можно брать либо точно отмеренный объем анализируемого раствора, либо определенную массу анализируемого вещества. В соответствии с этим различают два подхода: метод пипетирования и метод отдельных навесок.
Вычисление результатов по методу пипетирования
Метод
пипетирования состоит в том, что отбирают
с помощью калиброванной пипетки точный
объем V(X)
анализируемого раствора вещества Х
(аликвоту) с неизвестной молярной
концентрацией эквиалента с(1/z)
и титруют титрантом с известной молярной
к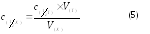 онцентрацией
эквивалента с(1/zТ).
Для вычислений используют формулу:
онцентрацией
эквивалента с(1/zТ).
Для вычислений используют формулу:
О пределив
концентрацию ализируемого раствора
можно рассчитать массу вещества во всем
анализируемом растворе:
пределив
концентрацию ализируемого раствора
можно рассчитать массу вещества во всем
анализируемом растворе:
где Vк- - объем всего анализируемого раствора в мерной колбе (объем мерной колбы).
Пример 1. Определить точную молярную концентрацию эквивалнта раствора NaOH (гидроксида натрия) по точно 0,1 M раствору хлорводородной кислоты НС1. Для титрования взято 10 мл раствора НС1. Проведено титрование трех параллельных проб. На 1-е титрование пошло V1=10,25 мл, на 2-е V2= 10,27 мл, на 3-е V3= 10,25 мл NaOH.
Решение. Определяют Vср:
В![]()
![]() формулу
формулу
подставляют данные и вычисляют точную нормальность раствора:
![]()
Вычисление результатов по методу отдельных навесок. В этом случае взвешивают на аналитических весах точную навеску m(A) вещества А, переносят ее в колбу для титрования, растворяют, прибавляя в колбу некоторое количество растворителя, и тируют полученный раствор..
В
(7)

Пример 2. Определить молярную концентрацию раствора нитрата серебра с(AgNO3). Анализируемое вещество - хлорид натрия NaCl. Масса навески NaCl - 0,1170 г. Объем раствора нитрата серебра V(AgNO3), расходованного на титрование, равен 20,05 мл.
Решение. В формулу
г![]() де
с(AgNO3)
— молярная концентрация титранта;
m(NaCl)
— навеска анализируемого вещества, г;
M(NaCl)
— эквивалентная масса анализируемого
вещества; - объём титранта, расходованного
на титрование, мл, п
де
с(AgNO3)
— молярная концентрация титранта;
m(NaCl)
— навеска анализируемого вещества, г;
M(NaCl)
— эквивалентная масса анализируемого
вещества; - объём титранта, расходованного
на титрование, мл, п![]() одставляют
данные и вычисляют точную нормальность
раствора:
одставляют
данные и вычисляют точную нормальность
раствора:
