
Контрольная по химии вар. № 24
.docx

![]()
4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Ответ: 9 г/моль.
Дано:
m(Me(OH)x) = 1,3 г
m(Me2(SO4)x) = 2,85 г
Найти: Мэкв(Ме)
Решение:
Согласно закону эквивалентов:
m (гидроксида) m (сульфата)
———————— = ———————
Mэкв (гидроксида) Mэкв (сульфата)
1,3 2,85
————————— = ——————————
Mэкв(Ме) + Mэкв (ОН) Mэкв (Ме) + Mэкв (SO42-)
1,3 2,85
——————— = ———————
Mэкв(Ме) + 17 Mэкв (Ме) + 48
1,3 (Mэкв (Ме) + 48) = 2,85 (Mэкв(Ме) + 17)
1,3Mэкв (Ме) + 62,4 = 2,85 Mэкв(Ме) + 48,45
1,55Mэкв (Ме) = 13,95
Mэкв (Ме) = 9 г/моль
Ответ: 9 г/моль
25. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4p? Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
Решение:
Заполнение электронами орбиталей в атоме происходит по правилу Клечковского: в порядке возрастания суммы главного (n) и орбитального (l) квантовых чисел. При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
Для орбитали 4s: n = 4, l = 0; n + l = 4
Для орбитали 3d: n = 3, l = 2; n + l = 5
Значит 4s заполнится раньше, чем 3d.
Для орбитали 5s: n = 5, l = 0; n + l = 5
Для орбитали 4p: n = 4, l = 1; n + l = 5
Значит 4p заполнится раньше, чем 5s.
21Sc 1s22s22p63s23p63d14s2.
46. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия.
Решение:
|
Формулы оксидов |
Формулы гидроксидов |
|
Na2O |
NaOH |
|
MgO |
Mg(OH)2 |
|
Al2O3 |
Al(OH)3 |
|
SiO2 |
H2SiO3 |
|
P2O5 |
H3PO4 |
|
SO3 |
H2SO4 |
|
Cl2O7 |
HClO4 |
Химический характер этих соединений при переходе от натрия к хлору меняется от основного к кислотному.
Уравнения реакций, доказывающие амфотерность гидроксида алюминия:
- растворение в кислотах:
![]()
- растворение в щелочах:
![]()
67. Распределите электроны атома серы по ковалентным ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами?
Решение:
Распределение электронов атома серы по квантовым ячейкам в нормальном состоянии:
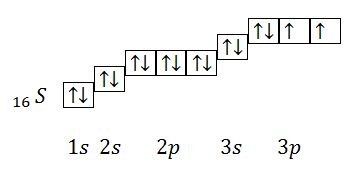
Из данного электронного строения атома видно, что количество неспаренных электронов равно 2. Соответственно валентность серы в таком состоянии равна 2.
Атом серы имеет два возбужденных состояния.
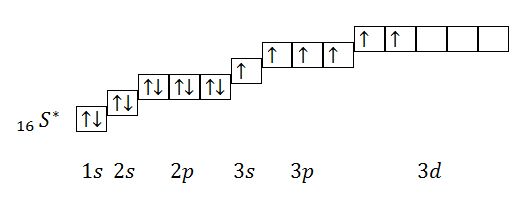
Первое возбужденное состояние:
Из данного электронного строения атома видно, что количество неспаренных электронов равно 4. Валентность серы в первом возбужденном состоянии равна 4.
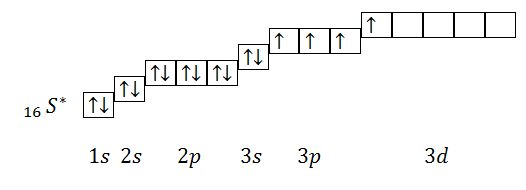
Второе возбужденное состояние:
Из данного электронного строения атома видно, что количество неспаренных электронов равно 6. Валентность серы во втором возбужденном состоянии равна 6.
88. Какой объем 20,01%-ного раствора HСl (ρ = 1,100 г/см3 ) требуется для приготовления 1 л 10,17%-ного раствора (ρ = 1,050 г/см3 )? Ответ: 485,38 см3.
Дано:
w1(HCl) = 20,01%
ρ1р-ра = 1,100 г/см3
V2р-ра = 1 л
w2(HCl) = 10,17%
ρ2р-ра = 1,050 г/см3
Найти: V1р-ра
Решение:
m2(р-ра) = 1000 см3 *1,050 г/ см3 = 1050 г
m(НСl) = 1050 г *10,17%/100% = 106,8 г
m1(р-ра) = 106,8 г *100 %/20,01 %= 533,7 г
V1(р-ра) = 533,7 г /1,100 (г/см3) = 485,38 см3
Ответ: 485,38 см3.
109. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718 оС. Температура кристаллизации уксусной кислоты 16,65 0С.
Дано:
m(С14Н10) = 4,25 г
m(CH3COOH) = 100 г
t крист (р-ра) = 15,718 оС
t крист (CH3COOH) = 16,65 0С
Найти: Ккр (CH3COOH)
Решение:
Согласно закону Рауля, температура кристаллизации раствора ниже температуры кристаллизации растворителя
t крист (р-ра) = t крист (растворителя) - ∆t
15,718 = 16,65 - ∆t
∆t = 16,65 – 15,718 = 0,932 °С
Понижение температуры замерзания, согласно закону Рауля:
∆t = Сm · К(растворителя)
К (растворителя) – криоскопическая константа растворителя
Сm - моляльная концентрация раствора – количество молей растворенного вещества, приходящееся на 1 кг растворителя. Вычислим ее:
m(C14H10) 4,25 г
Сm = ———————————————— = ————————— = 0,2388 моль/кг
M(C14H10) · m(уксусной кислоты, кг) 178 г/моль·0,1 кг
К(растворителя) = ∆t/Сm = 0,932/0,2388 = 3,9°С
Ответ: 3,9°С
130. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) AgNO3 и K2CrO4; б) Pb(NO3)2 и KI; в) CdSO4 и Na2S.
Решение:
а) 2AgNO3 + K2CrO4 → 2KNO3 + Ag2CrO4↓
2Ag+ + 2NO3 - + 2K+ + CrO4 2- → 2K+ + 2NO3 - + Ag2CrO4↓
2Ag+ + CrO4 2- → Ag2CrO4↓
б) Pb(NO3)2 + 2KI → PbI2↓ + 2KNO3
Pb2+ + 2NO3− + 2K+ + 2I− → PbI2↓ + 2K+ + 2NO3−
Pb2+ + 2I− → PbI2↓
в) CdSO4 + Na2S → CdS↓ + Na2SO4
Cd2+ + SO42− + 2Na+ + S2− → CdS↓ + 2Na+ + SO42−
Cd2+ + S2− → CdS↓
151. Какие из солей RbCI, Cr2(SO4)3, Ni(NO3)2, Na2SO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 <) имеют растворы этих солей?
Решение:
RbCI – соль, образованная сильным основанием и сильной кислотой. Гидролизу не подвергается. рН раствора равно 7 (нейтральная среда).
Cr2(SO4)3, Ni(NO3)2 – соли, образованные слабым основанием и сильной кислотой. Гидролизуются по катиону. рН < 7 (кислая среда).
Cr2(SO4)3 + 2HOH ↔ 2CrOHSO4 + H2SO4
2Cr3+ + 3SO42− + 2HOH ↔ 2CrOH2+ + 2SO42− + 2H+ + SO42−
Cr3+ + HOH ↔ CrOH2+ + H+
Ni(NO3)2 + HOH ↔ NiOHNO3 + HNO3
Ni2+ + 2NO3− + HOH ↔ NiOH+ + NO3− + H+ + NO3−
Ni2+ + HOH ↔ NiOH+ + H+
Na2SO3 - соль, образованная сильным основанием и слабой кислотой. Гидролизуется по аниону. рН > 7 (щелочная среда).
Na2SO3 + HOH ↔ NaHSO3 + NaOH
2Na+ + SO32− + HOH ↔ Na+ + HSO3− + Na+ + OH−
SO32− + HOH ↔ HSO3− + OH−
172. Напишите выражения для константы равновесия гетерогенной системы
СО2 + С ⇄ 2СО. Как изменится скорость прямой реакции - образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
Решение:

193. Реакция горения метилового спирта выражается термохимическим
уравнением СН3ОН (ж) + 3/2 О2 (г) = СО2 (г) + 2Н2О (ж); ∆Н = ?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота
парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: - 726,5 кДж.
Решение:

214. Какие из карбонатов: ВеСО3, СаСО3 или ВаСО3 - можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив ∆Gо298 реакции. Ответ: + 31,24 кДж; -130,17 кДж; - 216,02 кДж.
Решение:


Ответ: + 31,24 кДж; -130,17 кДж; - 216,02 кДж.
