
- •§ 1.1. Основные газовые законы и их использование при расчетах
- •§ 1.2. Закон эквивалентов и расчеты с его использованием
- •§ 1.3. Простейшие расчеты по формулам и химическим уравнениям
- •§ 2.1. Расчет энергетики химических реакций
- •§ 2.1. Направленность химических реакций Химико-термодинамические расчеты
- •§ 3.1. Скорость химических реакций
§ 3.1. Скорость химических реакций
Скорость химической реакции характеризует изменение концентрации веществ (реагентов и продуктов реакции) во времени. Различают реакции в газовых смесях или растворах (гомогенные реакции) и гетерогенные реакции, когда хотя бы один реагент находится в иной фазе, чем другие (газ-жидкость, твердое тело-жидкость).
Скорость гомогенной реакции измеряется изменением концентрации реагентов (или продуктов) в единицу времени. В гетерогенных реакциях контролируется изменение концентрации газовых или находящихся в растворе компонентов:
![]() .
.
Скорость реакций зависит от природы и концентрации реагирующих веществ, температуры, давления (для газовых реакций), величины поверхности раздела фаз (для гетерогенных реакций), а также от присутствия и количества катализаторов или ингибиторов.
Зависимость скорости реакции от концентрации реагентов выражается законом действия масс - для реакции aA + bB cC :
![]() ,
,
т.е. скорость реакции пропорциональна концентрации реагирующих веществ.
k - фактор пропорциональности, представляет собой удельную скорость реакции (константу скорости), т.е. скорость реакции при единичных концентрациях компонентов A и B. В отличие от скорости реакции константа k не зависит от концентрации растворов и является количественной характеристикой процесса. В гетерогенных реакциях концентрации конденсированных компонентов (твердых тел или несмешивающихся жидкостей) в уравнении закона действия масс не учитываются. Так, скорость реакции
CaO (тв) + H2O (ж) Ca(OH)2
зависит только от площади поверхности твердой CaO и интенсивности перемешивания смеси.
Зависимость константы скорости реакции от температуры описывается уравнением Аррениуса:
![]() ,
,
где Z0 - количество соударений молекул (ионов, атомов) реагентов в секунду в единице объема, p - стерический фактор, показывающий, какая доля всех соударений благоприятна для данной реакции, e - основание натуральных логарифмов, R - газовая постоянная, T - температура (в K), Eакт - энергия активации реакции.
Энергия активации - избыточный запас энергии по отношению к средней энергии молекул реагентов, достаточный для протекания реакции. Любая реакция протекает через образование переходного состояния реакции (активационная стадия) - т.е. состояние, в котором старые связи окончательно не разорвались, а новые еще не образовались:
A
+ B
![]() [A Ч
Ч Ч B]
№
®
C.
[A Ч
Ч Ч B]
№
®
C.
Энергия активации определяется при измерении нескольких констант скорости при разных температурах либо графически из зависимости ln(k)-1/T, либо аналитически из уравнения Аррениуса для каждой пары температур.
Зависимость скорости от температуры для многих реакций подчиняется эмпирическому правилу Вант-Гоффа: при изменении температуры на 10 градусов скорость реакции изменяется в 2 . . . 4 раза, т.е.
 ,
,
где температурный коэффициент g = 2 . . . 4.
Большинство химических процессов в определенных условиях может протекать обратимо:
A
+ B
![]() C + D.
C + D.
В этом случае в системе имеют место как прямая, так и обратная реакции, причем по мере превращения скорость прямой реакции убывает, а обратной - возрастает. При уравнивании обеих скоростей возникает состояние динамического равновесия - количество образовавшихся продуктов реакции (C и D) в единицу времени равно количеству распавшихся на исходные вещества (A и B).
Химическое
равновесие реакции aA + bB
![]() cC
+ dD характеризуется константой равновесия:
cC
+ dD характеризуется константой равновесия:
![]() .
.
В зависимости от необходимости различают Kc (константа равновесия, учитывающая концентрации реагирующих партнеров), Kp (константа, учитывающая парциальные давления газов) и Kf (константа, учитывающая мольные доли компонентов):
 ,
,
 .
.
При этом между Kc, Kp и Kf существует простая связь:
![]() ,
,
![]() ,
,
где Dn - разность между суммой коэффициентов компонентов реакции (Snпрод - Snисх), p0 - общее давление газовой смеси. При Dn =0 (реакция идет без изменения числа молей) Kc=Kp=Kf . В этом случае
![]() .
.
В общем же случае при постоянной температуре
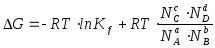 .
.
Примеры решения задач
Задача 3.1.
Как изменится скорость реакции 2A(раствор) + 3B(раствор) ® 4C(раствор) (исходные концентрации [A]=5 моль/л, [B]=6 моль/л) после израсходования 60% компонента A?
Решение: по уравнению реакции на 2 моль A расходуется 3 моля B. Прореагировало 5 Ч 0.6 = 3 моля A. Из пропорции:
2 моля A - 3 моля B,
3 моля A - x молей B
находим x = 4.5 молей B.
Таким образом, в реакционной смеси осталось (5-3)=2 моля A и (6-4.5)=1.5 моля B. В соответствии с законом действия масс начальная скорость реакции
![]() .
.
После того, как прореагировало 60% А:
![]() ,
,
![]() .
.
Таким образом, скорость реакции уменьшится в 400 раз.
Задача 3.2.
Написать выражения закона действия масс для реакций:
1. 2 CO(газ) + O2(газ) ® 2 CO2(газ),
2. CO2(газ) + C(тв) ® 2 CO(газ) ,
3. CaO(тв) + H2O(ж) ® Ca(OH)2(тв) ,
4. NaOH(раствор) + HCl(раствор) ® NaCl(раствор) + H2O(ж) .
Решение: в первой реакции участвуют реагенты в газовом состоянии (система гомогенная), следовательно:
![]() .
.
Вторая реакция проходит в гетерогенных условиях (газ - твердое тело). Так как в химических процессах меняются только концентрации компонентов, находящихся в газовых смесях или в растворах (концентрация несмешивающихся жидкостей, а также твердых компонентов постоянна), выражение закона действия масс для этой реакции
![]() .
.
Реакция CaO + H2O ® Ca(OH)2 гетерогенна: участвуют жидкость (H2O) и твердое тело (CaO), концентрации которых в процессе не изменяются. Следовательно:
![]() .
.
В последнем случае реакция гомогенна (раствор):
![]() .
.
Задача 3.3.
Как изменится скорость реакции 2A(газ)+3B(газ)®C(газ) при повышении давления в 2 раза?
Решение: увеличение давления в газовой реакции связано с уменьшением реакционного объема; при сохранении количества веществ это означает увеличение их концентрации. При увеличении давления в 2 раза концентрация А и В увеличится вдвое. Следовательно:
![]() ,
,
![]() .
.
Скорость реакции увеличится в 32 раза.
Задача 3.4.
Как изменится скорость реакции A(тв)+2B(газ)®3С(тв) при уменьшении давления в 3 раза?
Решение: при уменьшении давления уменьшится концентрация только газового компонента В, т.е. [B] уменьшится втрое.
![]() ,
,
![]() .
.
Скорость реакции уменьшится в 9 раз.
Задача 3.5.
Как изменится скорость реакции 2 A + 3 B ® С при повышении температуры с 40 до 80°С (температурный коэффициент Вант-Гоффа равен 2)?
Решение: в соответствии с правилом Вант-Гоффа
 ;
; 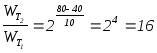 .
.
Скорость реакции повысится в 16 раз.
Задача 3.6.
Как следует изменить температуру, чтобы понизить скорость химической реакции в 1024 раза (g=2)?
Решение:  ;
;
![]() ;
; ![]() ,
,
![]() ;
;
![]() ;
; ![]() .
.
Температуру реакции следует понизить на 100 градусов.
Задача 3.7.
Как изменится скорость реакции 4A(газ)+3B(газ)®3С(газ) при повышении температуры на 35°С и понижении давления в 2 раза? (Температурный коэффициент скорости равен 3).
Решение: при повышении температуры скорость реакции увеличится:
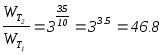 .
.
При понижении давления скорость реакции уменьшится:
 ,
,
![]() ;
; ![]() .
.
Следовательно
![]() .
.
При одновременном изменении давления и температуры скорость реакции составит 0.3656 от исходной.
Задача 3.8.
Найти энергию активации реакции, если при 20°С константа скорости реакции составляет 2,5 Ч 10-2, а при 30°С - 5,0 Ч 10-2 л/м Ч с?
Решение: в соответствии с законом Аррениуса
![]() ;
; ![]() ;
;
![]() ;
;
![]() .
.
Вычтем из второго уравнения первое:
![]() ,
,
![]()
![]() ,
,
![]() 51
134
Дж/моль
=
51.134
кДж/моль.
51
134
Дж/моль
=
51.134
кДж/моль.
Задача 3.9.
В
реакции 2A(газ)+B(газ)
![]() 3С(газ)
равновесные концентрации составляют:
3С(газ)
равновесные концентрации составляют:
[A]=5 моль/л,
[B]= 3 моль/л,
[C]= 4 моль/л.
Найти константу равновесия (Kc).
Решение: ![]() .
.
Задача 3.10.
Найти
константу равновесия (Kp)
реакции 2A(газ)+3B(газ)![]() С(газ),
если после установления равновесия в
смеси содержится 30% А, 20% В и 50% С по объему
при общем давлении 2 атм.
С(газ),
если после установления равновесия в
смеси содержится 30% А, 20% В и 50% С по объему
при общем давлении 2 атм.
Решение:
![]() .
.
Парциальные давления компонентов, учитывая закон Авогадро, составляют:
Pi = Pобщ Ч Cмол = Pобш Ч Cоб.%,
PA = 2 Ч 0.3 = 0.6 атм,
PB = 2 Ч 0.2 = 0.4 атм,
PC = 2 Ч 0.5 = 1.0 атм.
Отсюда:
![]() .
.
Задача 3.11.
Найти
константу равновесия в газовой реакции
2A+5B![]() 3C+D,
если исходные концентрации [A]=5моль/л,
[B]=7моль/л, и к моменту установления
равновесия прореагировало 30% А.
3C+D,
если исходные концентрации [A]=5моль/л,
[B]=7моль/л, и к моменту установления
равновесия прореагировало 30% А.
Решение: к моменту установления равновесия прореагировало 5 Ч 0.3 = 1.5 моль/л компонента А. Найдем количество прореагировавшего компонента В и образовавшихся С и D. По уравнению реакции
-
на 2 моля А расходуется
- 5 молей В;
1.5 моля A
- x молей В;
=>
 ;
;из 2 молей А образуется
- 3 моля С;
1.5 моля A
- y;
=>
 ;
;из 2 молей А образуется
- 1 моль D;
1.5 моля A
- z;
=> z=0.75.
Следовательно, равновесные концентрации реагентов составляют:
[A]равн = 5 - 1.5 = 3.5 моль/л;
[B]равн = 7 - 3.75 = 3.25 моль/л;
[C]равн = 2.25 моль/л;
[D]равн = 0.75 моль/л.
Тогда
![]() .
.
Задача 3.12.
Используя
стандартные значения DH0
и DS0,
рассчитать
константу равновесия реакции N2+3H2![]() 2NH3
при 1000°С.
(Зависимостью DH
и DS
от температуры пренебречь).
2NH3
при 1000°С.
(Зависимостью DH
и DS
от температуры пренебречь).
Решение:
N2(газ)
+
3 H2(газ)
![]() 2
NH3(газ).
2
NH3(газ).
ѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕ
DHобр
(кДж/моль) 0 0 -46
ѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕ
Sобр 192 131 192
(Дж/моль Ч К)
ѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕ
DHр = -92 кДж/моль,
DS = 2 Ч SобрNH3 - SобрN2 - 3 Ч SобрH2 = 2 Ч 192 - 192 - 3 Ч 131 =
= -201 Дж/моль Ч К = -0.201 кДж/моль Ч К,
DG = DH - TDS = -92 + 0.201 Ч 1273 =
= 163.87 кДж/моль,
DG = - RT Ч ln k,
![]() .
.
Константа
равновесия реакции
![]() .
.
Задача 3.13.
При
100°С
константа равновесия реакции A+B![]() 2C
равна 4. Найти равновесные концентрации
А, В и С, если исходные концентрации
[A]0=[B]0
= 2 моль/л.
2C
равна 4. Найти равновесные концентрации
А, В и С, если исходные концентрации
[A]0=[B]0
= 2 моль/л.
Решение:  .
.
Примем [C]равн = x моль/л, тогда количество прореагировавших А и В определяем как x/2 молей и равновесные концентрации [A] и [B] = (2- x/2) моль/л.
Подставив эти величины в выражение константы равновесия, получим
 ,
,
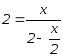 ,
откуда x
= 2.
,
откуда x
= 2.
Следовательно:
[C]равн = 2 моль/л;
[A]равн = [B]равн =(2 - 2/2) = 1 моль/л.

Растворы - это гомогенные системы переменного состава. Для характеристики относительного содержания компонентов растворов используют различные методы выражения концентраций:
Массовые (объемные) проценты (%масс, %об) - процентное содержание растворенного вещества, отнесенного ко всему раствору;
Молярная концентрация (M, моль/л) - количество молей растворенного вещества в 1 л раствора;
Нормальная концентрация (н, моль/л) - количество эквивалентов вещества, содержащихся в 1 л раствора;
Моляльная концентрация (m, моль/кг) - количество молей растворенного вещества, приходящееся на 1 кг растворителя;
Мольная доля (Ni) - количество молей растворенного вещества или растворителя, отнесенное к общей сумме молей.
Связь между свойствами растворов и их концентрацией может быть выражена несколькими уравнениями:
|
Для растворов неэлектролитов: |
|
Для растворов электролитов: |
|
|
1-й закон Рауля |
|
Здесь P0 - давление насыщенного пара над растворителем, P - давление пара над раствором, N2 - мольная доля растворенного вещества, i - изотонический коэффициент.
|
Dtфп = K Ч m |
2-й закон |
Dtфп = i Ч K Ч m |
|
Dtкип = E Ч m |
Рауля |
Dtкип = i Ч E Ч m |
|
Dtкрист = K Ч m |
|
Dtкрист = i Ч K Ч m |
Здесь Dtкип = tкип. раствора - tкип. растворителя,
Dtкрист = tкрист. растворителя - tкрист. раствора,
E - эбулиоскопическая постоянная растворителя,
K - криоскопическая постоянная растворителя.
Осмотический закон Вант-Гоффа
Pосм=C Ч R Ч T; Pосм= i Ч C Ч R Ч T.
где Pосм - осмотическое давление, С - молярная концентрация растворенного вещества, R - газовая постоянная.
Различие между растворами неэлектролитов и электролитов обусловлено присутствием в последних большего числа частиц вследствие электролитической диссоциации молекул растворенного вещества (при одинаковой концентрации обоих растворов).
![]()
![]()
![]() .
.
При
этом
![]() ,где
i=1 для неэлектролитов, i>1 для электролитов.
,где
i=1 для неэлектролитов, i>1 для электролитов.
Между константой диссоциации, степенью диссоциации и изотоническим коэффициентом существуют простые связи:
![]() (для
слабых электролитов
(для
слабых электролитов
![]() ),
),
![]() ,
где N = m + n.
,
где N = m + n.
Вода - лучший растворитель, обладающий высокой ионизирующей способностью, является чрезвычайно слабым электролитом:
H2O
![]() H+
+ HO-,
H+
+ HO-,
а
точнее 2H2O
![]() H3O+
+ HO-.
H3O+
+ HO-.
Степень диссоциации воды » 2 Ч 10-9 при комнатной температуре. Поэтому произведение концентраций ионов воды является постоянной величиной (ионное произведение воды):
KH2O = [H+] Ч [HO-] = 10-14 (при 22°C).
Концентрация ионов водорода H+, а чаще водородный показатель pH=-lg(CH+) используется как мера кислотности среды:
в нейтральной среде [H+]=[HO-]=10-7; pH = 7,
в кислой среде [H+]>[HO-] >10-7; pH < 7,
в щелочной среде [H+]<[HO-] <10-7; pH > 7.
В этих средах [H+]= KH2O / [HO -]=10 -14 / [HO -], pH = 14 - pOH.
Для труднорастворимых сильных электролитов произведение концентраций ионов в растворе (KnAm) при постоянной температуре - величина постоянная (произведение растворимости ПР), качественно указывающая на растворимость этого электролита при данной температуре:
KnAm
![]() nKm+
+ mAn-,
nKm+
+ mAn-,
ПР = [Km+]n Ч [An-]m.
Низкие значения ПР указывают на слабую растворимость электролита. Вещество полностью растворится, если произведение концентраций ионов в растворе меньше ПР, и выпадает в осадок, если это произведение больше ПР.
При растворении солей в воде наряду с диссоциацией молекул на ионы в ряде случаев имеет место обмен ионами между солью и водой (гидролиз солей):
KA
+ H2O
![]() KOH + HA.
KOH + HA.
Учитывая, что в этом равновесном процессе самым слабым электролитом является вода, легко понять невысокие степени гидролиза солей. Степень гидролиза достигает значительных величин лишь в условиях больших разбавлений растворов, при повышенных температурах и малой растворимости продуктов гидролиза.
Рассмотрим несколько примеров гидролиза солей:
А. При гидролизе могут образовываться только сильные кислоты и основания:
K+
+ A-
+ H2O
![]() K+
+ HO-
+ H+
+ A-.
K+
+ HO-
+ H+
+ A-.
Наличие в системе лишь одного слабого электролита (воды) смещает равновесие в сторону исходной соли - гидролиз не идет.
Б. При гидролизе образуется слабое основание и сильная кислота:
K+
+ A-
+ H2O
![]() KOH + H+
+ A-
KOH + H+
+ A-
или
K+
+ H2O
![]() KOH + H+,
KOH + H+,
pH<7.
Следовательно, регулятором гидролиза является образование некоторого количества слабо-диссоциирующего основания и понижение pH среды (среда кислая).
Соли, содержащие многовалентные катионы, образуют при гидролизе основные соли:
ZnCl2
+ H2O
![]() Zn(OH)Cl + HCl,
Zn(OH)Cl + HCl,
Zn2+
+ H2O
![]() (ZnOH)+
+ H+.
(ZnOH)+
+ H+.
Гидролиз по 2-ой стадии
(ZnOH)+
+ H2O
![]() Zn(OH)2
+ H+
Zn(OH)2
+ H+
идет в значительно меньшей степени.
В. При гидролизе образуется сильное основание и слабая кислота:
K+
+ A-
+ H2O
![]() K+
+ HO-
+ HA
K+
+ HO-
+ HA
или
A-
+ H2O
![]() HA + HO-,
HA + HO-,
pH>7.
Результатом гидролиза является образование слабодиссоциированной кислоты и повышение pH среды (среда щелочная).
При гидролизе солей, имеющих многовалентные анионы, образуются кислые соли:
Na2CO3
+ H2O
![]() NaHCO3
+ NaOH,
NaHCO3
+ NaOH,
CO32-
+ H2O
![]() HCO3-
+ HO-.
HCO3-
+ HO-.
Г. При гидролизе образуются слабые основания и кислота:
K+
+ A-
+ H2O
![]() KOH + HA,
KOH + HA,
CH3COONH4
+ H2O
![]() CH3COOH
+ NH4OH.
CH3COOH
+ NH4OH.
Уксусная кислота (CH3COOH) и гидроксид аммония (NH4OH) - слабые электролиты, поэтому глубина гидролиза в данном случае может быть выше, чем в ранее рассмотренных случаях (Б, В), но pH среды, определяющийся относительной силой образующихся кислоты и основания, близок к нейтральному.
Таким образом, увеличению степени гидролиза способствует разбавление раствора и повышение температуры. Снижение гидролиза может быть достигнуто повышением концентрации соли в растворе, снижением температуры и добавлением к раствору сильных кислот (Б) или оснований (В).
Примеры решения задач
Задача 4.1.
Найти количество воды и NaNO3, необходимые для приготовления 2 л 22% раствора (d=1.14 г/мл).
Решение: масса 2 л раствора составляет 2 Ч 1.14 = 2.28 кг. Следовательно:
|
22 г NaNO3 |
- |
100 г раствора, |
|
х г |
- |
2280 г. |
х = 501.6 г NaNO3.
Отсюда масса воды mH2O = 2280 - 501.6 = 1778.4 г.
Задача 4.2.
Рассчитать мольную долю, молярную, нормальную и моляльную концентрацию 78% раствора H2SO4 (d=1.70 кг/дм3).
Решение: прежде чем решать задачу, проанализируем ее исходные данные: по условиям 78 г H2SO4 (78/98=0.796 молей) содержится в 100 г (100/1.7=58.8мл) раствора, т.е. на 0.796 молей H2SO4 приходится (100-78)/18=1.222 моля H2O.
Таким образом, мольная доля H2SO4:
 =
0.796 / (0.796 + 1.222) = 0.3944.
=
0.796 / (0.796 + 1.222) = 0.3944.
Моляльная концентрация (количество молей вещества на 1000 г растворителя):
|
0.796 молей H2SO4 |
- |
22 г H2O, |
|
m |
- |
1000 г. |
m = (0.796 Ч 1000)/22 = 36.18 моль/кг.
Молярная концентрация (количество молей вещества в 1 л раствора):
|
0.796 молей H2SO4 |
- |
58.8 мл раствора, |
|
М |
- |
1000 мл. |
M = (0.796 Ч 1000)/58.8 = 13.5 моль/л.
Так как эквивалент H2SO4 составляет 1/2 моля, то
N = 2 Ч M = 2 Ч 13.5 = 27 моль/л.
Задача 4.3.
Какое количество 45.5% KOH (d=1.46 г/см3) потребуется для полной нейтрализации 0.5 л 2н серной кислоты?
Решение: в 0.5 л 2н H2SO4 содержится 1 эквивалент (0.5 моля) кислоты, следовательно, для ее нейтрализации потребуется 1 эквивалент (1 моль) щелочи.
В 100 г раствора KOH (100 : 1.46 = 68.5 мл) содержится 45.5 г (45.5/56 = 0.8125 моля) KOH. Составим пропорцию:
|
0.8125 моля KOH |
- |
685 мл раствора, |
|
1 моль |
- |
х мл. |
Таким образом, объем щелочи составляет
(68.5 Ч 1) : 0.8125 = 84.3 мл.
Задача 4.4.
Рассчитать давление пара раствора, содержащего 100 г сахарозы C12H22O11 в 800 мл воды, если давление насыщенных паров воды при температуре 25°С составляет 3.167 кПа.
Решение: согласно закону Рауля давление пара над раствором составляет P1 = NH2OPH2O, где P1 - давление пара над раствором, PH2O - давление пара над чистым растворителем, а NH2O - мольная доля растворителя в растворе.
MC12H22O11 = 342 г/моль
MH2O = 18 г/моль
Следовательно:
 .
.
Поэтому давление паров воды над раствором
P1 = N1 Ч P0 = 0.9935 Ч 3.167 = 3.146 кПа = 3146 Па.
Задача 4.5.
Найти температуру кипения и замерзания 20% раствора фенола (C6H5OH) в воде.
Решение: согласно закону Рауля Dtкип = E Ч m,
Dtзам = K Ч m,
где m - моляльная концентрация.
KH2O=1.86°C,
EH2O=0.52°C.
Найдем моляльную концентрацию раствора:
|
20 г фенола C6H5OH (m/M=20/94=0.2128 моля) |
|
содержится в 80 мл воды, |
|
x молей |
- |
в 1000 мл |
Из этой пропорции: x = 0.2128 Ч 1000/80=2.66 моль/кг.
Следовательно: Dtкип = 0.52 Ч 2.66 = 1.38°C,
Dtзам = 1.86 Ч 2.66 = 4.95°C.
Таким образом, температура кипения раствора 101.38°C, а температура замерзания - 4.95°C.
Задача 4.6.
Найти осмотическое давление раствора, в 1.5 л которого содержится 300 г глюкозы (C6H12O6), при 25°C.
Решение: согласно закону Вант-Гоффа Pосм = C Ч RT. Молярная концентрация раствора составляет (молекулярная масса глюкозы = 180):
C = 300 / 1.5 Ч 180 = 1.11 кмоль/м3.
Следовательно, Pосм = 1.11 Ч 8.314 Ч 298 = 2753 кПа.
Задача 4.7.
Найти процентную концентрацию раствора глюкозы, замерзающего при -5°C.
Решение: Dtзам = K Ч m,
m = Dtзам / K = 5/1.86 = 2.6882 моль/кг.
Таким образом, на 1000 г воды в растворе приходится 2.6882 Ч Mгл = 2.6882 Ч 180 = 483.9 г глюкозы.
Следовательно:
|
в (483.9 г глюкозы + 1000 г воды) т.е. в 1483.9 г раствора |
|
содержится 483.9 г глюкозы, |
|
100 г |
- |
x. |
x = (483.9 Ч 100) / 1483.9 = 32.6%.
Задача 4.8.
Рассчитать объемы воды и этиленгликоля (C2H6O2, M=62 г/моль, d=1.1088 г/см3), необходимые для получения 5 л антифриза (d=1.0713 кг/дм3), замерзающего при-40°С.
Решение: Dt = K Ч m,
m = Dt / K = 40/1.86 = 21.5 моль/кг.
Следовательно, на 1 кг воды в антифризе приходится 21.5 Ч 62 = 1333 г этиленгликоля.
Масса 5 л антифриза составляет 5 Ч 1.0713 = 5.356 кг. Следовательно:
|
в (1000 + 1333), т.е. в 2333 г антифриза |
|
содержится 1333 г этиленгликоля, |
|
5356 г |
- |
x. |
x =(5356 Ч 1333) / 2333 = 3077 г = 3.077 кг,
масса воды 5356 - 3077 = 2279 г = 2.279 кг.
Таким образом, для получения 5 л антифриза потребуется 3.077 : 1.1088=2.775 л этилен-гликоля и 2.279 л воды.
Задача 4.9.
Раствор 1 г нитробензола в 65 г бензола застывает при 4.86°С. Температура кристаллизации бензола 5.5°С, К=5.12°С. Рассчитать молекулярную массу нитробензола.
Решение:
|
1 г нитробензола |
|
растворен в 65 г бензола, |
|
х |
- |
в 1000 г. |
x = 1000/65 = 15.38 г.
Dtкр = 5.5 - 4.86 = 0.64°С = K Ч m = 5.12 Ч m.
Отсюда m = 0.64 / 5.12 = 0.125 моль/кг.
Следовательно, 15.38 г нитробензола составляют 0.125 моля и M = 15.38/0.125 = 123 г/моль, что действительно соответствует формуле C6H5NO2.
Задача 4.10.
Рассчитать кажущуюся степень диссоциации Na2CO3 в растворе, если при растворении 1.06 г его в 200 мл воды температура кипения повысилась на 0.062°С.
Решение:
Na2CO3 - электролит. По закону Рауля Dtкип=iЧEЧm. Находим моляльную концентрацию раствора:
|
1.06г (1.06/106=0.01моля) Na2CO3 |
|
растворено в 200г H2O, |
|
m |
- |
в 1000 г. |
m = (0.01 Ч 1000) / 200 = 0.05 моль/кг.
Тогда изотонический коэффициент
![]() .
.
![]() .
.
Задача 4.11.
Рассчитать процентную концентрацию раствора KOH, если он замерзает при -0.519°С. Степень диссоциации щелочи в растворе 0.86.
Решение: ![]() ,
,
i = a + 1 = 0.86 + 1 = 1.86,
Dt=0-(-0.519)=0.519.
По закону Рауля Dtзам = i Ч K Ч m, отсюда:
m = Dtзам / i Ч K = 0.519 / (1.86 Ч 1.86) = 0.15 моль/кг.
Составим пропорцию:
|
0.15 моля, т.е. 0.15 Ч 56=8.4 г KOH |
|
содержится в (1000+8.4) г раствора, |
|
x |
- |
в 100 г. |
x = (8.4 Ч 100) / 1008.4 = 0.833 г.
В 100 г раствора содержится 0.833 г KOH, т.е. процентная концентрация раствора равна 0.833%.
Задача 4.12.
Произведение растворимости AgBr составляет 5.3Ч10-13 при 25°С. Вычислить растворимость соли (моль/л) при данной температуре.
Решение: обозначим растворимость AgBr за S моль/л. Тогда концентрации [Ag+]=[Br-]=S моль/л. Следовательно, ПР = 5.3 Ч 10-13 = S2, и отсюда:
![]() =
7.28
Ч
10-7
моль/л.
=
7.28
Ч
10-7
моль/л.
Задача 4.13.
Возможно ли получение 0.001% раствора Ba3(PO4)2 (м.м.=538) при комнатной температуре?
ПРBa3(PO4)2 = 6 Ч 10-39.
Решение: если принять концентрацию соли за S моль/л, то [Ba2+]=3S, [PO43-]=2S.
ПР = 6 Ч 10-39 = [Ba2+]3 Ч [PO43-]2 = (3S)3 Ч (2S)2 = 108 Ч S5,
![]() моль/л
моль/л
Таким образом, в 1 л раствора (плотность его можно принять за 1 г/см3) содержится
8.89 Ч 10-9 Ч M = 8.89 Ч 10-9 Ч 538 =4.783 Ч 10-6 г.
Следовательно, концентрация насыщенного раствора не может быть больше чем
|
4.783 Ч 10-6 |
- |
в 1000 г раствора, |
|
x |
- |
в 100 г. |
x = 4.783 Ч 10-7%.
Задача 4.14.
Насыщенный раствор BaCrO4 при некоторой температуре содержит 3.8 Ч 10-4% соли. Рассчитать ПРBaCrO4.
Решение: в 100 г раствора, плотность которого можно принять за 1 г/см3, содержится 3.8 Ч 10-4 г соли. В 1 л раствора содержится 3.8 Ч 10-3 г соли. То есть концентрация соли (м.м. BaCrO4 =253) составит:
3.8 Ч 10-3 / 253 = 1.5 Ч 10-5 моль/л,
ПР = [Ba2+] Ч [CrO42-]= (1.5 Ч 10-5)2 = 2.25 Ч 10-10.
Задача 4.15.
Образуется ли осадок Ag2SO4, если к 0.01М раствору AgNO3 добавить равный объем 0.25М раствора K2SO4? (ПРAg2SO4 = 2 Ч 10-5)
Решение: при смешивании растворов концентрации растворов уменьшаются вдвое. Следовательно, [Ag+]=0.005 моль/л, [SO42-]=0.125 моль/л. Тогда
[Ag+]2 Ч [SO42-]= (0.005)2 Ч (0.125) = 3.125 Ч 10-6.
3.125 Ч 10-6 < ПР=2 Ч 10-5, поэтому осадок не образуется.

Под химическими источниками тока (ХИТ) подразумевают устройства, в которых химическая энергия гетерогенных окислительно-восстановительных реакций, происходящих на поверхности электродов, может быть преобразована в электрическую энергию. Электрод, на поверхности которого происходит восстановление, называют катодом; электрод, на поверхности которого происходит окисление, называют анодом.
В основе работы таких устройств лежат явления, происходящие на границе раздела между металлом и раствором (расплавом) электролита, связанные с возникновением скачка потенциала (электродного потенциала). Электродный потенциал (j) зависит от природы металла, активности (концентрации) катионов металла в растворе (расплаве) и температуры. Электродный потенциал при стандартных условиях, т.е. при активности (концентрации) катионов металла 1 моль/л и температуре 298 К называют стандартным (j0). Стандартные электродные потенциалы, измеренные относительно эталонного водородного электрода, сведены в ряд напряжений. Потенциал водородного электрода (Pt, H2/H2SO4) при стандартных условиях принят за нуль.
Электродные потенциалы любых окислительно-восстановительных систем (редокс-потенциалы) можно рассчитать по уравнению Нернста:
![]() ,
,
где j0 - стандартный потенциал (В), R - универсальная газовая постоянная (ДжЧмоль-1ЧК-1), n - число электронов, участвующих в окислительно-восстановительном процессе, Т - температура (К), F - постоянная Фарадея (Кл), [Ox] - концентрация окисленной формы, [Red] - концентрация восстановленной формы.
Подставив значения постоянных (R=8.314, T=298, F=96500) и приведя натуральные логарифмы к десятичным, получим
![]() ,
,
а для системы «металл-раствор соли металла»:
![]() .
.
Движущей силой любой химической реакции является уменьшение свободной энергии Гиббса (DG), определяющей максимальную работу реакции. Максимальную работу ХИТ совершает в условиях равновесной реакции, которая возможна только при нулевой силе тока (I=0). В этих условиях
DG = -Amax = Q Ч Umax = Q Ч E,
где Q - количество электричества, U ‑ напряжение, E - электродвижущая сила ХИТ (ЭДС). То есть
DG = - n Ч F Ч E, или в стандартных условиях DG0 = - n Ч F Ч E 0.
Таким образом, ЭДС - разность потенциалов ХИТ, измеряемая компенсационным путем в условиях равновесных электродных процессов (I=0 А). Отсюда E > 0, поэтому расчет ЭДС гальванической системы ведут по схеме
E = jкатода - jанода
(катод - электрод с бóльшим значением j, анод - с мéньшим). Например, для системы, состоящей из металлов А и В, опущенных в растворы их солей:

 MeA
| соль MeA
|| соль MeB
| MeB
MeA
| соль MeA
|| соль MeB
| MeB
jMeB > jMeA; MeA - анод, MeB - катод.
Электродные процессы в ХИТ:
К: MeBn+ + n e- ѕ® MeB,
А: MeA - m e- ѕ® MeAm+.
При этом количество электронов, участвующих в катодном и анодном процессах, должно быть одинаковым.
Электролизом называют совокупность процессов, происходящих при прохождении постоянного электрического тока через расплав или раствор электролита. Восстановительные (катодные) и окислительные (анодные) процессы происходят в соответствии с величиной электродного потенциала.
На катоде легче восстанавливаются частицы с бóльшим электродным потенциалом, на аноде легче окисляются частицы с мéньшим электродным потенциалом.
При определении процессов, протекающих на катоде при электролизе водных растворов, следует помнить:
1. Легко восстанавливаются ионы металлов с положительными значениями электродных потенциалов.
2. Ионы металлов с умеренно отрицательными значениями потенциалов (Zn2+, Fe2+, Cd2+, Ni2+ и другие) восстанавливаются одновременно с восстановлением ионов водорода (в кислой среде) или воды (в нейтральной или щелочной среде):
2H+ + 2e- ѕ® H2,
2H2O + 2e- ѕ® H2 + 2OH-.
3. Ионы металлов с высокоотрицательными значениями электродных потенциалов (j < -1.66 В, то есть от Li+ до Al3+ в ряду напряжений) ни при каких условиях не восстанавливаются при электролизе водных растворов.
При определении анодных процессов следует помнить:
1. При использовании металлических анодов (металлы с j0 < 0.8 В) окисляется материал анода:
Me0 - n e- ѕ® Men+.
2. На инертных электродах при электролизе водных растворов легко окисляются одноатомные бескислородные анионы (кроме F-).
3. Кислородсодержащие анионы при электролизе водных растворов практически не окисляются. В этих случаях идет окисление воды:
2H2O - 4 e- ѕ® O2 + 4H+.
Количественно процессы электролиза описываются законом Фарадея: количество вещества, претерпевающего превращения при электролизе, пропорционально количеству прошедшего через электролит электричества.
m
=
k
Ч Q
или
![]() (для
любых веществ),
(для
любых веществ),
![]() (для
газообразных веществ),
(для
газообразных веществ),
где m и V - масса и объем, I - сила тока, t - время, F - постоянная Фарадея (96500 Кл или 26.8 АЧчас), mэкв и Vэкв - эквивалентная масса и объем данного вещества. При пропускании 96500 Кл или 26.8 АЧчаса электричества превращается 1 эквивалент вещества.
Отношение экв/F называют электрохимическим эквивалентом, т.е. оно характеризует количество вещества, превращающегося при пропускании 1 Кл (АЧс) или 1 АЧчаса электричества.
В условиях реального электролиза закон Фарадея в приведенной форме не выполняется, поэтому вводят поправку на выход по току:
![]() ,
,
где h -эмпирическая величина (в % или долях от 1), характеризующая неидеальность процесса:
![]() %.
%.
Для расчета расхода электроэнергии используют уравнение
W = Q Ч U,
где Q - количество электричества, U - напряжение в сети, В. При расчете нужно помнить, что 1 А Ч с Ч В=1Вт Ч с, поэтому
![]() .
.
Примеры решения задач
Задача 5.1.
Рассчитать электродный потенциал системы Cu | CuSO4 (0.01 М).
Решение: расчет проводим по уравнению
j = j0+(RT/nF) lg(CMen+) = j0+(0.059/n) lg(CCu2+),
j0Cu2+=0.338; n=2,
j = 0.338 + (0.059/2) lg(10-2) = 0.279 В.
Задача 5.2.
Рассчитать электродный потенциал водородного электрода при pH=2, 7, 14.
Решение:
j = j0+(0.059/n) lg CMen+ =
= j0H+/H + 0.059 lg CH+=
= 0 + 0.059 lg CH+ =
= -0.059 pH,
т.к. pH=-lg(CH+).
Отсюда jpH=2 = -2 Ч 0.059 = -0.118 В,
jpH=7 = -7 Ч 0.059 = -0.413 В,
jpH=14= -14 Ч 0.059 = -0.826 В.
Задача 5.3.
Рассчитать электродный потенциал системы Pt,H2|H2S (С=0.01 моль/л, КД(1)=6Ч10-8).
Решение: для расчета потенциала этого водородного электрода необходимо найти концентрацию ионов водорода в растворе (или pH). H2S - слабый электролит:
H2S
![]() H+
+ HS-.
H+
+ HS-.
![]() .
.
Следовательно, [H+] = aC = 2.45 Ч 10-3 Ч 0.01 = 2.45 Ч 10-5.
pH = - lg CH+ = - lg 2.45 Ч 10-5 = 4.61;
j = -0.059 pH = -0.059 Ч 4.61 = -0.272 В.
Задача 5.4.
Рассчитать потенциал водородного электрода Pt,H2|NaOH (С=0.01 моль/л).
Решение: для расчета pH раствора используем ионное произведение воды:
NaOH
![]() Na+
+ HO-,
Na+
+ HO-,
[HO-] = [NaOH] = 0.1 М.
Следовательно, [H+]=KH2O/[HO-]=10-14/0.1=10-13.
pH=-lg(CH+) = 13;
j = -0.059 pH = -0.059 Ч 13 = -0.767 В.
Задача 5.5.
Определить ЭДС гальванического элемента
Zn | ZnSO4 || Fe(NO3)3 | Fe
0.01 моль/л 0.1 моль/л
и привести схему электродных процессов.
Решение:
jZn|Zn2+ = -0.763 + lg(0.01) Ч 0.059/2 = -0.822 В,
jFe|Fe3+ = -0.037 + lg(0.1) Ч 0.059/3 = -0.057 В.
jFe|Fe3+ > jZn|Zn2+ , следовательно, железный электрод является катодом, а цинковый - анодом.
К: 2Fe3+ + 6e ѕ® 2Fe.
А: 3Zn - 6e ѕ® 3Zn2+.
E = jК - jА = -0.057 - (-0.822) = 0.765 В.
Задача 5.6.
Определить ЭДС концентрационного элемента и привести схему электродных процессов:
Cr | Cr2SO4 || CrCl2 | Cr
0.1 моль/л 0.001 моль/л
Решение:
j1 = -0.91 + lg(0.1) Ч 0.059/2 = -0.9395 В,
j2 = -0.91 + lg(0.01) Ч 0.059/2 = -0.9985 В.
Следовательно, катодом является электрод , а анодом - электрод .
К (электрод ): Cr2++ 2e ѕ® Cr.
А (электрод ): Cr - 2e ѕ® Cr2+.
E = j1 - j2 = 0.059 В.
Задача 5.7.
Определить ЭДС и написать электродные процессы в гальваническом элементе:
H2(Pt) | HCl || NaOH | (Pt)H2
0.1 моль/л 0.01 моль/л
Решение:
jH|H+ = -0.059 pH.
В сильной кислоте [H+]=0.1, т.е. pH=1, следовательно, jH|H+ = -0.059 В.
В щелочи [HO-]=0.01 м/л, значит, [H+]= 10-14/0.01 = 10-12 и pH=12.
Следовательно, потенциал этого электрода:
j = -0.059 Ч 12 = -0.708 В.
Отсюда:
E = -0.059 - (-0.708) = 0.649 В.
К: 2H++ 2e ѕ® H2 (электрод с HCl).
А: H2 - 2e ѕ® 2H+ (электрод с NaOH).
Задача 5.8.
Найти концентрацию (моль/л) FeCl2 в гальваническом элементе:
Mn | MnSO4 || FeCl2 | Fe,
0.01 моль/л x моль/л
если ЭДС элемента составляет 0.7215 В.
Решение:
jMn|Mn2+ = -1.192 + lg(0.01) Ч 0.059/2 = -1.251 В.
0.7215 = jFe|Fe2+ - (-1.251), значит jFe|Fe2+=-0.5295 В.
jFe|Fe2+ = -0.441 + lg(x) Ч 0.059/2 = -0.5295 В.
Следовательно, lg x = (-0.5295+0.441)/0.0295 = -3.
Поэтому [FeCl2] = 0.001 моль/л.
Задача 5.9.
Определить количество алюминия, которое можно получить при электролизе Al2O3 током 25А в течение 24 часов при выходе по току 88%.
Решение: учитывая, что при пропускании 26.8 АЧчаса (1F) электричества можно получить 1 экв. алюминия (9 г), составим пропорцию:
|
26.8 А Ч ч |
- |
9 г Al, |
|
25 А Ч 24часа |
- |
х г Al, |
откуда х = 25 Ч 24 Ч 9 / 26.8 = 201.5 г.
Однако из-за 88% выхода по току практически получаемое количество Al составит
mAl = 201.5 Ч 0.88 = 177.3 г.
Задача 5.10.
Определить время, которое потребуется для получения 100 л водорода (н.у.) электролизом раствора NaOH током 3А при выходе по току 75%.
Решение: 1 F (26.8 А Ч ч) расходуется на получение 1 экв. водорода (11.2 л), следовательно:
|
26.8 А Ч ч |
- |
11.2 л, |
|
3 А Ч t |
- |
100, |
откуда t = (26.8 × 100)/(3 × 11.2) = 79.8 часа.
Практически же потребуется из-за 75% выхода по току
tпр = t / 0.75 = 106.3 часа.
Задача 5.11.
Ток силой 10 А пропускали через 0.5 кг 5%-го раствора NaOH. Через сколько часов концентрация раствора увеличится вдвое? Выход по току считать 100%.
Решение: при электролизе водного раствора щелочи происходит разложение воды с выделением водорода на катоде и кислорода на аноде. Следовательно, концентрация щелочи по ходу электролиза возрастает. Количество NaOH в растворе постоянно и равно 0.05 × 500=25 г. Обозначим убыль воды за х грамм. Тогда масса раствора составит (500-х) г. Следовательно, в 10% растворе щелочи:
25 / (500-х) = 0.1
25 = 50 - 0.1 × х
0.1 × х = 25
х = 250 г.
То есть чтобы вдвое увеличить концентрацию щелочи в растворе, необходимо разложить 250 г воды.
Найдем время t, за которое пройдет разложение этого количества воды из пропорции
|
26.8 А Ч ч |
- |
9 г (1 экв.) воды, |
|
10 А Ч t |
- |
250. |
Отсюда t = (26.8 × 250)/(10 × 9) = 74.4 часа.
Задача 5.12.
Определить объем кислорода (н.у.), который можно получить, затратив 100 кВт × ч электроэнергии при напряжении в сети 10 В и выходе по току 79%.
Решение: известно, что количество электроэнергии (W) и количество электричества (Q) связаны уравнением:
W = Q × U
100 кВт × ч = 100 000 Вт × ч = Q × 10 В
Q = 100 000 / 10 = 10 000 А × час
Отсюда:
|
26.8 А Ч ч (1 F) |
- |
5.6 л (1 экв.) кислорода (н.у.) |
|
10 000 А Ч ч |
- |
х л |
Из этой пропорции находим х = (10000 × 5.6)/26.8 = 2089.6 л.
С учетом выхода по току количество кислорода, которое можно получить при этих условиях,
Vкисл = 2086.6 × 0.79 = 1650.7 л.
Задача 5.13.
Укажите наиболее коррозионно-опасный контакт металлов:
Cu/Fe, Cr/Co, Mg/Ni
Решение: в одинаковых условиях скорость коррозии пропорциональна разности потенциалов металлов в контакте (ЭДС элемента).
-
Cu/Fe
Cr/Co
Mg/Ni
j0, В
0.338
- 0.441
- 0.91
- 0.234
- 2.37
- 0.25
E, В
0.779
0.676
2.12
Следовательно, наиболее коррозионно-опасным является контакт Mg/Ni.
Задача 5.14.
Укажите катодные (опасные) и анодные (неопасные) покрытия железа:
Sn/Fe, Cu/ Fe, Cr/ Fe
Решение: катодным для железа является покрытие металлом, имеющим больший электродный потенциал, т.е. в гальванической паре с железом металл покрытия должен выполнять катодные функции (анод - железо). Такие покрытия опасны - при повреждении покрытия развивается подповерхностная коррозия (разрушение железа под покрытием). Анодным является покрытие железа более активным металлом, имеющим более низкий электродный потенциал. Металл такого покрытия выполняет роль анода. В приведенных примерах:
|
Sn/Fe |
Cu/Fe |
Cr/Fe | |||
|
- 0.14 |
- 0.441 |
+ 0.338 |
- 0.441 |
- 0.91 |
- 0.441 |
Покрытия оловом и медью являются катодными, хромом - анодным.
Задача 5.15.
Напишите электродные процессы при коррозии для контактов:
Fe/Zn в HClразб,
Fe/Sn во влажном воздухе,
Cu/Zn в серной кислоте.
Решение:
1. В паре Fe-0.441/Zn-0.763 анодом является цинк, следовательно:
|
А: |
Zn - 2e |
¾® |
Zn2+, |
|
К: |
2H+ + 2e |
¾® |
H2. |
2. В паре Fe-0.441/Sn-0.14 анодом является железо, следовательно:
|
А: |
2Fe - 4e |
¾® |
2Fe2+, |
|
К: |
O2 + 2H2O + 4e |
¾® |
4HO-. |
3. В паре Cu+0.338/Zn-0.763 анодом является цинк, следовательно:
|
А: |
2Zn - 4e |
¾® |
2Zn2+, |
|
К: |
O2 + 4H+ + 4e |
¾® |
2H2O. |
Задачи и упражнения
по общей химии
Сергей Петрович Коршунов
Валентина Михайловна Казанцева
Редактор Н.А. Фомичева
Подписано в печать 5.10.98. Печать оперативная. Усл. п.л. 2,5. Уч.-изд. л. 2,3. Тираж экз. Заказ № .
Тольяттинский политехнический институт
Тольятти, ул. Белорусская, 14
