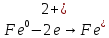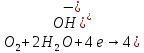Никель
.docxМИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«МОСКОВСКИЙ АВИАЦИОННЫЙ ИНСТИТУТ (национальный исследовательский университет)» (МАИ)
Институт №2
«Аэрокосмические конструкции, технологии и системы управления»
Кафедра
«Общая химия, физика и химия композиционных материалов»
РЕФЕРАТ
НИКЕЛЬ
по дисциплине
«ОБЩАЯ ХИМИЯ»
Студент:
Фамилия И.О.
Группа:
Полный номер группы
Преподаватель: Ряховская Е.В.
Фамилия И.О.
Отметка о выполнении (защиты) работы
Дата (защиты работы)
Москва 2016
СОДЕРЖАНИЕ:
Введение 3
Положение металла в периодической системе Д.И.Менделеева 3
Проявляемые металлом степени окисления в его соединениях 3
Местоположение металла в электрохимическом ряду напряжений металлов 4
Оценка восстановительной активности металла и окислительно-восстановительной способности его соединений 4
Поведение металла в компактном состоянии в различных средах 4
а)В атмосфере сухого воздуха 4
б) В воде 5
в)Взаимодействие с неокислительными кислотами 5
г)Взаимодействие с окислительными кислотами 6
д)Взаимодействие с растворами и расплавами щелочей 7
Возможные процессы электрохимической коррозии 8
а)Выявить анодный и катодный участники 8
б)написать уравнения частных анодных и катодных реакций 8
в)ЭДС коррозии 8
г)Итоговый процесс 8
Введение
Никель — элемент десятой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28. Обозначается символом Ni. Простое вещество никель : — это пластичный, ковкий,переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен.
Применяется: Никель является основой большинства супер сплавов — жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок. Производство железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов. Во многих химико-технологических процессах в качестве катализатора используется никель Ренея. Также никель используется для производства обмотки струн музыкальных инструментов.
Положение металла в периодической системе Д.И.Менделеева
Никель — элемент десятой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28.
Проявляемые металлом степени окисления в его соединениях
Никель образует соединения со степенью окисления +1, +2, +3 и +4. При этом соединения никеля со степенью окисления +4 редкие и неустойчивые
Местоположение металла в электрохимическом ряду напряжений металлов
Электрохимический ряд активности металлов характеризует сравнительную активность металлов в окислительно восстановительных реакциях в водных растворах. Ni расположен между кобальтом и теллуром, слева от водорода что означает что он имеет восстановительную способность.

Оценка восстановительной активности металла и окислительно-восстановительной способности его соединений
Исходя из написанного в пунктах можно сделать вывод, что никель обладает высокими восстановительными способностями
Поведение металла в компактном состоянии в различных средах
-
В атмосфере сухого воздуха
По
соотношению Пиллинга и Бедвортса
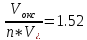 .
Следовательно на поверхности металла
образуется сплошная и плотная пленка
предохраняющая металл от дальнейшего
окисления.
.
Следовательно на поверхности металла
образуется сплошная и плотная пленка
предохраняющая металл от дальнейшего
окисления.
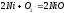
-
В воде
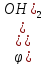
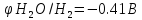

 E<0=>реакция
не протекает
E<0=>реакция
не протекает
-
Взаимодействие с неокислительными кислотами
φNi2+/Ni=-0,25B
φ =-0.059PH=-0.059*3=-0.177B
φNi2+/Ni<φ
=-0.059PH=-0.059*3=-0.177B
φNi2+/Ni<φ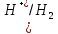 Значит реакция возможна
Значит реакция возможна

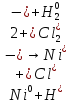
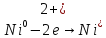 │1
│1
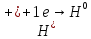 │2
│2

φNi2+/Ni=-0,25B
φ =-0.177B
φNi2+/Ni<φ
=-0.177B
φNi2+/Ni<φ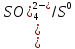 Значит реакция возможна
Значит реакция возможна


 │1
│1
 │2
│2
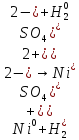
-
Взаимодействие с окислительными кислотами
φNi2+/Ni=-0,25B
φ =0.8В
φNi2+/Ni<
φ
=0.8В
φNi2+/Ni<
φ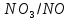 Значит реакция возможна
Значит реакция возможна


 │1
│1
 │2
│2
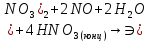
φNi2+/Ni=-0,25B
φ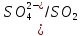 =
φNi2+/Ni<
φ
=
φNi2+/Ni<
φ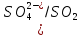 Значит реакция возможна
Значит реакция возможна

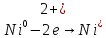 │1
│1
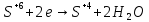 │1
│1
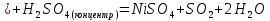
-
 Взаимодействие
с растворами и расплавами щелочей
Взаимодействие
с растворами и расплавами щелочей
В растворах щелочей: -0,25>-0,83B, следовательно металл устойчив к растворам щелочей.
С расплавами щелочей реакция также не идет.
Возможные процессы электрохимической коррозии
а)Выявить анодный и катодный участники
φNi2+/Ni=-0,339B=>катод φFe2+/Fe=-0,44B=>анод
б)написать уравнения частных анодных и катодных реакций






(А)
Fe│H2O,O2
│Ni
(К)
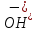
|
Анодный процесс |
Катодный процесс |
|
φFe2+/Fe=-0,44B=>анод |
φNi2+/Ni=-0,339B=>катод |
|
|
|
в)ЭДС коррозии
φk=φ =1.23-0.059*7=0.817B
φa=
φNi2+/Ni=-0.339B
=1.23-0.059*7=0.817B
φa=
φNi2+/Ni=-0.339B
 =
φк-φа=0,817+0,339=1,156В>0=>коррозия
возможна
=
φк-φа=0,817+0,339=1,156В>0=>коррозия
возможна
г)Итоговый процесс