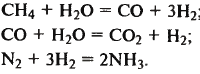Шпаргалки 2017
.docx|
Задачи синтеза ХТС: определить элементный состав ХТС для переработки сырья в продукты, структуру связей между элементами ХТС, обеспечивающими последовательность стадий ХТП и функцион-е системы, режимы отдельных элементов и системы в целом. Задачи анализа ХТС: Анализ ХТС заключается в получении сведений о состоянии ХТС, показа-телях ее эффективности и функции-онировании системы, а также о влиянии на эти данные химической схемы, стр-ры технологических связей, свойств и состояния элементов и подсистем, условий эксплуатации. Фактически анализ ХТС — получение показателей химического произ-водства и химико-технол.процесса. Эвристический принцип – позволяет специалистам при технол.проек-тировании химич. производств интуитивно выбирать удачные варианты решения задачи, без полного перебора возможных альтернативных вариантов. Принятие решения проис-т без обоснования его с помощью доказательств, что не снижает его ценности, так как проектант использует предлагаемые факторы и правила, (эвристики), учитывающие основные закономерности протекания процесса. К эвристикам относятся и теоретические знания, полученные исполнителем в процессе обучения, и частные рекомендации коллег, и даже его интуитивные предположения по лучшей организации производства. На основе эвристик составляется схема, которая может быть близка к оптимальной. Часто эвристики служат ограничениями при выборе варианта схемы, иногда используются совокупно с учетом их противоречивости и альтернативности. Недостатки: отсутствие теоретического обоснования эвристик, их противоречивость, отсутствие связи с отдельными свойствами рабочей среды. Эволюционный принцип – составляется некоторая произвольная схема при явном недостатке эвристик. Далее выбирается наиболее подходящий критерий эффективности и, руководствуясь им, осуществляется поиск и замена наименее эффективного блока. Корректируется структура схемы и процесс повторяется. Число таких итераций может быть любым до достижения заданной оптимальности.
Синтез оптимальной схемы теплообмена. Эвристич. правила: Для выбора структуры системы: 1) использовать для ТО горячий поток с максимальной начальной темп-рой и холодный — с максим. конечной; в противном случае труднее будет нагреть холодный поток; 2) исполь-зовать для ТО горячий и холодный потоки с наиболее высокими температурами. Для выбора теплообменников: 3) выбирать противоточные ТО как более эффективные; 4) проводить ТО до тех пор, пока разность темп-р не достигнет миним. допустимой ΔTmin; в противном случае резко возрастает размер ТО; 5) передавать макс. возж. кол-во тепла – оно опр-ся полным охл-м (нагревом) одного из потоков или достиж-м ΔTmin. Определение оптим. схемы:
Синтез оптимальной системы разделения многокомпонентной смеси. Пусть требуется разделить рек-тификацией смесь N комп-в. Для этого необходима N—1 колонна. Правила: 1) Разделять по порядку темп-р кипе-ния комп-в. В противном случае из-за скачков темп-р между колоннами пот-ребуются больщие затраты то на нагрев, то на охлаждение. 2) Отделять в первую очередь избыточный комп-т. Тогда последующие разделения будут с меньшими потоками и затратами. 3) Трудные разделения проводить с миним. кол-ми комп-в. При близ- ких темп-х кипения требуются многотарельчатые колонны, поэтому лучше предварительно отделить оста-льные компоненты и оставить только трудно разделяемые. |
Концепции синтеза ХТС. Полное использование сырьевых ресурсов. Приемы: 1) Выбор схемы процесса — важнейший этап, на котором можно добиться улучшения использования сырьевых ресурсов. Винил— хлорид получают в две стадии — хлорирование этилена и даль- нейший
пиролиз образовавшегося дихлорэтана:
Избирательность каждой из стадий — около 95%, образуется НСl как отход. Выход винилхлорида по этилену — 90%‚ а по второму исходному веществу, хлору, — 50%. Перейдя к одностадийной схеме окислительного гидрохлорирования с избиратель-ностью 95%, удалось разработать процесс с 95% выходом продукта по обоим исходным компонентам.
2) Избыток одною из реагентов — как правило, более дешевого и доступного, а также возможность вернуть его в процесс. Используют два фактора влияния избытка реагента на увеличение выхода продукта (термодинамический и кинетический). Н-р: паровая конверсия метана, изменение соотношения метана и воды 1:4 степень превращения с 0,58 ув-ся до 0,96 (СН4 + Н2О = СО + 3Н2). (термодин. фактор). 3) Противоточный контакт фаз (движение теплоносителей в ТО). 4) Фракционный рецикл (синтез аммиака: после конденсации и сепарации аммиака оставшуюся смесь снова отправляют в р-р). 5) Утилиза-ция отходов: В производстве экстракционной фосфорной кислоты много отходов от минеральных составляющих апатита в виде СаSO4 - фосфогипс. В отличие от природного фосфогипс, являющийся отходом производства фосфорной кислоты, загрязнен и имеет другую криста-ллическую структуру. Перекрис-таллизация и обработка фосфогипса позволяет получать разнообразные строительные материалы. 6) Альтернативное сырье (получение топлива из угля вместо нефти). Полное использование топливно-энергетических ресурсов (ТЭР). 1) Регенерация тепла и энергии (исполь-зование разогретой реакц. смеси в кач. горячего теплоносителя). 2) Утилиза-ция тепла и энергии – тепло и энергия потока использ-ся для получения ре-сурсов, которые не используются в данном произ-ве (выработка пара в котлах-утилизаторах). 3) Альтерна-тивные источники энергии. 4) Замена химической схемы получе-ния пр-та (замена двухстадийного де-гидрирования бутана на одностадий-ное – пр-во бутадиена-1,3). Минимизация отходов. 1) Санитар-ная очистка и обезвреживание отходов. 2) Уменьшение и замена вспомога-тельных потоков (замена водяных хол-в на воздушные). 3) Замкнутый водо-оборот – искл-е отходов загрязн.воды 4) Повышение надеж-ти оборудования и элементов ХТС: использование совершенных конструкций; подбор соответств-х конструкц.матер-в, устойчивых к имеющимся воздейст-м; регулярный профилакт. осмотр состоя- ния оборудования и его ремонт; прог-нозирование возможных нарушений на основе диагностики состояния и тео-рии надежности систем. Эффективное использование обору-дования. 1) Выбор процесса (перех. от алюмосиликатного кат-ра гидрокре-кинга у/в. к цеолитному – скор-ть проц. ув-сь в 300 раз). 2) Оптимизация процесса. 3) Организ-я проц. в апп-те (контакт теплоносителей в противото-ке). 4) Организация технол. проц. в подсистеме ХТС (замена период. проц. на непрерывный). 5) Конструкт.реш-я аппаратов (замена аксиального слоя катал-ра на радиальный). 6) Совмеще-ние процессов – конструктивное (пр-во аммиака – р-р + котел-утилизатор); функциональное – реактор-ректифик-р. Составление баланса. Практич. мат. баланс учитывает составы исх. сырья и готовой продукции, избыток одного из комп-в сырья, степень превр.реагентов, потери сырья и готового продукта и др Исх. данные: технол. схема, годовая произв-ть по прод-ту, произв. рецепту-ра загрузки комп-в, потери сырья. Сна-чала опред-т произв-ть по прод. с учетом потерь, затем общую величину потерь, расход каждого вида сырья и расходные коэф-ты сырья на тонну продукта.
|
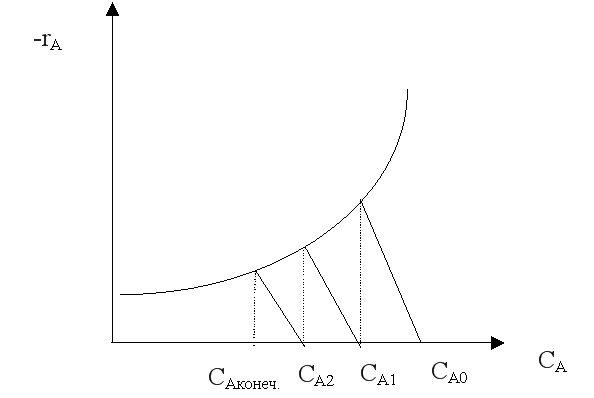
Синтез однородных ХТС. Каскад РИС-Н. В единичном РИС-Н нельзя добиться высокой степени превра-щения, так как конц-я исходного реагента мгновенно падает, и весь процесс протекает при низкой ско-рости. Однако при проведении реак-ций, в которых участвуют два и более реагентов, перемешивание участников реакции является необходимым условием ее осущест-вления. В этом случае можно исполь-зовать р-ры, которые описывают ячеечной моделью или моделью К-РИС-Н. Графический метод расчета К-РИС-Н: построить кривую –rA = kCANa (NA – порядок реакции); из точки СА0 провести прямую с тангенсом угла наклона –1/τ1, где τ1 – время нахождения реагента в первом реакторе (задается); из точки пересечения кривой и прямой опустить перпендикуляр на ось «х», полученное значение СА1 - конц-я реагента на выходе из первого реактора и на входе во второй реактор; операции повторять до тех пор, пока не будет достигнута конечная концентрация реагента СА конеч., соответствующая заданной конверсии реагента.
Аналитический метод расчета К-РИС-Н: простая необратимая реакция первого порядка.
Если
время const:
Производство серной кислоты. Хим. схема:
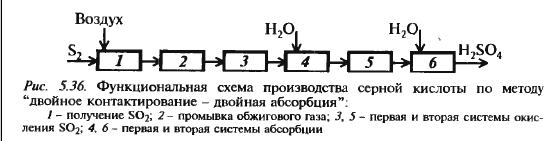
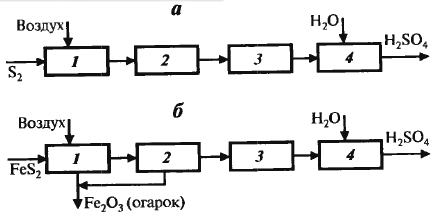
Функц. схема:
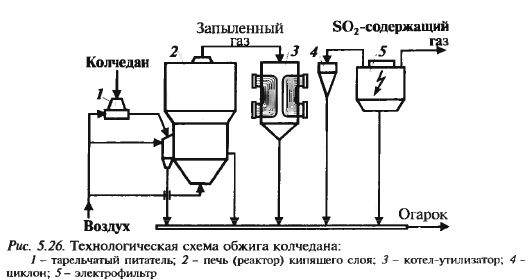
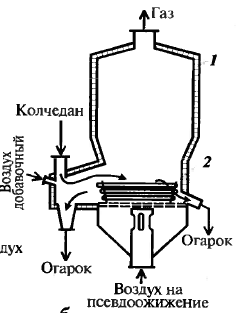
обжиг сырья, очистка и промывка об-жигового газа, окисление SO2, абсор-бция SO3 1) Обжиг колчедана Обжиг колчедана (пирита) явл-ся сложным ф-х процессом и включает в себя ряд последовательно или однов-ременно протекающих р-ций:
термич диссоциация, газофазное горение серы, горение пирротина
При недостатке кислорода:
Обжиг ведут при 850-900ºС. Печь кипящего слоя:
Технологическая схема см. дальше Ф-х основы процесса:
а – конц-я диоксида серы в обж. газе
|
|
Состояние (режим) ХТС определяется параметрами (показателями) потоков (связей) и состоянием аппаратов (эле- ментов). Параметры потоков: параметры состояния (количество потока в единицу времени (расход), фазовый состав, хими-ческий состав, температура, давление); параметры свойств: теплоемкость, плотность, вязкость и другие. Состояние элемента: регули-рующие воздействия (температура хладагента, отводящего тепло из реактора, или подача пара в паровую турбину); изменяющиеся в процессе эксплуатации характеристики аппарата и условия про-цесса в нем (изменение условий процесса в р-ре вследствие дезактивации катализатора или в ТО из-за загрязнения его пов-ти).
Примеры составления балансов для отдельных элементов ХТС Смеситель объединяет два потока
Конц-ции
комп-в:
Можно использовать мольные потоки (М) или объемы потоков. Делитель простой разд-т поток без изм-я состава. Пусть 2 поток составляет долю α входного потока
После раздел-я:
Делитель пропорциональный осущ-т обмен комп-ми между потоками. αi – доля комп-та входного потока, перещедшая в выход. поток 2:
Конц-ии
к-в:
При составлении материального баланса обычно задаются степени превращения исходных веществ в стехиометрических уравнениях как результат химического превращения в реакционном элементе. Кол-во продуктов, конц-ции комп-тов/их выход, селективности пересчитываются в ст.превр. Стехиометр. коэфф-ты можно выра-зить в массовых величинах, умножив “мольные” коэфф-ты на мольную массу. Используя ур-е с “массовыми” стех. коэфф-ми можно сразу получить массовый баланс в реакц. элементе.
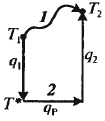
Можно также использовать суммарное уравнение реакции. Тепловой эффект реакции Заменяем путь процесса 1 на гипоте-тический 2
Тогда тепловой баланс:
Тепл. баланс для реактора окисления SO2: Расчет температурного режима всех потоков - весьма громоздкая задача. Расчет температуры только выходящего потока Твых проведем с помощью балансовых уравнений.
Несмотря на сложность структуры реакц. узла, разогрев смеси равен адиабат. разогр. Формы представления баланса: 1) сводная таблица; 2) нанесение показателей на схему
3) диаграммы
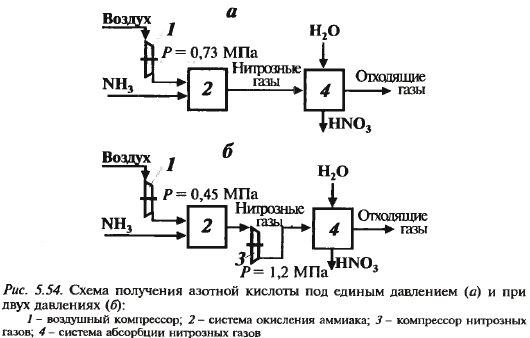
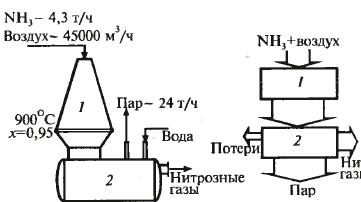
Производство азотной кислоты Хим. схема
Функц. схема см. дальше
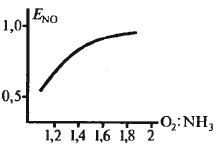
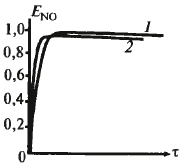
Кат-р – сетка из металл. проволоки Влияние разл. пар-ров на выход: 1 - 0,1 МПа 2 – 0,7 МПа
Оптим.
соотн – 1:1,8 (10% аммака)
1
– 0,1 МПа 2 – 0,7 МПа
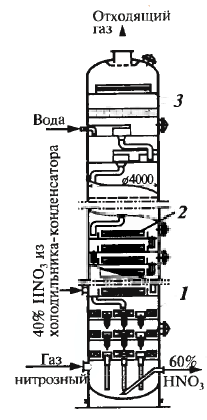
Абс-ция лучше проходит при повыш. давлении (см. схему при 1 и 2 давл.) Абсорбция оксидов азота
1 – ситчатые тарелки, 2 – змеевико-вые хол-ки, 3 – брызгоотбойники
Азотистая к-та разлагается на азотную к-ту и NO. |
Тепловой КПД характеризует энерг. эффективность ХТС.
по порядку: тепло, полезно затрачен-ное на технол. цели (из теор. расчета); доли тепла, генерированные в эл-х ХТС (котлы-утил.); КПД преобразов. тепла вторич. энергорес-в; тепло втор. энергорес-в, генер. в k-м элементе; расход топлива на технол. цели в l-м эл-те; теплота, выдел-ся при экзотер. реак-х и физ. превр-х в p эл-те; тепло, подведенное в j-й элемент ХТС с энергоносителями (пар, вода и др) Св-ва ХТС. 1) Зависимость режима одного аппарата от режимов других. 2)
Усовершенствование одного узла/
элемента улучшает эфф-ть ХТС в целом
за счет выигрыша в другом узле системы.
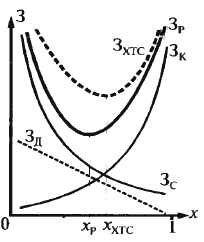
3) Оптимальные режи-мы эл-та и системы
могут различать-ся. Н-р: определим, при
какой степе-ни превр-я затраты будут
минималь-ны. (Cкап
– стоимость капит. вложений, Цс –
стоимость единицы расхода сырья, К1 –
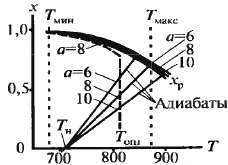
коэф-т окупаемости. Одиночный реактор:
Оптим. х – хр Реактор в системе: добавляются зат-раты на разделение Зд.
Оптим. х – хХТС.
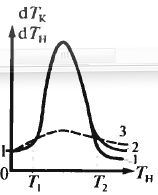
Неоднозначность режимов и их не-устойчивость. Обратные связи, имеющиеся в сист., могут привести к появлению неоднозначности режи-мов. Р-р с внешним ТО: выходящий горячий поток нагревает исх. смесь. Произведение чувствительностей т-р показывает нарастание темп-ры при однократном прохождении по линии «р-р – ТО». Процесс устойчив, если
Тепл. баланс:
Продифференцируем:
Тогда условие устойчивости:
Неустойчивый процесс – кривая 3 от Т1 до Т2.
Поглощение NO2 – быстрая р-ция, быстро достиг-ся равнов. между азот.к. и NO2 в паре. NO окисл. медленно.
Повыш-е давл. ускоряет окисл. NO и абсорбцию NO2. Энерготехнология Схема см дальше Очистка выход. газов – катал. восст. до азота (восст-ль – метан). Газы после абс. – под повыш. давл., потенц. кот. можно испол-ть для привода воздуш. компрессора. Очищенный газ сжигает-ся, затем эта энергия и пот-л давления исп-ся в турбине, питающей компресс-сор, т. о. можно освободиться от пот-ребления компрессором энерг. со сто-роны. |
При
горении серы:
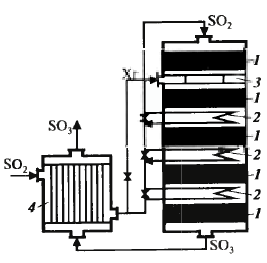
Окисление диоксида серы: ф-х основы
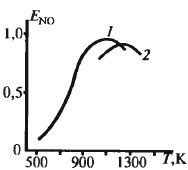
Процесс адиабатический, чем выше конц-я SO2, тем больше разогрев. Равновесная темп. не должна превышать максимальную, поэтому в пром-ти нач. конц-я – 7-8%.
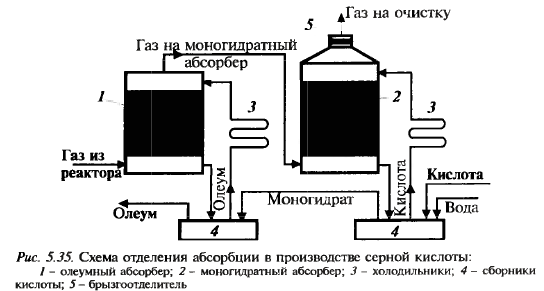
Схема см. дальше Абсорбция триоксида серы
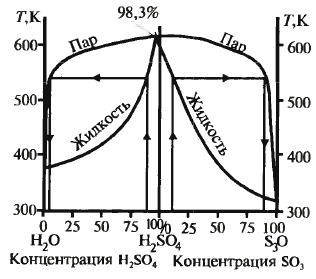
При конц-ии серной кислоты 98,3% процесс протекает лучше всего: при меньшей конц-ии реакция протекает также в паровой фазе, образ-ся серно-кислотный туман, при большей конц. поглощение неполное. Поэтому применяют два абсорбера: олеумный (газ неполностью поглощается олеумом) и моногидратный (конц. кислоты 98,3%, газ погл-ся полнос-тью) Схема см. дальше ДК-ДА Схема см. дальше Применяется для сокращения выбро-сов SO2 и увеличения степени превр. путем выведения продукта из реак-ра. Реакц. смесь нагревают дважды: в первом р-ре и перед вторым. Увели-чить кол-во тепла можно, увеличив площадь ТО или конц-ю SO2, поэто-му используют газ с конц-ей 10%. Производство аммиака
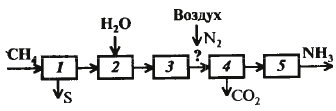
паровая конверсия метана, конверсия оксида углерода, синтез аммиака Функц.схема
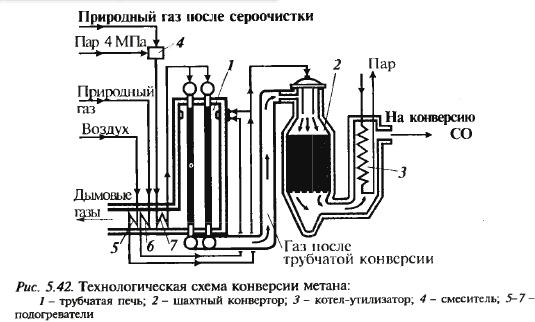
очистка прир. газа от серосодерж. соед-ий, конверсия метана, конверсия СО, очистка от оксидов углерода, синтез аммиака Конверсия метана
Сначала добиваются более полного превращения метана, повышая темп. При этом темп-ра, необх. для полного превращ. слишком высока, поэтому метан превращается неполностью (1 стадия – трубчатая печь, взаим. с паром). 2 стадия – шахтный конвер-тор, стенки которого покрыты бето-ном, соотв. можно повысить темпер. Оставшийся метан сгорает в кисл. воздуха, при этом также решается проблема подачи азота. Схема см. дальше Конверсия СО
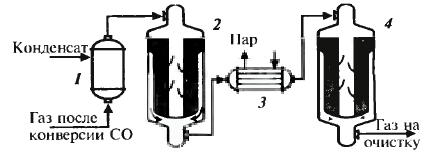
Проводится подобно окислению SO2. Два р-ра с селект. катал-ми: железох-ромовый и медьсодержащий. Схема дальше. Очистка от оксидов углерода CO2 абсорб-т р-ром моноэтанолами-на (МЭА-очистка)
Очистка от СО2: абсорбер, откуда очищенный газ идет на очистку от СО, и десорбер, где получ. СО2. В реакторе нах-ся никелевый катал-р, на кот-м гидрируется СО и ост. СО2
Адиабат. разогрев небольшой, поэто-му исп-ся однослойный р-р. Сумм. содерж. СН4 в синтез-газе – ок. 1%. Синтез аммиака
Кр опред-ся по эмпир. уравнению, из ур-я р-ции можно получить:
Кат-р – пористое железо с добавками, оптим. давление выше 20 МПа, на практике – 30-32 МПа.
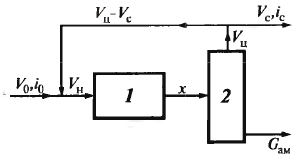
Для полноты превращ-я исп-т рецикл:
Vc – отдувка, выводятся инерт. газы -
конц-я аммиака
-
объем отдувки, где i
– конц-я синтез-газа и отдувки соотв.
Тогда ст. превр. в р-ре:
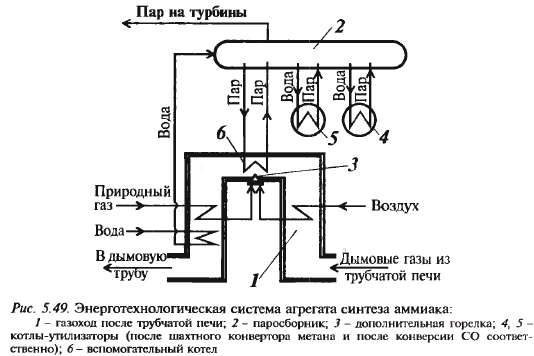
Линия 2 – оптим. теор. Энерготехнология Схема см. дальше Больше половины энергии потребля-ет компрессор синтез-газа, для его пи-тания исп-ся паровая турбина. Другие компрессоры также получ-т эн. от паровых турбин. Для их работы необх. дополн. источник энергии – вспомог. котел (на схеме).
|
Окисление
SO2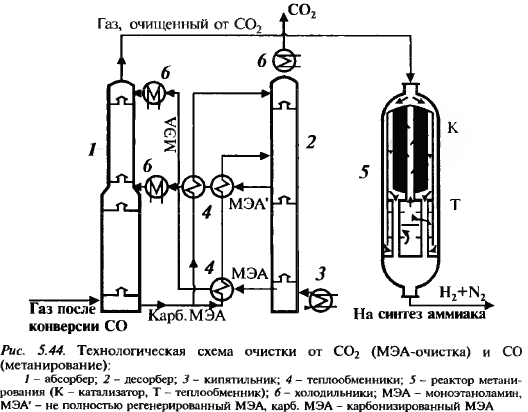

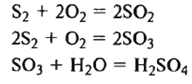
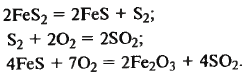
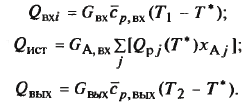
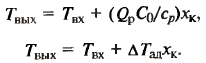
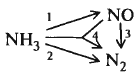
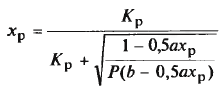 ур-е
решают подбором, необх. степени превр.
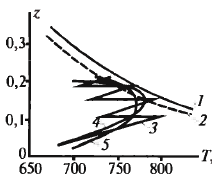
получают при 400-420ºС. Скор. р-ии:
ур-е
решают подбором, необх. степени превр.
получают при 400-420ºС. Скор. р-ии: