
Химия в.15
.docxСодержание
1.Оформление контрольной работы ................................................ . .2
2.Варианты контрольных заданий........................................................ . .2
3.Контрольные задания.........................................................................3
4.Методические указания и примеры решения задач ......................... 17
Литература ..........................................................................................
№15,35,55, 75,95,115,135,155,175,195,215
№15
15. Какие из электронных формул, отражающих строение не возбужденного атома некоторого элемента, записаны неверно: а) 1s2 2s2 2р6 3s1; б) 1s22s22p63s23p63d4; г) 1s22s22p63s23p64s2; д) 1s22s22р63s23d2? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы?
Решение.
а) 1s2 2s2 2р6 3s1 - № 11натрий;
б) 1s22s22p63s23p63d4 – неверно;
г) 1s22s22p63s23p64s2 - №20 кальций;
д) 1s22s22р63s23d2 – неверно.
Неправильно составлены электронные формулы под буквами: б, д. Потому что заполнение электронами орбиталей должно происходить по правилу Клечковского, в атоме распределение электронов происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n+l). При одинаковой сумме раньше заполняется орбиталь с меньшим значением. Последовательность заполнения орбиталей по этому правилу: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d < 4f < 6p и тд.
№35
Какой из двух гидроксидов является более сильным основанием: Ва(ОН)2 или Мg(ОН)2; Са(ОН)2 или Fe(OH)2? Ответ мотивируйте исходя из положения металла в периодической системе.
Гидроксид бария Ba(OH)2 или гидроксид магния Mg(OH)2
Более сильным основанием будет Ba(OH)2, так как в каждой из главных подгрупп с возрастанием порядкового номера элемента заряд его иона остается одним и тем же, но радиус иона возрастает (из-за увеличения числа электронных слоев).
Поэтому сила оснований, образуемых элементами одной и той же главной подгруппы, возрастает с возрастанием порядкового номера элемента.
Гидроксид кальция Ca(OH)2 или гидроксид железа Fe(OH)2
Более сильным основанием будет Ca(OH)2, так как в каждом периоде с возрастанием порядкового номера элемента возрастает заряд его иона и несколько уменьшается его радиус (из-за стяжения электронной оболочки к ядру).
Поэтому сила оснований, образуемых элементами одного и того же периода, уменьшается с возрастанием порядкового номера элемента.
№55
Как метод валентных связей объясняет угловое строение молекул H2S и линейное молекулы СO2?
В молекуле H2S атом серы образует с атомами водорода 2 сигма-связи, и у него еще есть 2 неподеленные электронные пары, т. е. 4 гибридные орбитали, тип гибридизации - sp3. Для этого типа гибридизации характерен валентный угол 109 градусов. Но неподеленные электронные пары являются более диффузными, чем сигма-связывающие орбитали, и занимают больший объем в пространстве, этим объясняется их сильное отталкивающее действие. Поэтому углы между связями S-H и между неподеленной парой атома серы и связью S-H неодинаковы; валентный угол по сравнению с теоретическим уменьшается до 92 градусов. В молекуле СО2 атом углерода связан с каждым атомом кислорода одной сигма- и одной пи-связью, т. е. находится в состоянии sp-гибридизации. Для этого типа гибридизации характерен валентный угол 180 градусов, поэтому молекула СО2 - линейная.
№75
На
основании стандартных теплот
образования и абсолютных стандартных
энтропий соответствующих веществ
вычислите
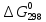 реакции, протекающей по уравнению:
2HCI(г)
+
реакции, протекающей по уравнению:
2HCI(г)
+
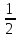 O2(г)
O2(г)
 H2O(г)+CI2(г).
H2O(г)+CI2(г).
В каком направлении эта реакция протекает при стандартных условиях?
Решение.
Стандартные теплоты образования веществ:
 =-241,825
кДж/моль,
=-241,825
кДж/моль,
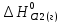 =0
кДж/моль,
=0
кДж/моль,
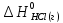 =-91,8
кДж/моль,
=-91,8
кДж/моль,
 =0
кДж/моль.
=0
кДж/моль.
Стандартные абсолютные энтропии веществ:
 =188,72
Дж/(моль*К),
=188,72
Дж/(моль*К),
 =223,0
Дж/(моль•К),
=223,0
Дж/(моль•К),
 =186,8
Дж/(моль•К),
=186,8
Дж/(моль•К),
 =213,65
Дж/(моль•К).
=213,65
Дж/(моль•К).
Энергию Гиббса (изобарно-изотермический потенциал) можно вычислить
по уравнению:
 G°
=
G°
=
 Н°
- Т*
Н°
- Т* S°.
S°.
Изменение энтальпии:
 Н
°х.р.=
Н
°х.р.= Н°прод.-
Н°прод.- Н°исх.
Н°исх.
 Н
°х.р=(
Н
°х.р=( +
+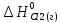 )-(
)-( +
+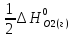 ).
).
 Н
°х.р=(-241,825+0)-(2*(-91,8)+
Н
°х.р=(-241,825+0)-(2*(-91,8)+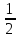 *0)=-58,225
кДж/моль.
*0)=-58,225
кДж/моль.
Изменение энтропии:
 S
о
х.р
= S
о
прод
- S о
исх
S
о
х.р
= S
о
прод
- S о
исх
 S
о
х.р
=(
S
о
х.р
=(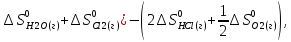
 S
ох.р=(188,72+223,0)-(2*186,8+
S
ох.р=(188,72+223,0)-(2*186,8+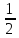 *213,65)=-68,705
Дж/(моль•К)=-0,069 к Дж/(моль•К).
*213,65)=-68,705
Дж/(моль•К)=-0,069 к Дж/(моль•К).
 G°=-58,225-298*(-0,069)=-37,751
кДж.
G°=-58,225-298*(-0,069)=-37,751
кДж.
Самопроизвольно протекающие процессы идут в сторону уменьшения
изобарно-изотермического
потенциала, т.к.
 G < О, то процесс
G < О, то процесс
принципиально осуществим.
Ответ. G°=-37,751
кДж.
G°=-37,751
кДж.
№95
В
гомогенной системе 2NO2
= 2NО + O2
равновесные концентрации реагирующих
веществ:
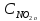 = 0,8 моль/л;
= 0,8 моль/л;
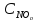 = 2,2 моль/л;
= 2,2 моль/л;
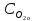 = 1,1 моль/л.
= 1,1 моль/л.
Вычислите константу равновесия реакции и исходную концентрацию NO2.
Решение.
-
Константа равновесия реакции:
Kp = [NO]2 * [O2]/ [NO2]2 = 2,22 * 1,1/ 0,82 = 6,88.
-
В соответствии с уравнением реакции:
2NO2 = 2NО + O2
Из 2 моль NO2 получается 2 моль NО и 1 моль O2;
Из х моль NO2 получилось 2,2 моль NО и 1,1 моль O2, следовательно, исходная концентрация NO2:
0,8+2,2=3,0 моль/л.
Ответ: К = 6,88; С NO2 = 3,0 моль/л.
№115
Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна – 0,5580 С. Криоскопическая константа воды 1,860. Вычислите мольную массу растворенного вещества.
Решение.
Температура кристаллизации чистой воды 00 С. Понижение
температуры кристаллизации раствора:
 Ткрис.=
0
– (– 0,558) = 0,5580.
Ткрис.=
0
– (– 0,558) = 0,5580.
Для
разбавленных растворов повышение
температуры кипения
 Ткип.
Ткип.
и
понижение температуры кристаллизации
 Ткрис.
по сравнению с
Ткрис.
по сравнению с
растворителем выражается уравнением ( второй закон Рауля):
![]() ,
где
К - криоскопическая или эбуллиоскопическая
константа;
,
где
К - криоскопическая или эбуллиоскопическая
константа;
m и М - соответственно масса растворенного вещества и его мольная масса;
m1 - масса растворителя.
Мольная масса растворенного вещества:
М=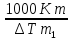 .
.
M=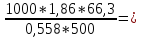 442
г/моль.
442
г/моль.
Ответ. M=442 г/моль.
№135
Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Cu2+ + 2OH- = Cu(OН)2; б) NH4+ + OH- = NH4OH.
Решение.
а) Cu2+ + 2OH- = Cu(OН)2 -сокращенное ионное уравнение реакции;
молекулярные уравнения реакций:
СuС12 + 2КОН = Сu(ОН)2↓ + 2КС1
CuSO4 + 2NH4OH → Cu(OH)2↓ + (NH4)2SO4
![]()
б) NH4+ + OH- = NH4OH- сокращенное ионное уравнение реакции.
Молекулярные уравнения:
NH4Cl + NaOH = NaCl + NH3 ↑ + H2O
2NH4Cl
+ Ca(OH)2 =
CaCl2 +
2NH3 +
2H2O
+
2H2O
NH4Cl
+ KOH = KCl + NH3 +
H2O
+
H2O
№155
Окислительно-восстановительные реакции протекают по схемам. Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается:
а)
FeSO4
+ K2Cr2O7
+ H2SO4
 Fe2(SO4)3
+ Cr2(SO4)3
+ K2SO4
+ H2O
Fe2(SO4)3
+ Cr2(SO4)3
+ K2SO4
+ H2O
б)
I2
+ CI2
+ H2O
 НIO3
+ HCI
НIO3
+ HCI
Решение.
а)
FeSO4
+ K2Cr2O7
+ H2SO4
 Fe2(SO4)3
+ Cr2(SO4)3
+ K2SO4
+ H2O
Fe2(SO4)3
+ Cr2(SO4)3
+ K2SO4
+ H2O
Определяем элементы, которые изменяют свою степень окисления:
+2 +6 +3 +3
FeSO4
+ K2Cr2O7
+ H2SO4
 Fe2(SO4)3
+ Cr2(SO4)3
+ K2SO4
+ H2O
Fe2(SO4)3
+ Cr2(SO4)3
+ K2SO4
+ H2O
Составляем электронные уравнения:
3
2Fe+2 Fe+3
процесс
окисления, восстановитель
Fe+3
процесс
окисления, восстановитель
1
2Cr+6
+6е
 2Cr+3
процесс
восстановления, окислитель
2Cr+3
процесс
восстановления, окислитель
6FeSO4
+ K2Cr2O7
+7H2SO4
 3Fe2(SO4)3
+ Cr2(SO4)3
+ K2SO4
+7H2O
3Fe2(SO4)3
+ Cr2(SO4)3
+ K2SO4
+7H2O
б)
I2
+ CI2
+ H2O
 НIO3
+ HCI
НIO3
+ HCI
Определяем элементы, которые изменяют свою степень окисления:
0 0 +5 -1
I2
+ CI2
+ H2O
 НIO3
+ HCI
НIO3
+ HCI
1
2I0
 I+5
процесс
окисления, восстановитель
I+5
процесс
окисления, восстановитель
5
2
CI0+
2е
 CI-1
процесс
восстановления, окислитель
CI-1
процесс
восстановления, окислитель
I2
+ 5CI2
+6H2O
 2НIO3
+ 10HCI
2НIO3
+ 10HCI
№175
Составьте схему, напишите электронные уравнения электродных
процессов гальванического элемента, состоящего из пластин железа и
кадмия, опущенных в растворы своих солей. Вычислите ЭДС этого
элемента, если концентрации [Сd 2+] = 1 моль/л, [ Fe+] = 0,001 моль/л.
Решение.
Схема данного гальванического элемента
(-) Fe + | Fe || Сd 2+| Сd (+)
Вертикальная черта обозначает поверхность раздела между металлом и
раствором, а две черты - границу раздела двух жидких фаз - пористую
перегородку (или соединительную трубку, заполненную раствором
электролита). Железо имеет меньший потенциал ( -0,44 В) и является анодом – электродом, на котором протекает окислительный процесс. Кадмий, потенциал которого - 0,403 В - катод, т. е. электрод, на котором протекает
восстановительный процесс.
Анодный
процесс: 2 Fe
0
–2e-
 2Fe +
2Fe +
Катодный
процесс: Сd
2 +
+ 2e-
 Сd
0
Сd
0
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода.
Так как концентрация ионов кадмия в растворе равна 1 моль/л, то электродный потенциал катода:
Е0 Cd=-0,403 В.
Электродный потенциал железного анода определим по уравнению Нернста: E = Е0 + (0,059/n)*lgC ,
где Е0 – стандартный электродный потенциал;
n- заряд катиона;
C- концентрация ионов металла в растворе, моль/л.
Электродный потенциал железного анода:
E
Fe
=-0,44+ lg0,001=-
0,617
В.
lg0,001=-
0,617
В.
ЭДС = E Cd - E Fe =-0,403-2(-0,617)=0,831 В.
Ответ. ЭДС = 0,831 В.
№195
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора AgNО3. Если электролиз проводить с серебряным анодом, то его масса уменьшается на 5,4 г. Определите расход электричества при этом.
Решение.
На угольных электродах: на катоде К(-): Ag+ + 1e → Ag0 на аноде А(+): 2H2O - 4e → O2 + 4H+ В случае серебряного анода: Ag - 1e → Ag+ По закону Фарадея:
m(Ag) = Mэ(Ag) * Q / F, где
m(Ag) - масса серебра,
Mэ(Ag) - эквивалентная масса серебра, Mэ(Ag)=108 г/моль,
Q - расход электричества,
F- постоянная Фарадея, F=96500 Кл.
Q = m(Ag) * F / Mэ(Ag) = 5.4 * 96500 / 108 = 4825 Кл.
Ответ. Q=4825 Кл.
№215
Что называется электрохимической защитой? Какие виды электрохимической защиты металлов вы знаете? Объясните механизм электрохимической защиты металлов.
Электрохимическая защита - подавление анодных токов катодными с
помощью внешнего источника.
В зависимости от способа получения электрического тока различают
три виды ЭХЗ: катодную, протекторную, электродренажную.
В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью. Любой метод защиты изменяет ход коррозионного процесса, либо уменьшая скорость, либо прекращая его полностью. Эффективность защиты выражают через коэффициент торможения γ или степень защиты Z . Коэффициент торможения показывает, во сколько раз уменьшается скорость коррозии в результате применения данного способа защиты
![]()
где ![]() и
и ![]() -
скорость коррозии до и после защиты.
Степень защиты указывает, насколько
полно удалось подавить коррозию благодаря
применению этого метода:
-
скорость коррозии до и после защиты.
Степень защиты указывает, насколько
полно удалось подавить коррозию благодаря
применению этого метода:
![]()
или
![]()
Из всех методов защиты, основанных на изменении электрохимических свойств металла под действием поляризующего тока, наибольшее распространение получила защита металлов при наложении на них катодной поляризации (катодная защита). При смещении потенциала металла в сторону более электроотрицательных значений (по сравнению с величиной стационарного потенциала коррозии) скорость катодной реакции увеличивается, а скорость анодной падает (рис. 1).
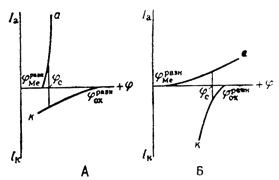
Рис. 1. Коррозионные диаграммы, отвечающие катодному контролю (А) и анодному контролю (Б).
Защита металла катодной поляризацией применяется для повышения стойкости металлических сооружений в условиях подземной (почвенной) и морской коррозии, а также при контакте металлов с агрессивными химическими средами. Она является экономически оправданной в тех случаях, когда коррозионная среда обладает достаточной электропроводностью, и потери напряжения (связанные с протеканием защитного тока), а, следовательно, и расход электроэнергии сравнительно невелик. Катодная поляризация защищаемого металла достигается либо наложением тока от внешнего источника (катодная защита), либо созданием макрогальванической пары с менее благородным металлом (обычно применяются алюминий, магний, цинк и их сплавы). Он играет здесь роль анода и растворяется со скоростью, достаточной для создания в системе электрического тока необходимой силы (протекторная защита).
Применение анодной защиты целесообразно в сильно агрессивных средах, например, в химической промышленности. При наличии поверхности раздела жидкость-газ необходимо иметь в виду, что анодная защита не может распространяться на поверхность металла в газовой среде, что, впрочем, типично и для катодной зашиты. Анодная защита может осуществляться несколькими способами.
Простое наложение постоянной э.д.с. от постороннего источника электрической энергии. Положительный полюс подключается к защищаемому изделию, а около его поверхности помещают катоды сравнительно малого размера. Таким способом можно защищать изделия из титана или циркония в серной кислоте.
Анодная защита потребляет очень мало энергии и может применяться для защиты обычных конструкционных металлов, способных пассивироваться, например углеродистой и нержавеющей стали, во многих средах. Эта защита легко подвергается контролю и измерениям и не требует дорогостоящей обработки поверхности металла, так как использует самопроизвольный эффект реакции между стенками емкостей и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля.
Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним из следующих способов: покрытием металла поверхностными пассивирующими пленками из его трудно растворимых соединений (окислы, фосфаты, сульфаты, вольфраматы или их комбинации), созданием защитных слоев из смазок, битумов, красок, эмалей и т.п. и нанесением покрытий из других металлов, более стойких в данных конкретных условиях, чем защищаемый металл (лужение, цинкование, меднение, никелирование, хромирование, свинцование, родирование и т.д.).
Защитное действие большинства поверхностных пленок можно отнести за счет вызванной ими механической изоляции металла от окружающей среды. По теории локальных элементов, их эффект следует рассматривать как результат увеличения электрического сопротивления.
Повышение устойчивости железных и стальных изделий при покрытии их поверхности осадками других металлов обусловлено и механической изоляцией поверхности, и изменением ее электрохимических свойств. Скорость коррозии можно снизить также изменением свойств коррозионной среды. Это достигается или соответствующей обработкой среды, в результате которой уменьшается ее агрессивность, или введением в коррозионную среду небольших добавок специальных веществ, так называемых замедлителей или ингибиторов коррозии.
Выводы.
1.В задачу защиты не входит полное прекращение процесса
коррозии. К тому же, это и невозможно.
2.Основная цель защиты – замедлить скорость коррозионного
разрушения до приемлемого уровня.
3.Изменение или сдвиг потенциала от равновесного значения
называют поляризацией электрода.
4.Изоляционные покрытия не гарантируют необходимой защиты
газопровода от коррозии.
5.Достаточно эффективная защита может быть обеспечена только при
нанесении покрытий и применении электрохимической защиты
(комплексная защита).
6.Электрохимической называется защита от коррозии,
осуществляемая путем поляризации от внешнего источника тока или путем соединения с металлом, имеющим более отрицательный (катодная
поляризация) или более положительный потенциал (анодная
поляризация), чем у защищаемого металла.
7.Применяют четыре вида электрохимической защиты:
-протекторную;
-катодную;
-электродренажную;
-анодную
8.При больших плотностях катодного тока на защищаемом сооружении происходит выделение газообразного водорода.
Литература
Основная
1. Павлов Н.Н. Общая и неорганическая химия: учеб. для вузов. – Санкт-Петербург.: Лань, 2011. – 496с.
2. Глинка Н. Л. Общая химия: учеб. пособие. – М.: Кнорус,2010. –752 с.
3. Глинка Н. Л. Задачи и упражнения по общей химии: учеб. пособие. – М.: Юрайт. – 2014. – 236 с.
Дополнительная
4. Коржуков Н. Г. Общая и неорганическая химия: учеб.пособие – М.: МИСИС: ИНФРА.– 2004. – 512 с.
5. Метельский А. В. Химия в вопросах и ответах. – Мн.: БелЭн, 2003. –544 с.
6. Химия. Программа, методические указания, решения типовых задач для студентов-заочников инженерно-технических специальностей вузов/ сост. А.И. Бережной, В.И. Ефимов, Л.Д. Томина – М.: Высш.шк., 2004 –199 с.
