
Лекции Прикладная аэроэкология 1
.pdf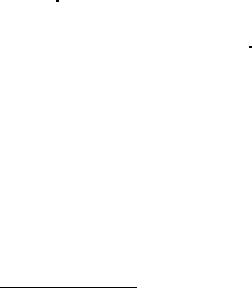
21
¾15% - силикаты;
¾5% - сажа;
остальное – оксиды металлов: As, Mo, Sb, и др.
Ориентировочные значения содержания пыли в воздухе, мг/м3 (среднесуточные):
¾сельский воздух – 0,02;
¾воздух городов – 0,1-0,4;
¾в промышленных районах (максимальные значения) – до 15;
¾магазины – 5-8;
¾литейные цеха – 15-50;
¾угольные шахты – 100-200;
¾участок упаковки цемента в мешки – 100-500.
4.6.Диоксид углерода (СО2)
Диоксид углерода (СО2) или углекислый газ не является примесью в атмосфере, поскольку входит в ее постоянный состав (0,03% об.). Естественные пути попадания его в атмосферу – дыхание и распад организмов, растений и гумуса. Антропогенные - сжигание углеводородсодержащих веществ.
СО2 содержится в атмосфере в таких количествах, что играет роль в те-
пловом балансе Земли как при поглощении, так и при излучении инфракрасной радиации. Увеличение содержания СО2 в атмосфере приводит к увеличе-
нию температуры поверхности Земли (парниковый эффект). СО2 не токсичен на уровнях, предсказываемых на конец столетия и даже при более высоких концентрациях.
ПАРНИКОВЫЙ ЭФФЕКТ атмосферы, свойство атмосферы пропускать солнечную радиацию, но задерживать земное излучение, способствует аккумуляции тепла Землёй.
Земная атмосфера сравнительно хорошо пропускает солнечную коротковолновую радиацию, которая почти полностью поглощается земной поверхностью, т. к. альбедо2 земной поверхности мало. Нагреваясь за счёт поглощения солнечной радиации, земная поверхность становится источником земного, в основном длинноволнового, излучения, прозрачность атмосферы для которого мала и которое почти полностью поглощается в атмосфере. Благодаря парниковому эффекту при ясном небе только 10÷20% земного излучения может, проникая сквозь атмосферу, уходить в космическое пространство.
2 АЛЬБЕДО – характеристика отражательных свойств поверхности тела: отношение рассеянного потока излучения поверхностью к потоку излучения, падающему на поверхность.
22
5. Химические превращения (трансформация) примесей в атмосфере
Тропосфера является неравновесной химически активной системой. В ней непрерывно идут процессы изменения концентрации примесей в атмосферном воздухе.
Знания о механизмах и скорости процессов поступления выбросов из природных и антропогенных источников, переноса в другие сферы (воду, почву) или трансформации в атмосфере позволяют составить баланс атмосферной части глобального кругооборота веществ в природе.
Большинство газообразных примесей, выбрасываемых в атмосферу, находятся в восстановленной форме или в виде окислов с низкой степенью окисления (сероводород, метан, оксид азота). Анализ атмосферных осадков показывает, что возвращенные на поверхность земли примеси представлены в основном соединениями с высокой степенью окисления (серная кислота, сульфаты, азотная кислота, нитраты, диоксид углерода).
Таким образом, тропосфера играет роль глобального окислительного резервуара.
Процессы окисления примесей в тропосфере могут протекать по трем различным направлениям:
1.окисление непосредственно в газовой фазе;
2.окислению предшествует абсорбция примесей частицами воды, в дальнейшем процесс окисления протекает в растворе;
3.окислению предшествует адсорбция примесей на поверхности взвешенных в воздухе частиц.
Вроли окислителя могут выступать молекулы кислорода, перекись водо-
рода, озон. Основную роль в процессах окисления, протекающих в атмосфе-
ре, играют свободные радикалы, прежде всего гидроксильный радикал ОН-.
Он образуется в верхних слоях атмосферы путем фотодиссоциации воды и при других реакциях, протекающих с участием синглетно-возбужденного атома кислорода.
2Н2О → 2ОН─+ Н2

23
О+ Н2О = 2ОН─
О+ СН4 → СН3 + ОН─
Согласно экспериментальным данным концентрация гидроксильных радикалов в тропосфере составляет (0,5 - 5)х106 1/см3.
В основных состояниях обычных молекул все электроны спарены; в возбужденных состояниях все электроны также могут быть спаренными. Такие возбужденные состояния, в которых электроны спарены, называются синглетными.
Схематическое изображение электронных конфигураций основного и низшего возбужденного состояния (синглетного) молекулы с четырьмя электронами и четырьмя молекулярными орбиталями (ψ1,
ψ2, ψ3, ψ4 )
5.1. Трансформация соединений углерода
СО - В большинстве случаев СО можно рассматривать как химически неактивный компонент воздуха. Однако в стратосфере и при фотохимическом смоге СО может окисляться до СО2, взаимодействуя со свободным радикалом ОН─:
СО+ ОН─ → СО2 + Н+
5.2. Трансформация метана
СН4 - Фотохимическое окисление метана в тропосфере протекает в основном по радикальному механизму:
НСН3 + ОН─ → НСН2─ + Н2О Образовавшийся на первой стадии метильный радикал при столкнове-
нии с молекулой кислорода дает другую неустойчивую частицу - метилпероксидный радикал.
НСН2─ + О2 → СН3ОО─ Метилпероксидный радикал в атмосфере разлагается с образованием ме
токсильного радикала:
СН3ОО─ + NО → СН3О─ + NО2 2 СН3ОО─ → СН3О─ + О2
24
При взаимодействии метоксильного радикала с кислородом происходит образование формальдегида:
СН3О─ + О2 → СН2О + НО2─ Молекулы СН2О подвергаются фотолизу при поглощении света в бли-
жайшей ультрафиолетовой области с образованием формильного традикала:
ν
СН2О → НСО + Н
ν
СН2О → СО + Н2 Формильный радикал НСО─ образуется также при взаимодействии фор-
мальдегида с гидроксилрадикалом:
СН2О + ОН─ → НСО─ + Н2О Реагируя с ОН-радикалом, формильный радикал образует оксид углеро-
да, который является конечной стадией окисления органических соединений в атмосфере:
НСО─ + ОН─ → СО + Н2О Цепь превращений метана в атмосфере может быть представлена сле-
дующим образом:
|
|
|
ОН− |
НСО─ |
ОН− |
|
|
|
→ |
→ |
|
СО |
|
|
|
|
|
ОН − |
О 2 |
NO |
O 2 |
ν |
ОН− |
СН4 → |
СН3─ → |
СН3ОО─ → |
СН3О─ → СН2О |
→ НСО─ → |
|
СО |
|
|
|
|
|
|
|
|
ν |
СО + Н2 |
|
|
|
|
→ |
||
5.3. Трансформация соединений серы
SO2 - Детальный механизм трансформации соединений серы в тропо-
сфере до настоящего времени не установлен. Наиболее вероятным представляется протекание реакций окисления с участием свободных радикалов:
Н2S+OH-→H2O+HS HS+O2→OH-+SO SO+HO2→SO2+OH-
25
Полученный из сероводорода диоксид серы (как и SO2, поступающий из антропогенных источников) окисляется далее;
SO2+ OH-→ HSO3 HSO3+ HO2→SO3+2OH- SO2+ HO2→ SO3+OH-
Скорость трансформации диоксида серы при средних значениях концентраций свободных радикалов в воздухе составляет примерно 0,1% в час, что соответствует времени пребывания SO2 в атмосфере, равному 5 сут. Процесс трансформации диоксида серы в воздухе резко ускоряется в промышленных регионах, где имеет место увеличенное содержание свободных радикалов.
Триоксид серы (серный ангидрид) легко взаимодействует с частицами атмосферной влаги и образует растворы серной кислоты:
SO3+ H2O→ H2SO4
Реагируя с аммиаком или нонами металлов, присутствующими в частицах атмосферной влаги, серная кислота частично переходит в соответствующие сульфаты. В основном это сульфаты аммония, натрия, кальция.
Образование сульфатов происходит и в процессе окисления на поверхности твердых частиц, взвешенных в воздухе. В этом случае стадии окисления предшествует адсорбция, сопровождающаяся химическими реакциями с образованием сульфитов:
SO2+ СаО→ Са SO3 SO2+МgО→ МgSO3
Вдальнейшем при взаимодействии с молекулярным кислородом сульфиты переходят в соответствующие сульфаты.
Вдождливую погоду возможен процесс окисления SO2 после предварительной абсорбции их каплями атмосферной влаги. В процессе окисления SO2 в жидкой фазе активное участие принимают ионы ОН- и НО23-, которые образуются в результате фотохимических превращений в слое облаков. Конечными продуктами окисления SO2 как в растворе, так и в газовой фазе, является серная кислота, которая образуется в виде мелкодисперсных аэрозо-
26
лей. Аэрозоли вымываются из атмосферы осадками и адсорбируются на поверхности земли. Такие явления называются кислотными дождями. Водородный показатель (рН) воды кислотных дождей менее 5,6.
В первые моменты после выброса диоксида серы в атмосфере практически отсутствуют частицы серной кислоты и сульфатов. Со временем доля SO2 в воздухе уменьшается, одновременно растет доля серы в виде H2SO4 и сульфатов. Количество серной кислоты в атмосфере достигает максимума спустя 10 часов после выброса, а сульфатов — через 30—40 часов.
5.4. Трансформация соединений азота
Соединения азота в атмосфере в основном представлены оксидами азота, аммиаком и солями аммония, а также азотной кислотой и нитритами.
Большинство естественных и антропогенных выбросов содержат оксид азота NO. В тропосфере NO, взаимодействуя с гидропероксил-радикалом, переходит в диоксид азота:
NO + HO-2 → NO2 +OH −
Окисление оксида азота происходит также при взаимодействии с озо-
ном:
NO +O3. → NO2+ O2
Под действием солнечного излучения происходит обратная реакция — часть диоксида азота разлагается с образованием оксида азота и атома кислорода:
NO2→ NO +O+
Атомарный кислород приводит к образованию в атмосфере озона.
В результате взаимодействия диоксида азота с гидроксильным радикалом происходит образование азотной кислоты:
NO2 + OH-→ НNO3
Образование азотной кислоты по вышеприведенной реакции является важной частью атмосферного цикла соединений азота. Около 44% НNO3 в тропосфере образуется в результате именно этой реакции.
27
Основное количество азотной кислоты выводится из тропосферы с атмосферными осадками в виде растворов НNO3 и ее солей.
Часть азотной кислоты разлагается с образованием диоксида или триоксида азота, которые вновь включаются в атмосферный цикл его соединений:
НNO3 → ОН + NO2 НNO3+ OH-→ Н2О + NO3
Среди нитратов, присутствующих в атмосфере, основное количество составляет азотнокислый аммоний NH4NO3, который образуется при взаимодействии соответствующих аэрозолей кислот и аммиака. Соединения аммония выводятся из атмосферы с атмосферными осадками и в результате процессов сухого осаждения.
Следует отметить, что оксиды азота поступают в атмосферу в форме NO, который на последующих стадиях превращается в NO2. Двуокись является более токсичным соединением: ПДКNO2=0,085мг/м3; ПДКNO=0,4 мг/м3 . Это обстоятельство необходимо учитывать при разработке мероприятий по защите атмосферного воздуха и производит соответствующий пересчет.
Например, оксиды азота в дымовых газах, поступающих в атмосферу с продуктами сгорания топлив, приблизительно на 97% состоят из NO. В атмосферном воздухе около 80% NO окисляется в NO2. Поэтому состав выбросов необходимо привести в соответствие с учетом превращения части NO в NO2.
Пример: От нагревательной печи в атмосферу выбрасываются оксиды азота NOх в количестве 100 г/с. Определить количество NO и NO2 , которое необходимо учитывать в атмосферном воздухе.
Решение:
1.Количество NO2, NO содержащееся в массе NOх дымовых газов:
МNO2=100 * 0,03 = 3 г/с
МNO=100 * 0,97 =97 г/с..
2.Масса NO2, образующаяся при трансформации NO :
М NO2= МNO *А*(МNO2 /МNO )=97*0,8*(46/30) = 119 г/с.
где:А=0,8 – доля NO, окисляющаяся в атмосферном воздухе вNO2.
28
МNO2, МNO – молекулярная масса двуокиси и окиси азота (46 и 30). 3.Общее количество NO2, которое необходимо учитывать при расчетах загрязнения атмосферы:
МNO2=3 г/с+119г/с =122 г/с;
4. .Общее количество NO , которое необходимо учитывать при расчетах загрязнения атмосферы:
МNO= М NO *(1-А)=97*(1-0,8)=19,4 г/с.
5.Общее количество NOх в атмосферном воздухе в результате трансформации:
МNOх= МNO2+ МNO=122 г/с+19,4 г/с=141,4 г/с.
6.Смог и его виды
Трансформация примесей в атмосфере может привести к образованию смога.
Смог (от английских слов “smoke” — дым, fog — туман) — атмосферное явление, наступающее при совпадении определенных метеорологических условий и высокой степени загрязненности воздушного бассейна. Различают следующие виды смогов: фотохимический, лондонский и ледяной.
6.1. Фотохимический смог
Фотохимический смог образуется в ясную солнечную погоду, при низкой влажности, температуре выше +300 С, полном отсутствии ветра и высокой загрязненности воздуха. При фотохимическом смоге наблюдается появление голубоватой дымки или беловатого тумана и связанное с этим ухудшение видимости. Основными химическими соединениями, обеспечивающими вышеперечисленные свойства смога, являются озонид углерода и пероксиацилнитраты (ПАН), образующиеся в результате химических реакций находящихся в воздухе углеводородов с оксидами азота и углерода под воздействием солнечной радиации (фотохимический эффект).
29
Смог вызывает у людей раздражение органов чувств, химически действует как окислитель (усиливает коррозию металлов, приводит к растрескиванию резины).
Фотохимический смог характерен для таких городов, как Днепропетровск, Донецк, Запорожье.
6.2. Лондонский смог
Лондонский смог формируется при влажности воздуха около 100%, темпе ратуре 0о С, длительной штилевой погоде и высокой концентрации продуктов сгорания твердого и жидкого топлива (S02, сажа, NOx и СО). Наблюдается чаще в осенне-зимний период, характерен для умеренных широт с влажным морским климатом. Смог получил свое название после происшедшей в столице Великобритании в декабре 1952 г. катастрофы, связанной с высокой загрязненностью воздуха и длительным штилем в течение двух недель. В этот период резко повысилось число легочных и сердечнососудистых заболеваний, смертность увеличилась более чем в 10 раз. Подобные ситуации повторялись в декабре 1956 и январе 1957 г.
Благодаря принятым мерам по ограничению пылегазовых выбросов загрязнение атмосферного воздуха в Лондоне значительно снизилось. Так, в период 1952—1970 гг. выбросы сажи при отоплении жилых домов сократились с 130 тыс.т в год до 10 тыс.т, а от промышленных предприятий - с 50 тыс.т до 5,0 тыс.т в год. Сильный туман, который образовался в декабре 1972 г., висевший над городом на протяжении двух недель, на этот раз не вызвал серьезных последствий для населения.
Смог типа лондонского характерен для Мариуполя, Одессы и других при морских городов.
6.3. Ледяной смог
Ледяной смог характерен для городов, расположенных в высоких (северных) широтах. Он образуется при температурах ниже минус 300С, полном штиле, высокой влажности воздуха и наличии мощных источников загрязне-
30
ния атмосферы. При низкой температуре капельки водяного пара превращаются в кристаллики льда (размером 5—10 мкм) и повисают в воздухе в виде густого белого тумана. Видимость уменьшается до 8—10 м. На кристалликах льда адсорбируются частички и молекулы пылегазовых выбросов. Утяжеляясь, кристаллики льда опускаются в приземный слой. Дыхание в таком тумане становится невозможным.
Для Украины ледяной смог не характерен.

7. Основные физико-химические свойства пылей и газов
7.1. Плотность пыли
Плотность пылей (частиц) – масса единицы объема - бывает истинная, кажущаяся и насыпная.
Истинная плотность твердой частицы определяется как отношение массы ее вещества к занимаемому ею объему за вычетом объема пор и газовых включений, которые может иметь частица.
Кажущаяся плотность определяется как отношение массы частицы к занимаемому ею объему, включая объемы пор и газовых включений.
Для монолитных твердых и для жидких частиц кажущаяся плотность совпадает с истинной.
Ощутимое снижение кажущейся плотности по сравнению с истинной наблюдается у пылей, склонных к коагуляции, к спеканию частиц ( сажа, окислы цветных металлов и др). Например, истинная плотность частиц газовой сажи составляет 1,8÷1,9 г/см3 а кажущаяся — около 0,13 г/см3.
Для расчетов пыле- и золоулавливающих аппаратов используют кажущаяся плотность, поскольку именно она определяет поведение частиц в газовых потоках.
Насыпная плотность определяется отношением массы свеженасыпанных твердых частиц к занимаемому ими объему, при этом учитывается наличие воз душных промежутков между частицами.
Величиной насыпной плотности пользуются для определения объема бункеров газоочистных аппаратов.
С увеличением однородности частиц по размерам их насыпная плотность уменьшается, так как увеличивается относительный объем воздушных прослоек. Насыпная плотность слежавшейся пыли оказывается в 1,2—1,5 раза больше, чем свеженасыпанной.
7.2. Дисперсный состав пыли и способы его задания
Размеры частиц золы и пыли характеризуются дисперсным составом. Принято различать:
1. первичные размеры частиц - характерны в момент их образования;
32
2.размеры агрегатированных частиц – образуются при коагуляции в пылегазовых трактах;
3.размеры частиц после выделения их из газовой фазы (хлопья, комочки).
Для первых двух случаев используют понятие «стоксовские размеры частиц» - размеры сферической частицы плотностью 1г/см3, имеющей такую же скорость седиментации (осаждения) в газовой фазе, как и данная несферическая частица или агрегат.
Фракция – относительная доля частиц, размеры которых находятся в определенном интервале значений, принятых в качестве верхнего и нижнего пределов.
Используют три способа задания дисперсного состава пыли: 1). табличный; 2). графический; 3). аналитический.
7.2.1. Табличный способ Табличное представление. Дисперсный состав может быть дан в виде
таблицы с указанием
a). фракций, выраженных в процентах от общей массы (Табл.7.1а);
b). доли частиц с размером крупнее (мельче) данного(Табл.7.1b). Таблица 7.1а.
Дисперсный состав золы Донецкого угля
Размер частицы, мкм |
0-5 |
5-10 |
10-20 |
|
20-30 |
30-40 |
40-50 |
|
|
>50 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фракционный состав, % |
12 |
|
20 |
30 |
|
12 |
|
|
8 |
5 |
|
|
13 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 7.1b. |
|
||||||
|
|
Размер частицы, мкм |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
>5 |
|
>10 |
>20 |
>30 |
>40 |
|
>50 |
|
|
|
|||||||
|
|
Доля частиц с размерами |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
88 |
|
68 |
38 |
26 |
18 |
|
13 |
|
|
|
|||||
|
|
крупнее данного, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7.2.2. Графический способ
Графическое представление. Дисперсный состав графически может быть представлен в виде:
33
a)гистограммы;
b)дифференциальной кривой;
c)интегральной кривой.
Гистограмму (ступенчатый график) строят, принимая равномерное распределение частиц по размерам внутри каждой фракции. По оси абсцисс откладывают размер частиц фракции, по оси ординат - процент содержания фракции.
Рис.7.1. Гистограмма дисперсного состава золы Донецкого угля
Дифференциальная кривая. Для построения дифференциальной кривой распределения частиц по размерам необходимо:
процентное содержание каждой фракции разделить на разность граничных размеров частиц соответствующей фракции;
найденные значения отложить как ординаты точек, абсциссы которых равны среднему размеру каждой фракции.
Таблица 7.2. Данные дисперсного состава для построения дифференциальной кривой
Размер части- |
0-5 |
5-10 |
10-20 |
20-30 |
30-40 |
40-50 |
|
цы, мкм |
|||||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Фракционный |
12 |
20 |
30 |
12 |
8 |
5 |
|
состав, % |
|||||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Ордината |
12/(5- |
20/(10- |
30/(20- |
12/(30- |
8/(40- |
5/(50- |
|
0)=2,4 |
5)= 4 |
10)=3 |
20)=1,2 |
30)=0,8 |
40)=0,5 |
||
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
34 |
|
|
|
|
|
|
|
|
|
Размер части- |
0-5 |
5-10 |
10-20 |
20-30 |
30-40 |
40-50 |
|
цы, мкм |
|||||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Абсцисса |
(0+5)/2= |
(10+5)/2= |
(10+20)/2= |
(20+30)/2= |
(30+40)/2= |
(40+50)/2= |
|
2,5 |
7,5 |
15 |
25 |
35 |
45 |
||
|
|||||||
|
|
|
|
|
|
|
Рис.7.2. Дифференциальная кривая распределения частиц по размерам для золы Донецкого угля
Интегральная кривая. Наиболее удобная форма графического изображения результатов дисперсного анализа. Каждая точка кривой R(dч) или D(dч) показывает относительное содержание частиц с размерами больше (или меньше) данного размера. (Кривая R(dч) построена по данным таблицы 7.1.b.)
Рис.7.3. Интегральная кривая распределения частиц по размерам для золы Донецкого угля
35
7.2.3. Аналитический способ
Распределение частиц по размерам в газовых потоках с учетом их агрегации в большинстве случаем оказывается логарифмически нормальным даже если распределение первичных частиц не являлось таковым.
Логарифмически нормальное распределение можно записать в виде:
|
1 |
− |
lg2 (dч / dm ) |
|
|
2 lg2 σч |
|
||
ξ = |
2π lgσч |
e |
|
|
где ξ - удельное содержание частиц с размерами dч;
dm – медианный размер частиц для данного распределения (размер, при котором количество частиц с размерами > dm равно количеству частиц с размерами < dm;
σч – среднеквадратичное отклонение в функции данного распределения.
Интегральная кривая для частиц с логарифмически нормальным распределением может быть записана в виде:
|
|
100 |
lgd |
ч |
|
− |
lg2 (dч / dm ) |
||
|
|
|
|
|
|
|
|||
R(dч ) = |
|
|
e |
2lg2 σч d(lgdч ) |
|||||
|
|
|
|
||||||
|
2π lgσч +∫∞ |
|
|
|
|
|
|||
Если прибегнуть к подстановке: |
|
|
|
|
|
|
|
||
t = |
lg(dч / dm ) |
, |
|
|
|
|
|
|
|
|
lgσч |
|
|
|
|
|
|
||
то уравнение примет вид: |
|
|
|
|
|
|
|
|
|
R(dч)= |
100 |
t |
e−t 2 / 2dt |
|
|
||||
|
|
|
|
||||||
|
|
2π lgσч +∫∞ |
|
|
, |
|
|||
где R(dч) - относительное содержание частиц с размерами, большими dч. Для частиц с логарифмически нормальным распределением интегральные кривые распределения частиц по размерам удобно строить в вероятност- но-логарифмической системе координат, в которой кривые приобретают вид
36
прямых линий. Для построения такой системы координат по оси абсцисс в логарифмическом масштабе откладывают значения dч , а по оси ординат – значения R(dч) или D(dч).
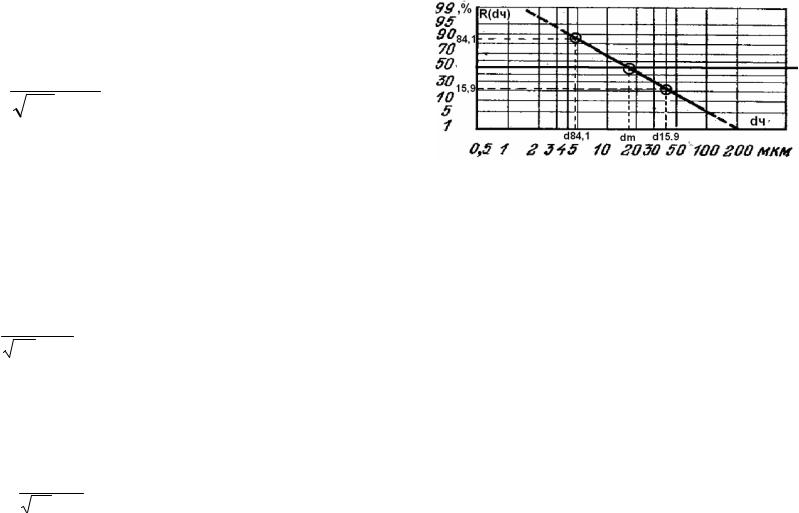
Рис.7.4. Интегральное распределение частиц по размерам в вероятност- но-логарифмической системе координат
В этом случае функцию распределения частиц по размерам можно выразить в виде двух параметров: dm. и lgσч.
Значение dm соответствует абсцисса точки пересечения полученной прямой с линией R(dч)=50%.
Значение lgσч находят из выражения, которое является свойством интеграла вероятности:
lgσч = lgd15,9 – lgdm = lgdm – lgd84,1 ,
где: lgd84,1 и lgd15,9 - абсциссы точек, ординаты которых имеют значения 84,1 и 15,9 соответственно.
При нарушении логарифмически нормального распределения дисперсный состав в вероятностно-логарифмических координатах не будет выражен прямой линией и описываться вышеприведенными уравнениями.
Для подобных случаев имеется ряд более общих формул.
7.3. Аутогезионные свойства пыли
Аутогезионные свойства (аутогезия – слипаемость) – характеризуют сцепление частиц пыли друг с другом.
Одной из наиболее распространенных неполадок пылегазоочистного оборудования является частичное или полное забивание аппаратов или их

37
отдельных элементов улавливаемым продуктом. Поэтому слипаемость является основным критерием определения области применения того или иного типа пылеуловителя.
Золу и пыль условно делят на 4 группы по степени слипаемости. В основе деления лежит значение разрывной прочности (силы сцепления между частицами) специально сформированных пылевых слоев (прибор Андрианова):
1.неслипающаяся, Р≤60Па; (глиноземная, доломитовая).
2.слабослипающаяся, 60<Р≤300Па;
3.среднеслипающаяся, 300<Р≤600Па;
4.сильнослипающаяся, Р>600Па.(цементная пыль с большим влагосодержанием).
7.4. Сыпучесть пыли
Сыпучесть пыли (тесно связана с понятием слипаемости) является исходным параметром для определения крутизны стенок бункеров пылегазоочистных аппаратов и диаметров выпускных отверстий.
Сыпучесть определяет статический и динамический угол естественного откоса.
Статический угол естественного откоса αст образуется в результате обрушения слоя частиц при удалении подпорной стенки. Определяется с помощью прибора – стеклянный прямоугольный сосуд, одна из стенок которого съемная. У заполненного пылью сосуда стенка удаляется, часть пыли высыпается. Оставшаяся в сосуде пыль имеет поверхность под некоторым углом к горизонту. Этот угол является статическим углом естественного откоса.
Динамический угол естественного откоса αдин представляет угол меж-
ду горизонтальной плоскостью и образующей конуса, полученного при насыпании пыли на плоскость.
Рис.7.5. Статический и динамический угол естествкеенного откоса
38
7.5. Абразивность пыли
Абразивность пыли – определяет износ внутренних поверхностей пылегазоочистных аппаратов. Зависит от твердости, размера, плотности и формы частиц. Оценивается по коэффициенту абразивности – определяется потерей веса образца, истираемого частицами, взвешенными в потоке воздуха.
7.6. Электрические свойства пыли
Удельное электрическое сопротивление (УЭС) [Ом*м] слоя пылиоми-
ческое сопротивление куба пыли со стороной, равной 1м, прохождению электрического тока. УЭС пыли влияет на эффективность работы установок электрической очистки газов, зависит от физико-химических свойств пыли, температуры, влажности.
Электрическая заряженность частиц (ЭЗЧ) – характеризуется идеаль-
ным избыточным зарядом на единицу массы пыли, [Ку/г]. ЭЗЧ влияет на эффективность улавливания частиц, аутогенные свойства и взрывоопасность пыли. Частицы пыли могут приобретать заряд при адсорбции ионов естественного происхождения, при трении друг о друга или о стенки газоходов.
7.7. Смачиваемость пыли
Смачиваемость пыли (СП)(%) – характеризует ее способность смачиваться водой. Определяют путем измерения доли смоченного и погрузившегося на дно сосуда порошка, насыпанного тонким слоем на поверхность воды (метод пленочной флотации). СП влияет на работу мокрых пылеуловителей. При соприкосновении с поверхностью жидкости несмачиваемые частицы остаются на поверхности, а смачиваемые погружаются в жидкость (гидрофобные и гидрофильные частицы). После заполнения поверхности жидкости пылинками очистка газов ухудшается, т.к. в результате упругого соударения (с ранее осевшими на поверхности жидкости частицами) частицы пыли возвращаются в поток газа и оказываются неуловленными.
По смачиваемости пыль классифицируют на три группы:
1.не смачиваемые -0÷30%;
2.средне смачиваемые -30÷80%;
3.хорошо смачиваемые – 80÷100%.

39
Многие виды пыли из-за сильно развитой поверхности частиц способны гореть, самовоспламеняться и образовывать с воздухом пожаро- и взрывоопасные смеси. Подобные свойства наблюдаются даже в том случае, когда исходный материал, из которого получена пыль, является негорючим.
7.8. Пожаро- и взрывоопасные свойства пыли
Основными характеристиками пожаро- и взрывоопасных свойств пыли являются:
Температура воспламенения – наименьшая температура горючего вещества, при которой скорость выделения горючих паров обеспечивает устойчивое горение после воспламенения от внешнего источника.
Температура самовоспламенения - наименьшая температура (смесь пыли с воздухом) при которой происходит резкое увеличение скорости экзотермических реакций, приводящее к возникновению пламенного горения.
Пыль, взвешенная в воздухе, может воспламеняться только при определенных концентрациях.
Диапазон воспламенения – область концентраций между верхним и нижним пределами воспламенения аэровзвесей твердых веществ в воздухе.
Воспламенение различают по скорости распространения фронта пла-
мени:
спокойное пламя – W=4÷10 м/с;
взрыв – W>100 м/с;
детонация - W>1000 м/с.
Взрыв характеризуется максимальным давлением (Рмах), которое возникает при взрыве наиболее пожаро-, взрывоопасной смеси в замкнутом сосуде. Рмах используют при расчете оборудования на взрывоустойчивость.
Взрыв может быть первичным и вторичным.
Первичный взрыв при наибольших скоплениях пыли вблизи источника воспламенения.
Вторичный взрыв – взрыв пыли, поднятой в воздух первичным взры-
вом.
8. Свойства газов
Газами, подлежащими очистке, как правило, являются воздух или дымовые газы. Свойства газов характеризуются следующими параметрами:
9химический состав;
9температура;
9давление;
9вязкость;
9плотность;
9удельная теплоемкость;
9энтальпия;
9влажность;
9запыленность;
9расход (массовый или объемный).
Плотность, вязкость, теплоемкость, газовая постоянная и другие существенные показатели для процессов пыле- и золоулавливания для воздуха и для дымовых газов, мало отличаются между собой. Поэтому при отсутствии данных для дымовых газов значения перечисленных величин могут быть приняты по табличным данным для воздуха.
8.1. Способы задания компонентного состава газов
Химический состав. Компонентный состав смеси n газов может быть задан массовыми или объемными долями (или процентами). Для определения и пересчета этих величин используют следующие соотношения:
|
|
g |
i |
= |
Gi |
= |
|
|
Vi ρi |
|
= r |
ρi |
|
= r |
M i |
|
|
|||||
|
|
|
Vсмρсм |
|
|
M см |
|
|||||||||||||||
|
|
|
|
|
Gсм |
i ρсм |
|
|
i |
|
||||||||||||
|
Vi |
|
|
|
Gi |
|
|
|
|
|
|
Gi * |
ρсм = g |
|
|
ρсм = g |
* M см |
|||||
r = |
= |
|
ρi |
|
Gсм |
|
= |
|
* |
|||||||||||||
|
|
|
|
|||||||||||||||||||
i |
Vсм |
|
|
|
|
|
|
|
|
Gсм |
ρi |
i |
|
ρi |
|
i |
M i |
|||||
|
|
|
|
|
|
ρсм |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
где Gi, Vi, ρi, Mi – масса, объем, плотность, молекулярная масса i-го компонента газовой смеси соответственно;
Gсм, Vсм, ρсм, Mсм – масса, объем, плотность, молекулярная масса газовой смеси соответственно
gi, ri – массовая и объемная доля i-го компонента смеси соответственно.
