
- •2. Марганец и его соединения. Биологическая роль.
- •3. Железо и его соединения. Биологическая роль.
- •4. Ионное произведение воды. Водородный показатель.
- •5. Силы Ван-дер-Вальса.
- •7. Упругость пара над раствором. Законы Рауля.
- •9. Ионная связь.
- •11. Кислородосодержащие кислоты хлора. Соли этих кислот. Биологическая роль.
- •12. Координационная теория Вернера.
- •13. Классификация и изомерия комплексных соединений.
- •15. Кислородосодержащие кислоты серы. Соли этих кислот.
- •16. Понятие о квантовой механике.
- •17. Многоэлектонные атомы и периодический закон.
- •18. Окисли азота.
- •19. Окислительно-восстановительные реакции.
- •20. Аммиак и его свойства.
- •21. Водородные соединения галогенов. 22. Галогеноводородные кислоты.
- •23. Метод молекулярных орбиталей.
- •25. Константа и степень электролитической диссоциации.
- •26. Азотная кислота и ее соли.
- •27. Гибридизация атомных орбиталей.
- •29. Периодичность изменения свойств элементов и их соединений.
- •30. Гидролиз.
- •32. Благородные газы.
- •35. Металлическая связь.
- •38. Современная химическая атомистика.
- •39. Осмос. Осмотическое давление. Закон Вант Гоффа.
- •41. Теория Бора.
- •43. Скорость химических реакций. Химическое равновесие.
- •44. Понятие об активном комплексе и энергии активации.
- •45. Серная кислота
- •46. Растворы. Растворимость как физико-химический прочес (гидратная теория, теория Менделеева).
25. Константа и степень электролитической диссоциации.
Количественно процесс диссоциации можно просчитать с помощью степени электролитической диссоциации (альфа) и константы электролитической диссоциации (k).
Факторы, влияющие на степень электролитической диссоциации:
1. Природа растворимого вещества.
2.Природа растворителя.
3. Температура.
4. Концентрация: разбавление раствора приводит к увеличению степени электролитической диссоциации.
5. Влияние одноименного иона, приводящее к уменьшению степени электролитической диссоциации: при введении, например, в раствор слабой уксусную кислоты, равновесие диссоциации ее соли (ацетата аммония) от влияния, создаваемого избытком ацетат ионов, созаваемого солью, смещается влево. (пример из тетради)
Растворы
диссоциации слабой уксусной кислоты:
CH3COOH=CH3COO-
+H+- равновесный
процесс. Поэтому к этому процессу можно
применить для рассчета понятия константы
химического равновесия: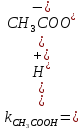
Как правило, константа диссоциации используется для количественной оценки диссоциации слабых электролитов.
Учитывая, что при электролитической диссоциации электролитов количество частиц в растворе растет, выше рассмотренные законы и следствия для растворов неэлектролитов в применении к электролитам несколько видоизменяются, например:
Закон
Вант-Гоффа для электролитов – росм= ί ·CRT, где ί- изотонический
коэффициент. Он представляет собой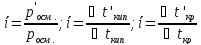 (
(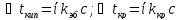
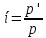 ,
где в числителе стоят экспериментально
измеренные значения величин для растворов
электролитов, а в знаменателе теоритически
рассчитанные значения по формулам для
растворов неэлектролитов той же
концентрации.
,
где в числителе стоят экспериментально
измеренные значения величин для растворов
электролитов, а в знаменателе теоритически
рассчитанные значения по формулам для
растворов неэлектролитов той же
концентрации.
26. Азотная кислота и ее соли.
Чистая азотная кислота HNO3 —бесцветная жидкость плотностью 1,51 г/см при - 42 °С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана.Получение в лаб:NaNO3+H2SO4=NaHSO4+HNO3\пром:кат.окисление аммиака кислородом до оксида азота 2,кот окисляют до 4,растворяют в горячей воде при избытке воздуха.
Получают
из оксида 4 и 5. NO2
– ядовитый газ бурого цвета, имеет
характерный запах. 2NO2+H2O→HNO2+N2O5
– бесцветные кристаллы, хорошо
растворяющиеся в воде с образованием
азотной кислоты:N2O5+H2O→ 2HNO3.Азотная
кислота не отличается прочностью.Уже
под влиянием света она постепенно
разлагается: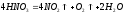 .Выделяющийся
диоксид азота растворяется в кислоте
и придает ей бурую окраску.С неМе.
.Выделяющийся
диоксид азота растворяется в кислоте
и придает ей бурую окраску.С неМе.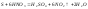 ,
,
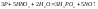 Азотная
кислота действует почти на все металлы
(искл неактив), превращая их в нитраты,
а некоторые металлы—в оксиды.Концентрированная
HNO3 пассивирует некоторые металлы.
Железо, легко растворяющееся в разбавленной
азотной кислоте, не растворяется в
холодной конц(так же на хром и алюминий)
.При реакциях с концентрированной
кислотой чаще всего выделяетсяNO2.
При взаимодействии разбавленной азотной
кислоты с малоактивными металлами,
например, с медью, выделяется NO. В случае
более активных металлов — железа, цинка,
— образуетсяN2O.
Сильно разбавленная азотная кислота
взаимодействует с активными
металлами—--цинком, магнием, алюминием
-— с образованием иона аммония, дающего
с кислотой нитрат аммония. Обычно
одновременно образуются несколько
продуктов.
Азотная
кислота действует почти на все металлы
(искл неактив), превращая их в нитраты,
а некоторые металлы—в оксиды.Концентрированная
HNO3 пассивирует некоторые металлы.
Железо, легко растворяющееся в разбавленной
азотной кислоте, не растворяется в
холодной конц(так же на хром и алюминий)
.При реакциях с концентрированной
кислотой чаще всего выделяетсяNO2.
При взаимодействии разбавленной азотной
кислоты с малоактивными металлами,
например, с медью, выделяется NO. В случае
более активных металлов — железа, цинка,
— образуетсяN2O.
Сильно разбавленная азотная кислота
взаимодействует с активными
металлами—--цинком, магнием, алюминием
-— с образованием иона аммония, дающего
с кислотой нитрат аммония. Обычно
одновременно образуются несколько
продуктов.
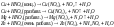
Выступая в качестве окислителя, НNО 3 может восстанавливаться до различных продуктов:

Смесь, состоящая из 1 объема азотной и 3—4 объемов концентрированной соляной кислоты, называется царской водкой, растворяет некоторые металлы золото.
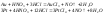
С избытком
соляной кислоты хлорид золота(III) и
хлорид платины (IV) образуют комплексные
соединения
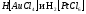
Нитраты.Соли азотной кислоты хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
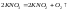 Нитраты
большинства:
Нитраты
большинства: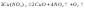
Наконец,
нитраты наименее активных металлов
(например, серебра, золота) разлагаются
при нагревании до свободного металла:
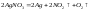
Применение:азотных удобрений,селитр, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.в медицине-для прижигания бородавок , соли - антисептического средства при жел.-киш. заболеваниях.
