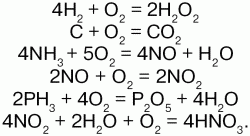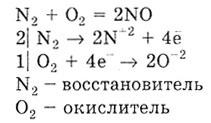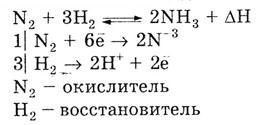chast_2
.docx
|
1. Комплексные соединения. Координационная теория Вернера. Классификация комплексных соединений. Комплексные соединения: строение, характер связи, диссоциация. Соединения сложного состава, у которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды), называются комплексными соединениями. Первые комплексные соединения были синтезированы в середине прошлого века, однако теоретические представления о них стали развиваться после опубликования в 1893 г. швейцарским химиком А. Вернером координационной теории. Большой вклад в химию комплексных соединений внесли русские ученые Л. А. Чугаев, И. И. Черняев и их ученики. По координационной теории Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферы. Внутреннюю сферу называют комплексом. При написании химических формул комплексных соединений внутреннюю сферу заключают в квадратные скобки. Центральный атом внутренней сферы комплексного соединения, вокруг которого группируются ионы или молекулы, называется комплексообразователем. Частицы, непосредственно связанные с комплексообразователем, называются лигандами. Число лигандов в комплексе называется координационным числом комплексообразователя. Координационное число показывает число мест во внутренней сфере комплексного соединения или число мест вокруг комплексообразователя, на которых могут разместиться лиганды. Координационные числа разных комплексообразователей имеют значения от 2 до 12. Чаще Других встречаются комплексные соединения с координационным числом, равным 4 или 6, затем 8 или 2. Заряд комплекса численно равен суммарному заряду внешней сферы и противоположен ему по знаку. Различают катионные, анионные и нейтральные комплексы. Комплекс с положительным зарядом называют катионным, с отрицательным зарядом — анионным, с нулевым зарядом — нейтральным. Заряд комплексообразователя равен и противоположен по знаку алгебраической сумме зарядов всех остальных ионов. Координационная емкость лиганда — число мест, занимаемых каждым лигандом во внутренней сфере комплекса. Лиганды, которые занимают одно координационное место у центрального атома, называют монодентатными. Однако лиганды могут занимать два и более (до восьми) координационных мест за счет образования с комплексообразователем соответствующего числа химических связей. Такие лиганды называются полидентатными. Комплексообразователи. Способность элемента к образованию комплексных соединений относится к важнейшим его химическим свойствам. Она зависит от строения внешнего электронного уровня атома элемента и определяется его положением в периодической системе Д. И. Менделеева. Как правило, комплексообразователями являются атомы или чаще ионы металлов, имеющие достаточное число свободных орбиталей. При образовании химических связей с лигандами комплексообразователи выполняют роль акцепторов. Возможность участия тех или иных орбиталей центрального атома в комплексообразовании меняется от периода к периоду. Способность элементов к комплексообразованию от периода к периоду растет. При последовательном переходе от одного периода к другому растет координационное число элементов. Лиганды. Лигандами в комплексных соединениях могут служить анионы F-, ОН", CN_, SCN-, N0^, С023 ", С2ОтГ и др.; нейтральные молекулы Н20, NH3, CO, NO, F2, N2H4, NH2—СН2— —СН2—NH2 (этилендиамин) и т. д. Почти все лиганды обладают одной или несколькими неподеленными парами электронов (NH3, Н20, F~, ОН"). Иногда роль лигандов играют молекулы, не содержащие неподеленных пар электронов, но имеющие электроны, участвующие в образовании л-связи. Донорные свойства лигандов реализуются за счет s- и р-атомных орбиталей, а акцепторные— за счет вакантных р- и d-орбиталей. Координационная теория Вернера — теория комплексных соед-ний, предложенная в 1893 г. Вернером. Согласно координационной теории в молекуле любого комплексного соед-ния один из ионов, обычно положит. заряженный, занимает центральное место и наз.комплексообразователем. Вокруг него в непосредственной близости расположено (координировано) некоторое число противоположно заряж.ионов или электронейтральных молекул, наз. лигандами (или аддендами), они образуют внутреннюю координационную сферу соединения. Остальные ионы, находящиеся на более далеком расстоянии от центральн.иона, образуют внешнюю координационную сферу. Напр., в комплексной соли K2[PtCl6] ион платины явл.комплексообразователем, ионы хлора — лигандами, во внешней координационной сфере находятся ионы калия. Классификация: 1.По заряду комплекса: 1) Катионные комплексы обр-ны в рез-те координации вокруг положит-го иона нейтральных мол-л (H2O, NH3 и др.). [(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II); [Co(NH3)6]Cl2 — хлорид гексоамминкобальта(II) 2) Анионные комплексы: в роли комплексообр-ля выступает атом с положит-ой степ ок-ия, а лигандами явлпростые или сложные анионы. K2[BeF4] — тетрафторобериллат(II) калия; Li[AlH4] — тетрагидридоалюминат(III) лития; K3[Fe(CN)6] — гексацианоферрат(III) калия 3) Нейтральные комплексы обр-ся при координации мол-л вокруг нейтрального атома, а так же при одновременной корд-ции вокруг положит-го иона — комплексообр-ля отриц-ых ионов и мол-л. [Ni(CO)4] — тетракарбонилникель; [Pt(NH3)2Cl2] — дихлородиамминплатина(II) 2.По числу мест занимаемых лигандами в координационной сфере:1) Монодентатные лиганды. Такие лиганды бывают нейтральными (мол-лы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.).2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной к-ты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−. 3) Полидентатные лиганды. Напр, комплексоны — органич-ие лиганды, сод-щие в своем составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комп-сы, образ-ые некот полидентатными лигандами, относят к хелатным (гемоглобин). 3)По природе лиганда: 1) Аммиакаты — комплексы, в кот лигандами служат мол-лы аммиака, напр: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.2) Аквакомплексы — в кот лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др. 3) Карбонилы — комплексные соед-ия, в кот лигандами явл мол-лы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].4) Ацидокомплексы — комплексы, в кот лигандами явл кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные к-ты: H2[CoCl4], H2[SiF6]. 5) Гидроксокомплексы — комплексные сое-ия, в кот в кач-ве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6].Изомерия компл-ых соед-ий. В статистическом аспекте стереохимии центр-ным оказ-ся явл-ие изомерии комплексных соед-ий. Св-во изомерии хим соед-ний было известно еще при разработке классической теории хим строения.Под изомерией понимают способ-ть к разному взаимному расположению атомов и атомных фрагментов в соед-ях одинакового общего состава, диктующую отличия в хим и физ св-вах соотв-щих соед-ий — изомеров. В случае комплексных соед-ий указанные различия м/б связаны как со спецификой распол-ия лигандов во внутр координационной сфере, так и с распределением лигандов м/д внутр и внешн сферами.Изомерия прямо связана с наличием или отсутствием в соед-ии тех или иных эл-тов симметрии: поворотных осей, зеркально-поворотных осей, центра и плоскостей симметрии. Существуют изомеры двух типов:1) соед-ия, в кот состав внутр сферы и строение комплексных лигандов идентичны (геометрические, оптические, конформационные, координационного положения);2) соед-ия, для кот возможны различия в составе внутр сферы и строении лигандов (ионизационные, гидратные, координационные, лигандные).Пространственная (геометрическая) изомерия.Этот вид изомерии вызван неодинаковым размещением лигандов во внутр сфере относительно др др. Необходимым усл геометр-кой изомерии явл наличие во внутр координац-ой сфере не менее 2х различных лигандов. Геометр-ая изомерия проявл-ся преимущественно у комплексных соед-ий, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды. С увелич-ем числа различных лигандов во внутр сфере растет число геометр-их изомеров. Оптическая изомерия связана со способностью некот комплексных соед-ий сущ-dать в виде 2х форм, не совмещаемых в 3хмерном простр-ве и явл-хся зеркальным отображ-ем друг друга, как левая рука и правая. Поэтому оптическую изомерию назыв иногда еще зеркальной изомерией. Структурная изомерия. Гидратная (сольватная) изомерия заключ-ся в различном распред-ии мол-л раств-ля м/д внутр и внеш сферами комплексного соед-ия, в различном харак-ре хим связи мол-л воды с комплексообразователем. Напр: [Cr(H2O)6]Cl3 (фиолетовый), [Cr(H2O)5Cl]Cl2 ∙ H2O (светло-зеленый), [Cr(H2O)Cl2]Cl ∙ 2H2O (темно-зеленый).Ионизационная изомерия опред-ся различным распред-ем заряженных лигандов м/д внутр и внеш сферами компл-са и харак-ет способ-ть компл-ных соед-ий с одним и тем же элементным сост давать в р-ре разные ионы. Примеры соед-ий: [Co(NH3)5Br]SO4 (красн-фиолет), [Co(NH3)5SO4]Br (красный).Координационная из-рия связана с переходом лигандов от одного комплексообраз-ля к другому: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6].
|
2. Изомерия координационных соединений. Устойчивость комплексных соединений. Константа нестойкости. Изомерия комплексных соединений 1. Гидратная (сольватная) изомерия. Обнаруживается в отдельных изомерах, когда распределение молекул воды между внутренней и внешней сферами оказывается неодинаковым. CrCl3 ∙ 6H2O: 1. [Cr(H2O)6]Cl3 + Ag+ (1); 2. [Cr(H2O)5Cl]Cl2 ∙ H2O + Ag+ (2/3); 3. [Cr(H2O)4Cl2]Cl ∙ 2H2O + Ag+ (1/3). Валовой состав всех изомеров одинаковый. Но в первом случае все шесть молекул воды находятся во внутренней сфере, во втором – пять, а в третьем – только четыре. Так как структура всех комплексов различна, различны и свойства. 2. Координационная изомерия. Встречается только у бикомплексных соединений. [Fe+3(NH3)6]+3 ∙ [Co+3(CN)6]-3 и [Co+3(NH3)6]+3 ∙ [Fe+3(CN)6]-3. 3. Ионизационная изомерия. Связана с различной легкостью диссоциации ионов из внутренней и внешней среды комплекса. [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2. Первая соль дает желтый осадок с раствором AgNO3. Вторая реагирует с раствором нитрата серебра с образованием белого творожистого осадка AgCl. (пример из тетради) 4. Изомерия связи. Возникает тогда, когда монодентатные лиганды могут координироваться через два разных атома. Например, ион NO2- может присоединяться к центральному атому через азот или через кислород. Это обусловливает существование у иридия, кобальта и некоторых других металлов двух изомеров: [(NH3)5 – Ir – NO2]Cl2 и [(NH3)5 – Ir – ONO]Cl2. Таким образом, изомерия связи может наблюдаться у амбидентатных лигандов, кторые содержат по крайней мере два разных атома с неподеленными электронными парами. 5. Пространственная (геометрическая) изомерия. Обусловлена тем, что одинаковые лиганды располагаются вокруг комплексообразователя либо рядом (цис-положение), либо напротив (транс-положение). Цис- и транс-изомеры отличаются друг от руга физическими и химическими свойствами. Устойчивость КСВ растворах комплексных соединений могут происходить разнообразные сложные превращения, определяемые природой как самого комплексного соединения, так и растворителя. Это,во-первых, диссоциация на комплексные и внешнесферные ионы, затем – диссоциация комплексного иона или нейтрального комплекса, сопровождаемая замещением лиганда во внутренней сфере на молекулы растворителя. Кроме того, комплексы могут участвовать в разнообразных окислительно-восстановительных процессах, если в состав комплексного иона или растворителя входят ионы или молекулы с ярко выраженными окислительными или восстановительными свойствами. 5.1. Комплексные соединения без внешней сферы Комплексные соединения можно условно разделить на две большие группы: электролиты и неэлектролиты. К неэлектролитам относят прежде всего внутрикомплексные соединения (или хелаты), затем – карбонилы металлов и -комплексы и некоторые другие. Растворимые комплексные соединения, не имеющие внешней сферы, ведут себя в растворах как слабые электролиты. 5.2. Отщепление ионов внешней сферы Комплексные соединения, имеющие ионную внешнюю сферу, в растворе подвергаются диссоциации на комплексный ион и ионы внешней сферы. Они ведут себя в разбавленных растворах как сильные электролиты: диссоциация протекает моментально и практически нацело. Примеры такого рода: [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42 K3[Fe(CN)6] = 3 K+ + [Fe(CN)6]3 Если во внешней сфере комплексного соединения находятся гидроксид-ионы, то это соединение – сильное основание (диссоциация идет нацело, рН 7). Пример соединения этого типа – гидроксид тетраамминцинка(II): [Zn(NH3)4](OH)2 = [Zn(NH3)4]2+ + 2 OH Комплексные соединения с внешнесферными катионами водорода (типа гексафторосиликата водорода или тетрафторобората водорода) в водном растворе нацело подвергаются протолизу. Они являются сильными кислотами: H[BF4] + H2O = [BF4] + H3O+ 5.3. Обратимая диссоциация комплексов Однако на отщеплении внешнесферных ионов процесс электролитической диссоциации не заканчивается. Комплексные ионы, в свою очередь, подвергаются обратимой электролитической диссоциации, уже как слабые электролиты, по схеме : [MLn] Такая диссоциация, разумеется, протекает ступенчато: лиганды удаляются из внутренней сферы постепенно, один за другим (точнее, происходит реакция замещения лиганда на молекулы растворителя - воды). Для упрощения записи в качестве примера взят незаряженный комплекс, а продукт диссоциации представлен в негидратированном виде. Аналогичным образом происходит и обратный процесс - образование комплекса. Сначала во внутренней сфере появляется один лиганд, затем второй, третий и так далее: M
+ L [ML]
+ L [ML2]
+ L ……. [ML(n1)]
+ L Процесс комплексообразования завершается, когда число присоединившихся монодентатных лигандов L станет равным координационному числу комплексообразователя M. При этом устанавливается динамическое равновесие, поскольку наряду с образованием комплексовидет и их диссоциация.
Полная константа образования комплекса bn(обр) характеризует устойчивость комплексного соединения: чем больше значение bn(обр), тем более устойчив комплекс данного состава. Например, сравнивая константы образования катиона диамминсеребра(I) и дицианоаргентат(I)-иона: (1)
Ag+ +
2 NH3 (2)
Ag+ +
2 CN- сделаем очевидный вывод о большей прочности второго комплекса – аниона [Ag(CN)2]- , поскольку, судя по большему значению константы образования, равновесие в реакции (2) сильнее сдвинуто вправо, чем в (1). Индекс n у константы образования комплекса равен координационному числу центрального атома в том комплексном соединении, которое оценивается. Нетрудно заметить, что величина bn(обр) связана со ступенчатыми константами образования Ki(обр) соотношением: b n(обр) = K1(обр) ´ K2(обр) ´ K3(обр) ´ … ´ Kn(обр) Константа нестойкости КС Если вместо равновесия в реакциях образования комплексов рассматривать обратный процесс – реакции диссоциации комплексов (или реакции обмена лигандов на молекулы растворителя), то соответствующие константы будут носить название ступенчатых констант нестойкости комплексов: [ML] [ML2] ……. [MLn] и общих (суммарных) констант нестойкости комплексов: [ML] [ML2] [ML3] ……. [MLn]
|
3. Природа химической связи в комплексных соединениях. Метод валентных связей. Пространственное строение и магнитные свойства комплексов. Первой теорией, объясняющей образование КС была теория ионной (гетерополярной) связиВ. Косселя и А. Магнуса: многозарядный ион – комплексообразователь (d-элемент) обладает сильным поляризующим действием; лиганды – легко поляризующиеся ионы или нейтральные молекулы. Между комплексообразователем и лигандом возникают электростатические силы притяжения, которые вызывают деформацию электронных облаков комплексообразователя и лигандов и их взаимное перекрывание. В результате действия электростатических сил притяжения и отталкивания в КС образуется устойчивая группировка атомов, обладающая минимальной потенциальной энергией и определённым образом ориентированная в пространстве. С одной стороны теория объяснила линейную структуру при к.ч.=2, плоский треугольник при к.ч.=3, тетраэдр при к.ч.=4, правильный октаэдр при к.ч.=6. Согласно этой теории наиболее прочные комплексные соединения образуют ионы с большим зарядом и малым радиусом. С другой стороны она не объясняла существование неполярных лиганд и комплексообразователей с нулевой степенью окисления, а также магнитные и оптические свойства КС. Для объяснения образования и свойств комплексных соединений в настоящее время применяются теория валентных связей (ВС), теория кристаллического поля (ТКП) и теория молекулярных орбиталей (МО). В нач. 30-х г.г. XX в. Л. Полинг применил метод валентных связей, основные принципы которого сводились к следующему: - связь между комплексообразователем и лигандом осуществляется по донорно-акцепторному механизму (комплексообразователь имеет свободные орбитали – акцептор электронов, лиганды – доноры электронных пар); - орбитали комплексообразователя подвергаются гибридизации, определяющей пространственную геометрию КС; - наряду с s-связями между комплексообразователем и лигандом (электронная плотность смещена к комплексообразователю) образуются p-связи (электронная плотность смещена к лигандам). Если на d- подуровне центрального атома нет или присутствует 10 электронов, то такой подуровень имеет сферическую электрическую симметрию. Лиганды на поверхности сферы независимо от своего положения находятся под действием одинаковых электростатических сил. В этом случае d- электроны не будут оказывать влияния на положение, занимаемое лигандом. Комплексы с «внешней» гибридизацией более лабильны, обладают повышенной реакционной способностью. МВС ограничивается качественными объяснениями строения и свойств комплексных соединений.
|
|
|
4. Теория кристаллического поля. Окраска комплексных соединений. Понятие о ММО. Теория кристаллического поля — квантовохимическая модель, в которой электронная конфигурация соединений переходных металлов описывается как состояние иона либо атома, находящегося в электростатическом поле, создаваемым окружающими его ионами, атомами или молекулами. Концепция кристаллического поля была предложена Беккерелем для описания состояния атомов в кристаллах и затем развита Хансом Бете и Джоном Ван Флеком для описания низших состояний катионов переходных металлов, окруженных лигандами — как анионами, так и нейтральными молекулами. Теория кристаллического поля была в дальнейшем объединена [и усовершенствована] с теорией (делокализованных) молекулярных орбиталей в более общую теорию поля лигандов, учитывающую частичнуюковалентность связи металл-лиганд в координационных соединениях[1]. Теория кристаллического поля позволяет предсказать или интерпретировать оптические спектры поглощения и спектры электронного парамагнитного резонансакристаллов и комплексных соединений, а также энтальпий гидратации и устойчивости в растворах комплексов переходных металлов. Обзор теории кристаллического поля[править | править вики-текст] Согласно ТКП, взаимодействие между переходным металлом и лигандами возникает вследствие притяжения между положительно заряженным катионом металла и отрицательным зарядом электронов на несвязывающих орбиталях лиганда. Теория рассматривает изменение энергии пяти вырожденных d-орбиталей в окружении точечных зарядов лигандов. По мере приближения лиганда к иону металла, электроны лиганда становятся ближе к некоторым d-орбиталям, чем к другим, вызывая потерю вырожденности. Электроны d-орбиталей и лигандов отталкиваются друг от друга как заряды с одинаковым знаком. Таким образом, энергия тех d-электронов, которые ближе к лигандам, становится выше, чем тех, которые дальше, что приводит к расщеплению уровней энергии d-орбиталей. На расщепление влияют следующие факторы: Природа иона металла. Степень окисления металла. Чем выше степень окисления, тем выше энергия расщепления. Расположение лигандов вокруг иона металла. Природа лигандов, окружающих ион металла. Чем сильнее эффект от лигандов, тем больше разность между высоким и низким уровнем энергии. Самый распространённый вид координации лигандов — октаэдрическая, при которой шесть лигандов создают кристаллическое поле октаэдрической симметрии вокруг иона металла. При октаэдрическом окружении иона металла с одним электроном на внешней оболочке d-орбитали разделяются на две группы с разностью энергетических уровней Δокт (энергия расщепления), при этом энергия у орбиталей dxy, dxz и dyz будет ниже, чем у dz2 и dx2-y2, так как орбитали первой группы находится дальше от лигандов и испытывают меньшее отталкивание. Три орбитали с низкой энергией обозначаются как t2g, а две с высокой — как eg. Следующими по распространённости являются тетраэдрические комплексы, в которых четыре лиганда образуют тетраэдр вокруг иона металла. В этом случае d-орбитали также разделяются на две группы с разностью энергетических уровней Δтетр. В отличие от октаэдрической координации, низкой энергией будут обладать орбитали dz2 и dx2-y2, а высокой — dxy, dxz и dyz. Кроме того, так как электроны лигандов не находятся непосредственно в направлении d-орбиталей, энергия расщепления будет ниже, чем при октаэдрической координации. С помощью ТКП также можно описать плоскоквадратную и другие геометрии комплексов. Разность энергетических уровней Δ между двумя или более группами орбиталей зависит также от природы лигандов. Некоторые лиганды вызывают меньшее расщепление, чем другие, причины чего объясняет теория поля лигандов. Спектрохимический ряд — полученный опытным путём список лигандов, упорядоченных в порядке возрастания Δ:[2] I− < Br− < S2− < SCN− < Cl− < NO3− < N3− < F− < OH− < C2O42− < H2O < NCS− < CH3CN < py < NH3 < en < bipy < phen < NO2− < PPh3 < CN− < CO Степень окисления металла также влияет на Δ. Металл с более высокой степенью окисления ближе притягивает лиганды за счёт большей разности зарядов. Лиганды, находящиеся ближе к иону металла, вызывают большее расщепление. Окраска КС Важнейшим достижением теории кристаллического поля является в ряде случаев удовлетворительное объяснение причин той или иной окраски комплексных соединений. То, что поглощение света имеет какую-то связь с d- электронами, наглядно показывает табл. 3, в которой указана окраска гексааквакомплексов ионов металлов IV периода [Ме(Н2О)6]n+.. Поглощение света комплексными соединениями d- элементов теория кристаллического поля объясняет переходом электронов с t2g -подуровня на eg -подуровень в октаэдрических комплексах и с eg -подуровня на t2g -подуровень в тетраэдрических комплексах. При этом поглощается квантсвета, энергия которого равна энергии расщепления: hn=D, где h- постоянная Планка, n- частота колебаний. Энергия расщепления, таким образом, оказывается математически связана с частотой колебания света в максимуме поглощения и, следовательно, с длиной волны максимума поглощения: n=D/h и l=с/n, где с- скорость света. Окраска комплекса зависит от его состава и строения, и определяется длиной волны l max , отвечающей максимуму полосы поглощения и интенсивностью полосы. В спектрах поглощения комплексных соединений d- элементов имеются полосы поглощения низкой интенсивности, которые проявляются в видимой области, а иногда несколько сдвинуты в фиолетовую область. Их появление связано с электронными переходами в незаполненных d- орбиталях. Изъятие из потока света, падающего на поглощающее свет вещество, части энергии, отвечающей поглощённой длине волны, приводит к тому, что возникает окрашивание, соответствующее действию на глаз человека непоглощённых длин волн. Например, из солнечного спектра раствором [Ti(H2O)6]3+ поглощаются зелёные волны, поэтому мы воспринимаем растворы комплексов Ti3+ как имеющие красно-фиолетовое окрашивание. Оранжевое окрашивание комплекса [Co(NH3)6]3+ указывает на поглощение в сине-фиолетовой части спектра, т.е. в области коротких волн и, следовательно, расщепление для этого комплекса -большая величина (комплекс низкоспиновый). Голубое окрашивание комплекса [CoF6]3- означает, что он поглощает энергию в жёлто-красной, т.е. длинноволновой части спектра. Величина расщепления в этом Понятие о ММО ММО – это квантово-механический метод описания ХС, согласно которому молекула рассматривается как «многоядерный» атом с электронами, находящимися на молекулярных орбиталях (МО), т.е. молекула состоит не из отдельных атомов, а рассматривается как совокупность всех ядер и электронов (метод делокализованных связей, в отличие от МВС – метода локализованных связей). Каждая МО описывает состояние отдельных электронов в поле всех ядер и усредненном поле остальных электронов. Подобно тому как для атома строится система АО, которые заполняются электронами, так и для молекулы в рамках ММО нужно сначала построить систему МО, которые затем заполняются электронами. Построение системы МО основывается на следующих положениях. 1. Электроны в молекуле находятся на МО, которые в отличие от атомных являются многоцентровыми и охватывают весь атом. Таким образом, МО характеризует состояние электрона в молекуле. 2. Молекулярная орбиталь находится в результате сложения (связывающая орбиталь) или вычитания волновых функций атомных орбиталей (разрыхляющая орбиталь). Поэтому ММО более точно называют методом ЛКАО –МО. 3. АО могут образовывать МО, если энергии АО близки по величине и имеют приблизительно одинаковую симметрию отностительно оси связи. 4. Каждая МО характеризуется набором трех квантовых чисел. Четвертое (спиновое) и принцип Паули определяют максимально возможное число электронов на МО. 5. Число МО равно сумме АО (принцип сохранения орбиталей). 6. При образовании МО энергия системы уменьшается; такая МО называется связывающей МО. При увеличении энергии системы образуются разрыхляюшие МО. Промежуточное состояние между связывающими и разрыхляющими МО называется несвязывающие МО. По энергетике они близки к АО.
|
5. Периодический закон как основа химической систематики. Групповая, типовая, полная электронная аналогия. Большие и малые периоды. Группа- совокупность элементов с одинаковым числом валентных электронов, т.е. электронов на орбиталях высшего уровня и на недостроенных внутренних подуровнях. Внутренняя периодичность – немонотонность изменения свойств элементов в пределах периода. Вторичная периодичность – немонотонность изменения свойств элементов в пределах подгруппы. Период- совокупность элементов, расположенных в порядке возрастания зарядов их ядер, в атомах которых электроны распределены по одному и тому же числу энергетических уровней. Периодическая система – это графическое воплощение Периодического закона. Периодический закон Д.И. Менделеева: свойства простых тел, а также формы и свойства их соединений находятся в периодической зависимости от атомных весов элементов. Подгруппа- совокупность элементов с одинаковым числом валентных электронов, распределенных на орбиталях одного и того же типа. Электронное семейство – совокупность элементов, у которых заполняется электронами орбитали подуровней одного типа. Соответственно различают семейства s-, p-, d- и f-элементов. Атомные радиусы; изменение в периодах и подгруппах.С увеличением порядкового номера в периодах атомные радиусы монотонно уменьшаются, а в подгруппах увеличиваются. Энергии ионизации; изменение в периодах и подгруппах. Энергия ионизации - это энергия, необходимая для отрыва электрона от атомной частицы. С увеличением порядкового номера в периодах энергия ионизации увеличивается, а в подгруппах – уменьшается. Групповая аналогия, групповые аналоги. Групповая аналогия проявляется у элементов, входящих в одну группу периодической системы. Групповые аналоги – это элементы одной группы Периодической системы, имеющие одинаковое число валентных электронов. Типовая аналогия и типовые аналоги. Типовая аналогия проявляется в A-, B- и C-подгруппах периодической системы. Типовые аналоги характеризуются одинаковым числом валентных электронов, распределенных на орбиталях одного типа. Электронные аналоги -элементы, имеющих сходные электронные формулы. Полные электронные аналоги имеют сходные электронные формулы во всех степенях окисления, неполные – только в некоторых, включая нулевую. Современная формулировка периодического закона: свойства элементов находятся в периодической зависимости от заряда ядер их атомов. Сродство к электрону. Изменение в периодах и подгруппах. Сродство к электрону - это энергетический эффект присоединения электрона к атомной частице. С увеличением порядкового номера в периоде сродство к электрону немонотонно увеличивается, в подгруппе – уменьшается. Электроотрицательность элемента – способность его атома к оттягиванию электронной плотности при образовании химической связи. Горизонтальные ряды элементов, в пределах которых свойства элементов изменяются последовательно, Менделеев назвал периодами (начинаются щелочным металлом (Li, Na, K, Rb, Cs, Fr) и заканчиваются благородным газом (He, Ne, Ar, Kr, Xe, Rn)). Исключения: первый период, который начинается водородом и седьмой период, который является незавершённым. Периоды разделяются на малые и большие . Малые периоды состоят из одного горизонтального ряда. Первый, второй и третий периоды являются малыми, в них находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды). Большие периоды состоят из двух горизонтальных рядов. Четвёртый, пятый и шестой периоды являются большими, в них находятся 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Верхние ряды больших периодов называются чётными , нижние ряды – нечётными. В шестом периоде лантаноиды и в седьмом периоде актиноиды располагаются в нижней части периодической системы. В каждом периоде слева направо металлические свойства элементов ослабевают, а неметаллические свойства усиливаются. В чётных рядах больших периодов находятся только металлы. В результате в таблице имеется 7 периодов, 10 рядов и 8 вертикальных столбцов, названных группами – это совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и в других соединениях. Эта валентность равна номеру группы. Группы - вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Каждая группа состоит из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов. Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого. В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами.
|
6. Водород. Положение в периодической системе. Физические и химические свойства. Водород (Н) – 1-й элемент периодической системы Менделеева – I и VII группа, главная подгруппа, 1 период. На внешнем s1-подуровне имеется 1 валентный электрон и 1 s2-подуровень свободный, отчего Н обладает двойной природой: в одних случаях он отдает электрон (восстановительные свойства), в других – принимает (окислительные свойства); электронная конфигурация – 1s1. Физические свойства: Н2 – бесцветный газ, без запаха, самый легкий из всех газов. Химические свойства: связь в молекуле Н2 – ковалентная неполярная. Энергия ионизации водорода высока, поэтому водород не образует ионных соединений. В обычных условиях молекула водорода очень устойчива – очень высокая энергия диссоциации и связи. Соединения водорода с другими элементами носят ковалентный характер. В соединениях Н всегда одновалентен, степень окисления с неметаллами +1, металлами -1. При высокой температуре водород взаимодействует с щелочными и щелочно-земельными металлами, образуя гидриды:
Связь в гидридах частично ионная. С галогенами Н реагирует по-разному: с F на холоде со взрывом:
С Cl при нагревании или на свету реакция идет со взрывом по цепному механизму, разлагая атомы на радикалы:
Синтезом Н с N получают аммиак:
Особо активен атомарный H. Он реагирует с кислородом без поджигания: 2Н + О2 = Н2О2. Получение: в лаборатории:
Или электролизом воды с добавлением NаОН. В промышленности Н получают: а) конверсией воды:
б) конверсией СН4:
в) кислородной конверсией:
г) нагреванием СН4:
|
|
|
7. Вода. Строение, особенности физических и химических свойств. Пероксид водорода. Из оксидов водорода самым распространенным на Земле является вода (Н2О). Молекулярная масса – 18. Строение молекулы воды (структурная формула):
Молекулы воды имеют треугольную формулу: атомы водорода образуют с атомом кислорода угол, равный 104,3 %. Вблизи атома кислорода образуется отрицательно заряженное поле, т. к. наибольшая электронная плотность сосредотачивается на атоме кислорода, а вблизи атомов водорода образуется положительно заряженное поле – молекула воды – диполь. Вследствие полярности молекулы воды ассоциируют, образуя водородные связи. Физические свойства: вода – бесцветная жидкость, без вкуса и запаха. При 100 °C и нормальном давлении водородные связи рвутся, и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость. Химические свойства: вода незначительно диссоциирует:
В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:
Взаимодействует со многими основными оксидами, металлами:
С кислотными оксидами:
Получение: вода образуется при горении водорода в кислороде: 2Н2 + О2 = 2Н2О Смесь двух объемов водорода и одного объема кислорода называется гремучей смесью. Методом перегонки получают чистую воду – дистиллированную воду. Пероксид, или перекись водорода – кислородное соединение водорода (перекись). Формула: Н2О2 Физические свойства: перекись водорода – бесцветная сиропообразная жидкость, относится к числу очень слабых, т. к. в очень малой степени диссоциирует: по I ступени:
по II ступени:
Химические свойства: при взаимодействии концентрированного раствора Н2О2 с гидроксидами металлов образуются их пероксиды: Na2O2, CaO, MgO2 и др.
Более характерны для него окислительные свойства.
Н2О2 здесь выступает окислителем.
В этих случаях пероксид водорода является восстановителем. Получение: в промышленности H2O2 получают взаимодействием разбавленной серной кислотой с пероксидом бария ВаО2: H2SO4(разб.) + ВаО2= ВаSO4 + H2O2. |
8. Общая характеристика халькогенов. Сера, ее физические и химические свойства. К элементам VI главной подгруппы периодической системы элементов Д. И.Менделеева относятся кислород (О), сера (S), селен (Se), теллур (Te) и полоний (Ро). Групповое название этих элементов — Халькогены В основном состоянии атомы халькогенов имеют электронную конфигурацию ns2np4 С двумя неспаренными р-электронами. В соединениях серы, селена, теллура с кислородом и галогенами реализуются степени окисления +6, +4 и +2. С большинством других элементов они образуют халькогениды, где находятся в степени окисления -2. Сера (S) в природе встречается в соединениях и свободном виде. Для получения серы основным источником служит железный колчедан (пирит) FeS2. Газовую серу получают из газов, образованных при коксовании и газификации угля. Сера находится в VI группе третьего периода периодической системы. Имеет на внешнем электронном слое атома шесть электронов. Проявляет степень окисления от -2 до +6. Сера не растворима в воде, но растворима в органических растворителях. Является диэлектриком. Сера – неметалл с типичными для него свойствами. Взаимодействует со многими металлами непосредственно (медью, железом, цинком), выделяя при этом теплоту. Взаимодействует также с большинством неметаллов, за исключением азота и йода. Химические свойства: 1) при нагревании сера реагирует с водородом, образуя сероводород: S + Н2 = H2S; 2) взаимодействуя с металлами, сера образует сульфиды: S + Fe = FeS; 2Al + 3S = Al2S3; 3) при сжигании серы в струе кислорода образуется сернистый газ или сернистый ангидрид SO2: S + O2 = SO2; 4) чистая сера способна проявлять восстановительные свойства: S + 2HNO3 = H2SO4 + 2NO.
|
9. Кислород, его физические и химические свойства. Кислород в положительных степенях окисления. Озон. Кислород (О) стоит в 1 периоде, VI группе, в главной подгруппе. р- элемент. Электронная конфигурация 1s22s22p4. Число электронов на внешнем уровне – 6.. Валентность кислорода 2, степень окисления -2. Физические свойства: кислород (О2) – бесцветный газ, без запаха и вкуса; в воде малорастворим, немного тяжелее воздуха. Химические свойства: Благодаря химической активности кислород взаимодействует почти со всеми простыми веществами. С металлами образует оксиды и пероксиды:
Кислород не реагирует только с платиной. При повышенных и высоких температурах реагирует со многими неметаллами:
Непосредственно кислород не взаимодействует с галогенами. Кислород реагирует со многими сложными веществами:
Кислороду характерны реакции горения:
При окислении кислородом уксусного альдегида получают уксусную кислоту:
Получение: в лаборатории: 1) электролизом водного раствора щелочи: при этом на катоде выделяется водород, а на аноде – кислород; 2) разложением бертолетовой соли при нагревании: 2КСlО3?2КСl + 3О2?; 3) очень чистый кислород получают: 2КМnO4? К2МnO4 + МnО2 + О2?. Озон и его свойства Озон (О3) – одна из аллотропных модификаций кислорода. Строение молекулы: озон имеет нелинейное строение молекулы с углом между атомами 117°. Молекула озона обладает некоторой полярностью, диамагнитна, так как не имеет неспаренных электронов. Физические свойства: озон – синий газ, имеющий характерный запах. Химические свойства: озон – сильный окислитель, он окисляет все металлы, в том числе золото – Au и платину – Pt . Большинство неметаллов, переводит низшие оксиды в высшие, а сульфиды их металлов – в их сульфаты:
Йодид калия озон окисляет до молекулярного йода:
Но с пероксидом водорода Н2О2 озон выступает в качестве восстановителя:
Получение: получают озон в озонаторах путем пропускания через кислород или воздух электрические искры. Образование озона из кислорода:
|
|
|
10. Сероводород. Политионовые кислоты. Сероводород (H2S) – бесцветный газ с резким запахом гниющего белка. Получение: 1) прямой синтез из элементов, при температуре 600 °C; 2) воздействием на сульфиды натрия и железа соляной кислотой. Физические свойства: сероводород тяжелее воздуха, очень ядовит. Легко воспламеняется на воздухе. Химические свойства: сероводород – сильный восстановитель, в зависимости от условий (температура, pH раствора, концентрация окислителя) при взаимодействии с окислителями он окисляется до диоксида серы или серной кислоты: 1) горит голубоватым пламенем на воздухе:
2) при высокой температуре разлагается:
3) вступает в реакцию с галогенами:
4) взаимодействует с окислителями:
5) серебро при взаимодействии с сероводородом темнеет:
|
11. Соединения серы в степени окисления +4. Наибольшее значение имеет оксид серы(IV) - бесцветный газ с резким неприятным запахом горящей серы. Молекула SO2 имеет угловое строение (угол OSO равен 119,5 °):
В промышленности SO2 получают обжигом пирита или сжиганием серы. Лабораторный метод получения диоксида серы - действие сильных минеральных кислот на сульфиты. Na2SO3 + 2HCl = 2NaCl + SO2 + H2O Оксид серы(IV) является энергичным восстановителем S+4O2 + Cl2 = S+6O2Cl2, но, взаимодействуя с сильными восстановителями, может выступать в роли окислителя: 2H2S + S+4O2 = 3S0 + 2H2O Диоксид серы хорошо растворим в воде. В водном растворе гидратированные молекулы SO2 частично диссоциируют с образованием катиона водорода: SO2×H2O
Тем не менее, соли сернистой кислоты устойчивы и могут быть выделены в индивидуальном виде: SO2 + NaOH = NaHSO3; SO2 + 2NaOH = Na2SO3 гидросульфит натрия сульфит натрия Сульфиты щелочных металлов хорошо растворимы в воде, в значительной мере гидролизованы: SO32-
+ H2О
Сильные восстановители, при хранении их растворов постепенно окисляются кислородом воздуха, при нагревании диспропорционируют: t 2Na2S+4O3 + О2 = 2Na2S+6O4; 4Na2S+4O3 = Na2S-2 + 3Na2S+6O4 Степень окисления +4 проявляется в галогенидах и оксогалогенидах: SF4 SOF2 SOCl2 SOBr2 фторид серы(IV) оксофторид серы(IV) оксохлорид серы(IV) оксобромид серы(IV) Фторид серы(IV) - бесцветный газ. Оксохлорид серы(IV) (хлористый тионил, тионилхлорид) - бесцветная жидкость с резким запахом. Эти вещества широко применяются в органическом синтезе для получения фтор- и хлорорганических соединений. Соединения данного типа имеют кислотный характер о чем свидетельствует их отношение к воде: SF4 + 3H2О = H2SO3 + 4HF; SOCl2 + 2H2О = H2SO3 + 2HCl. |
12. Оксид серы (+6). Серная кислота, ее строение и свойства. Оксид серы (VI) получают окислением SO2 кислородом только в присутствии катализатора: 2SO2+ O2Û2SO3+Q. Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что хороший выход SO3(т.е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции. Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту: SO3+H2O=H2SO4 Структурная формула серной кислоты
Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Серная кислота является энергичным окислителем; её окислительные свойства проявляются при взаимодействии со многими веществами. Взаимодействие серной кислоты с металлами проходит различно в зависимости от её концентрации. Разбавленная серная кислота окисляет своим ионом водорода. Из-за этого она взаимодействует только с теми металлами, которые стоят в ряду напряжений до водорода, например: Zn + H2SO4 = ZnSO4 + H2. Концентрированная серная кислота является окислителем за счёт серы. Она окисляет металлы, стоящие в ряду напряжений до серебра включительно. При взаимодействии с малоактивными металлами, например, с медью, кислота восстанавливается до SO2: Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O. При взаимодействии с более активными металлами продуктами восстановления могут быть как SO2, так и свободная сера и сероводород. Так, при взаимодействии с цинком могут протекать реакции: Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O 3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O 4ZN + 5H2SO4 = 4ZnSO4 + H2S + 4H2O. Химические свойства серной кислоты. Химические свойства серной кислоты такие: Взаимодействие с металлами: разбавленная кислота растворяет только те металлы, которые стоят левее водорода в ряду напряжений, например H2+1SO4+ Zn0 = H2O + Zn+2SO4; окислительные свойства серной кислоты велики. При взаимодействии с различными металлами (кроме Pt, Au) она может восстанавливаться до H2S-2 , S+4O2 или S0, например: 2H2+6SO4 + 2Ag0 = S+4O2 + Ag2+1SO4 + 2H2O; 5H2+6SO4 +8Na0 = H2S-2 + 4Na2+1SO4 + 4H2O; Концентрированная кислота H2S+6O4также реагирует (при нагревании) с некоторыми неметаллами, превращаясь при этом в соединения серы с более низкой степенью окисления, например: 2H2S+6O4 + С0 = 2S+4O2 + C+4O2 + 2H2O; 2H2S+6O4 + S0 = 3S+4O2 + 2H2O; 5H2S+6O4 + 2P0 = 2H3P+5O4 + 5S+4O2 + 2H2O; С основными оксидами: H2SO4 + CuO = CuSO4 + H2O; С гидроксидами: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O; 2NaOH + H2SO4 = Na2SO4 + 2H2O; Взаимодействие с солями при обменных реакциях: H2SO4 + BaCl2 = 2HCl + BaSO4; Образование BaSO4 (белого осадка, нерастворимого в кислотах) используется для определения этой кислоты и растворимых сульфатов. |
|
|
13. Общая характерисика элементов 5 группы. Азот и фосфор как простые вещества. Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi). Общая электронная формула элементов подгруппы азота: ns2np3 . У каждого последующего нижестоящего атома нарастает энергетический уровень (N – 2s22p3; P – 3s23p3; As – 4s24p3; Sb – 5s25p3; Bi – 6s26p3), в связи с чем увеличивается радиус атома, уменьшается энергия ионизации, энергия сродства к электрону, электроотрицательность, ослабевают неметаллические свойства – усиливаются металлические. Характерны следующие степени окисления: N – +1, +2, +3, +4, 0, -1, -3, -5; P – от +1 до +5 (кроме +2), 0, -2, -3; все остальные: +3, +5, -3. Характерные валентности: 3, 4, 5. 1. Химические свойства азота. а) С кислородом азот peaгирует только при температуре электрической дуги (> 3000°С)
б) С водородом азот реагирует как окислитель. Реакция экзотермическая и обратимая. Это одна из реакций промышленного синтеза аммиака:
Чтобы максимально сместить равновесие в сторону образования аммиака (синтез аммиака) в промышленных установках используют давление 30 МПа и температуру 450-550°С. По принципу Ле-Шателье температуру следует понижать, чтобы сместить равновесие вправо, но при таком высоком давлении понижение температуры замедлит и прямую, и обратную реакцию. 450—550°С — это оптимальная температура. Фосфор (Р) находится в 3-м периоде, в V группе, главной подгруппы периодической системы Д.И. Менделеева. Порядковый номер 15, заряд ядра +15. У фосфора появляется d-подуровень. Электронная конфигурация Р: 1s22s22p63s23p33d0. Характерна sp3-гибридизация, реже sp3d1. Валентность фосфора – III, V. Наиболее характерная степень окисления +5 и -3, менее характерные: +4, +1, -2, -3. Фосфор может проявлять и окислительные и восстановительные свойства: принимать и отдавать электроны. Физические свойства: фосфор образует три аллотропных модификации: белый, красный и черный. Каждая модификация имеет свою температуру плавления и замерзания. Химические свойства: 1) при нагревании Р4 обратимо диссоциирует:
2) свыше 2000 °C Р2 распадается на атомы:
3) фосфор образует соединения с неметаллами:
Непосредственно соединяется со всеми галогенами: 2Р + 5Cl2 = 2РCl5. При взаимодействии с металлами фосфор образует фосфиды:
Соединяясь с водородом, образует газ фос-фин: Р4 + 6Н2 = 4РН3. При взаимодействии с кислородом образует ангидрид Р2О5: Р4 + 5О2 = 2Р2О5. Получение: фосфор получают прокаливанием смеси Са3(РO4)2 с песком и коксом в электропечи при температуре 1500 °C без доступа воздуха: 2Са3(РO4)2 + 1 °C + 6SiO2 = 6СаSiO3 + 1 °CO + P4. В природе фосфор в чистом виде не встречается, а образуется в результате химической активности. Основными природными соединениями фосфора являются минералы: Са3(РO4)2 – фосфорит; Са3(РO4)2, СаF2 (или СаCl) или Са3(РO4)2, Са(ОН)2 – апатит.
|
14. Аммиак, его строение и свойства. Синтез аммиака. Физические свойства: аммиак (NH3) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха; Раствор NH3 в воде – аммиачная вода или нашатырный спирт. Медицинский нашатырный спирт – 10 %. При низкой температуре образует в растворе кристаллогидрат NH3 * Н2О. Строение молекулы: характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода. Молекула имеет форму правильной пирамиды, в вершине которой стоят атомы азота, а в углах – водорода. Химические свойства: 1) при растворении NH3 в воде образуются гидратированные молекулы аммиака и частично ионы аммония – NH4+ и ОН-ионы – водный раствор аммиака имеет слабощелочную реакцию. 2) NH3 взаимодействует с кислотами: NH3 + Н2SO4 = NH4НSO4; 3) аммиак – сильный восстановитель. Из СuО при нагревании восстанавливает Сu: 3СuО + 2NH3 = Сu + N2 + 3Н2О; 4) в кислороде NH3 горит желтым пламенем: 4NH3 + 3О2 = 2N2 + 6Н2О; 5) кислородом воздуха NH3 окисляется в присутствии катализаторов: Pt, Cr2O3, Rh: 4NH3 + 5О2 = 4NО? + 6Н2О; 6) при замещении водорода на металлы образуются амиды: Na + NH3 = NaNH2 + 1/2 Н2; 7) водород в NH3 может замещаться на галогены. При действии на раствор хлорида аммония газообразным хлором образуется хлорид азота: NH4Cl + 3Cl2 = 4HCl + NCl3. Получение: в промышленности циамидный способ, основанный на способности азота при высокой температуре взаимодействовать с карбидом кальция, образуя циамид кальция CaCN2, который при воздействии с водяным паром при давлении 0,6 МПа легко разлагается на аммиак и карбонат кальция:
Позднее появился другой способ получения аммиака – прямое взаимодействие азота и кислорода под воздействием электрических разрядов, но эта реакция была обратимой, пока для нее не нашли оптимальные условия.
|
15. Оксиды азота. Азотная кислота. С кислородом N образует оксиды: N2O, NO, N2O3 NO2, N2O5 и NO3. Оксид азота I – N2O – закись азота, «веселящий газ». Физические свойства: бесцветный, со сладковатым запахом, растворим в воде. Анестезирующее средство. Химические свойства: разлагается при 700 °C: 2N2O=2N2 + O2 поддерживает горение и является окислителем; взаимодействует с водородом: N2+1O + H2?N20+ Н2O. Получение: NH4NO3=N2O + 2Н2O. N2O соответствует азотноватистая кислота: Н2N2O2. Оксид азота (II) NO – окись азота. Физические свойства: бесцветный газ, плохо растворим в воде. Химические свойства: NO обладает окислительно-восстановительными свойствами: 1) при обычной температуре устойчив, при понижении t димеризуется в N2O2; 2) при 700 °C разлагается: 2NO=2N2 + O2 поддерживая горение, является восстановителем; 3) с водородом. Смесь равных объемов NO и H2 взрывается: 2NO + 2H2 = N2 + Н2O, где NO – окислитель; 4) с галогенами: 2NO + Сl2 = 2NOСl(нитрозилхлорид). NO – несолеобразующий. Получение: 1) в лаборатории: 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O; 2) в промышленности: каталитическое окисление аммиака: 4NH3 +5O2 = 4NO + 6H2O; 3) NO образуется в грозу: N2 + O2 = 2NO. Оксид азота (III) N203. Физические свойства: темно-синяя жидкость (при низких t). Химические свойства: N2O3 – ангидрид азотистой кислоты HN02. При взаимодействии с водой и щелочами соответственно дает НNO2 и ее соли – нитриты: N2O + 2NaOH = 2NaNO2 + H2O. Получение: NO2 + NO = N2O3. Оксид азота (IV) – NO2. Физические свойства: ядовитый газ бурого цвета с резким запахом. Химические свойства: кислотный ангидрид:
Реагирует со щелочами: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O. Окислитель: N+4O2 + S+4O2 = S+6O3 + N+2O. Получение: 2NO + O2 = 2NO2; Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O. Оксид азота (V) – N2O5. Физические свойства: малостойкое белое кристаллическое вещество. Сильный окислитель. Химические свойства: ангидрид HN03.
Разлагается со взрывом: 2N2O5?4NO2 + О2. Получение:
Азотная кислота – бесцветная, «дымящаяся» на воздухе жидкость с едким запахом. Химическая формула HNO3. Под воздействием света концентрированная HNO3 разлагается на оксиды азота:
HNO3 – сильная кислота. В растворах полностью распадается на ионы. Взаимодействует с основными оксидами и основаниями, с солями более слабых кислот. HNO3 обладает сильной окислительной способностью. Способна восстанавливаться с одновременным образованием нитрата до соединений, в зависимости от концентрации, активности взаимодействующего металла и условий: 1) концентрированная HN03, взаимодействуя с малоактивными металлами, восстанавливается до оксида азота (IV) NO2:
2) если кислота разбавленная, то она восстанавливается до оксида азота (II) NO:
3) более активные металлы восстанавливают разбавленную кислоту до оксида азота (I) N2O:
До солей аммония восстанавливается очень разбавленная кислота:
4) с неметаллами HNO3 реагирует, восстанавливая их до соответствующих кислот, а сама восстанавливается до оксидов:
5) HNO3 окисляет некоторые катионы и анионы и неорганические ковалентные соединения. 6) вступает во взаимодействие со многими органическими соединениями – реакция нитрования. Промышленное получение азотной кислоты: 4NH3 + 5O2 = 4NO + 6H2O. |
|
|
16. Фосфор. Оксиды фосфора. Фосфорная кислота. Фосфор (Р) находится в 3-м периоде, в V группе, главной подгруппы периодической системы Д.И. Менделеева. Порядковый номер 15, заряд ядра +15, имеет 3 энергетических уровня, на энергетической оболочке 15 электронов, из них 5 валентных. У фосфора появляется d-подуровень. Электронная конфигурация Р: 1s22s22p63s23p33d0. Характерна sp3-гибридизация, реже sp3d1. Валентность фосфора – III, V. Наиболее характерная степень окисления +5 и -3, менее характерные: +4, +1, -2, -3. Фосфор может проявлять и окислительные и восстановительные свойства: принимать и отдавать электроны. Физические свойства: фосфор образует три аллотропных модификации: белый, красный и черный. Каждая модификация имеет свою температуру плавления и замерзания. Химические свойства: 1) при нагревании Р4 обратимо диссоциирует:
2) свыше 2000 °C Р2 распадается на атомы:
3) фосфор образует соединения с неметаллами:
Непосредственно соединяется со всеми галогенами: 2Р + 5Cl2 = 2РCl5. При взаимодействии с металлами фосфор образует фосфиды:
Соединяясь с водородом, образует газ фосфин: Р4 + 6Н2 = 4РН3. При взаимодействии с кислородом образует ангидрид Р2О5: Р4 + 5О2 = 2Р2О5. Получение: фосфор получают прокаливанием смеси Са3(РO4)2 с песком и коксом в электропечи при температуре 1500 °C без доступа воздуха: 2Са3(РO4)2 + 1 °C + 6SiO2 = 6СаSiO3 + 1 °CO + P4?. Элемент фосфор образует ряд оксидов, наиболее важными из них являются оксид фосфора (III) P2O3 и оксид фосфора (V) P2O5. Оксид фосфора (III), или фосфористый ангидрид (P2O3) получают при медленном окислении фосфора, сжигая его в недостатке кислорода. Ядовит. Химические свойства: 1) вступает в реакцию с холодной водой, образуя при этом фосфористую кислоту H3PO3; 2) взаимодействуя с щелочами, образует соли – фосфиты; 3) является сильным восстановителем. Взаимодействуя с кислородом, окисляется до оксида фосфора (V) P2O5. Оксид фосфора (V), или фосфорный ангидрид (P2O5) получают при горении фосфора на воздухе или в кислороде. Представляет собой белый кристаллический порошок. Химические свойства: 1) взаимодействуя с водой, образует ортофосфорную кислоту H3PO4; 2) имея свойства кислотного оксида, вступает в реакции с основными оксидами и гидроксидами; 3) способен к поглощению паров воды. Фосфорные кислоты. Фосфорному ангидриду соответствует несколько кислот. Главная из них – ортофосфорная кислота H3PO4. Образует три вида солей: 1) средние соли – ортофосфаты; 2) кислые соли с одним атомом водорода; 3) кислые соли с двумя атомами водорода. Получение фосфорной кислоты: 1) в лаборатории: 3P + 5HNO3 + 2H2O = 3H3PO4 +5NO; 2) в промышленности: а) термический метод; б) экстракционный метод: Ca3(PO4)2 + 3H2SO4 = CaSO4 + 2 H3PO4. |
17. Общая характеристика 4 группы. Углерод, его физические и химические свойства. Характеристические соединения углерода. Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, заряд ядра +6. Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа. Химические
свойства: электронная
конфигурация: 1s22s22p2.
. Наиболее характерные степени
окисления: +4, +2 – в неорганических
соединениях, – 4, -2 – в органических.
Характерно несколько типов гибридизации:
sp,
sp2, sp3.
При низких температурах углерод
инертен, но при нагревании его активность
возрастает. Углерод – хороший
восстановитель, но соединяясь с
металлами и образуя карбиды,
он выступает окислителем Углерод (кокс) вступает в реакции с оксидами металлов:
Огромное количество органических соединений он образует с водородом – углеводороды. В присутствии никеля (Ni) углерод, реагируя с водородом, образует предельный углеводород – метан: С + Н2 = СН4. При взаимодействии с серой образует сероуглерод: С + 2S2 = СS2. При температуре электрической дуги углерод соединяется с азотом, образуя ядовитый газ дициан: 2С + N2 = С2N2. В соединении с водородом дициан образует синильную кислоту – НСN. С галогенами углерод реагирует в зависимости от их химической активности, образуя галогениды. На холоде реагирует со фтором: С + 2F2 = СF2. При 2000 °C в электропечи углерод соединяется с кремнием, образуя карборунд: Si + C = SiC.
|
18. Общая характеристика галогенов. Характеристические соединения галогенов. Галогены – элементы VII группы – фтор, хлор, бром, йод, астат. Галогены – ярко выраженные неметаллы. Лишь йод в редких случаях обнаруживает некоторые свойства, схожие с металлами. В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5. Это значит, что галогены имеют 7 валентных электронов, кроме фтора.
Физические свойства галогенов: F2 – бесцветный, трудно сжижающийся газ; Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; Br2 – жидкость красно-бурого цвета; I2 – кристаллическое вещество фиолетового цвета.
Водные растворы галогеноводородов образуют кислоты. НF – фтороводородная (плавиковая); НCl – хлороводородная (соляная); НBr – бромоводородная; НI – йодоводородная. Силы кислот сверху вниз снижаются. Плавиковая кислота является самой слабой в ряду галогеново-дородных кислот, а йодоводородная – самой сильной. Это объясняется тем, что энергия связи Нг сверху уменьшается. В том же направлении уменьшается и прочность молекулы Н Г, что связано с ростом межъядерного расстояния. Растворимость малорастворимых солей в воде тоже уменьшается:
Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде. Все галогены в свободном состоянии – окислители. Сила их как окислителей снижается от фтора к йоду. В кристаллическом, жидком и газообразном состоянии все галогены существуют в виде отдельных молекул. Атомные радиусы возрастают в том же направлении, что приводит к повышению температуры плавления и кипения. Фтор диссоциирует на атомы лучше йода. Электродные потенциалы при переходе вниз по подгруппе галогенов снижаются. У фтора самый высокий электродный потенциал. Фтор – самый сильный окислитель. Любой вышестоящий свободный галоген вытеснит нижестоящий, находящийся в состоянии отрицательного однозарядного иона в растворе. |
|
|
19. Металл в периодической системе. Электрохимический ряд напряжения. Общие свойство металлов. Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенныеправее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cuвозможно только в прямом направлении. Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворамикислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействиис водой. Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычныхусловиях не взаимодействуют. При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металловумеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия)невозможно при обычных условиях выделить из водных растворов солей. Общие свойства металлов Реакции с простыми веществами С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
С серой реагируют все металлы, кроме золота и платины: Железо взаимодействует с серой при нагревании, образуя сульфид:
С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуютсягидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой даютацетилен, метаниды — метан.
|
20. Общая характеристика s-элементов I группы. Натрий и калий. Натрий и калий – щелочные металлы, стоят в 1 группе главной подгруппы. Физические свойства: схожи по физическим свойствам: легкие серебристо-белые мягкие металлы, с невысокими температурами плавления и кипения, малой плотностью. Химические свойства: химические свойства натрия и калия очень схожи, калий активнее натрия, так как радиус его атома больше и внешний 1s-электрон находится дальше от ядра. Электронная конфигурация Na: 1s22s1; К: 1s22s12р63s1. Они легко отдают один электрон, имеющийся на внешнем s-подуровне, превращаясь в положительно заряженные ионы. На воздухе тускнеют и окисляются. Связь между атомами металлическая. Соединения с натрием и калием носят ионный характер. Высокая химическая активность. 1.Очень бурно реагируют с кислородом: 2Na + О2 = Na2O2 (пероксид натрия) при t ниже180 °C: 4Na + О2 = 2Na2O. Аналогичные реакции идут с калием, но калий образует еще и надпероксид – KO2. 2. С водой идет бурная реакция: 2Na + 2H2O = 2NaOH + H2. У калия данная реакция проходит с воспламенением водорода: 2К + 2H2O = 2KOH + H2?. 3. Реагируют с водородом при нагревании, образуя солеобразные гидриды: 2Na + H2 = 2NaH. 4. Легко взаимодействуют с серой, образуя сульфиды: 2Na + S = Na2S. 5. В атмосфере фтора и хлора натрий и калий воспламеняются, сгорают и образуют соли: 2Na + Cl2 = 2NaCl. 6. С жидким бромом натрий пассивно взаимодействует: 2Na + Вr2 = 2NaВr, а калий реагирует со взрывом: 2К + Вr2 = 2КВr. 7. При пропускании над расплавленным натрием и калием газообразного аммиака образуются амиды: 2Na + 2NН3 = 2NaNН2 + Н2?; 2К + 2NН3 = 2КNН2 + Н2. 8. Реагируют с водосодержащими соединениями – со спиртами, образуя алкоголяты: 2К + С2Н5ОН = 2С2Н5ОК (этилат калия) + Н2. Со ртутью калий и натрий образуют амальгамы – твердые сплавы – восстановители вместо чистых металлов. Получение натрия и калия: 1) восстановлением из их оксидов: Si + 2К2O = SiO2 + 4К; 2) электролизом расплава гидроксидов:
|
21. Общая характеристика s-элементов II группы. Магний, кальций. Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg. Простое вещество магний — лёгкий, ковкий металл серебристо-белого цвета. Получение Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции, вначале производят обжиг доломита:
Затем сильный нагрев с кремнием:
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду. Химические свойства При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и световой энергии:
Магний может гореть даже в углекислом газе:
Раскаленный магний энергично реагирует с водой, вследствие чего горящий магний нельзя тушить водой:
Возможна также реакция:
Щелочи на магний не действуют, в кислотах он растворяется с бурным выделением водорода:
Магний со взрывом реагирует с сильными окислителями типа порошкового перманганата калия. Кальций (Са) – химический элемент 2-й группы периодической системы, является щелочноземельным элементом. Конфигурация внешней электронной оболочки 4s2; имеет степень окисления +2, реже +1. Получение Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C:
Химические свойства В ряду стандартных потенциалов кальций расположен слева от водорода. В, так что кальций активно реагирует с водой, но без воспламенения:
С активными неметаллами (кислородом, хлором, бромом, иодом) кальций реагирует при обычных условиях:
При нагревании на воздухе или в кислороде кальций воспламеняется и горит красным пламенем с оранжевым оттенком («кирпично-красным»). С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
Большинство из соединений кальция с неметаллами легко разлагается водой, например:
|
|
|
22. Общая характеристика переходных металлов. d-элементы II группы. Цинк. Ртуть. В периодической системе элементов Д.И. Менделеева цинк находится во II группе, четвертом периоде. Он имеет порядковый номер 30 и атомную массу 65,39. Это переходный металл, характеризующийся внутренней застройкой d-орбиталей.
По физическим свойствам цинк – металл голубовато-белого цвета. При обычных условиях он хрупкий, но при нагревании до 100-150˚C поддается прокатке. На воздухе этот металл тускнеет, покрываясь защитным тонким слоем оксидной пленки ZnO. 2 В соединениях цинк проявляет единственную степень окисления +2. В природе металл встречается только в виде соединений. Важнейшие соединения цинка – цинковая обманка ZnS и цинковый шпат ZnCO3. 3 В большинстве цинковых руд содержится небольшое количество цинка, поэтому их сначала обогащают до получения цинкового концентрата. При последующем обжиге концентрата получают оксид цинка ZnO: 2ZnS+3O2=2ZnO+2SO2. Чистый металл восстанавливают из полученного оксида цинка при помощи угля: ZnO+C=Zn+CO. 4 По своим химическим свойствам цинк – довольно активный металл, но уступает щелочноземельным. Он легко взаимодействует с галогенами, кислородом, серой и фосфором: Zn+Cl2=2ZnCl2 (хлорид цинка), 2Zn+O2=2ZnO (оксид цинка), Zn+S=ZnS (сульфид цинка, или цинковая обманка), 3Zn+2P=Zn3P2 (фосфид цинка). 5 При нагревании цинк реагирует с водой и сероводородом. В этих реакциях выделяется водород: Zn+H2O=ZnO+H2↑, Zn+H2S=ZnS+H2↑. 6 При сплавлении цинка с безводными щелочами образуются цинкаты – соли цинковой кислоты: Zn+2NaOH=Na2ZnO2+H2↑. В реакциях с водными растворами щелочей металл дает комплексные соли цинковой кислоты – например, тетрагидроксицинкат натрия: Zn+2NaOH+2H2O=Na[Zn(OH)4]+H2↑. 7 В лабораторных условиях цинк нередко используется для получения водорода из разбавленной соляной кислоты HCl: Zn+2HCl=ZnCl2+H2↑. 8 При взаимодействии с серной кислотой образуется сульфат цинка ZnSO4. Остальные продукты зависят от концентрации кислоты. Ими могут быть сероводород, сера или сернистый газ: 4Zn+5H2SO4(сильно разб.)=4ZnSO4+H2S+4H2O, 3Zn+4H2SO4(разб.)=3ZnSO4+S+4H2O, Zn+2H2SO4(конц.)=ZnSO4+SO2↑+2H2O. 9 Аналогично идут реакции цинка и с азотной кислотой: Zn+4HNO3(конц.)=Zn(NO3)2+2NO2↑+2H2O, 4Zn+10HNO3(разб.)=4Zn(NO3)2+N2O+5H2O, 4Zn+10HNO3(сильно разб.)=4Zn(NO3)2+NH4NO3+3H2O. Ртуть относится к химическим элементам II группы периодической системы Менделеева, она представляет собой тяжелый серебристо-белый металл. При комнатной температуре ртуть находится в жидком состоянии. Получение
Ртуть получают обжигом киновари (сульфида ртути(II)) или металлотермическим методом:
Физические свойства Ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре. Химические свойства Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые. В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:
подщелачивании:
добавлении лигандов, стабилизирующих степень окисления ртути +2. Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся. На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется:
В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса:
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений. Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6d10 — электронной оболочки, что приводит к возможности существования соединений ртути(IV), но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4[13][14]. Свойства металлической ртути Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке[15]:
и азотной кислоте:
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2. При нагревании до 300 °C ртуть вступает в реакцию с кислородом:
При этом образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода. При нагревании ртути с серой образуется сульфид ртути(II):
Ртуть также реагирует с галогенами (причём на холоде — медленно). Ртуть можно окислить также щелочным раствором перманганата калия:
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути. |
23. d-элементы I группы. Медь. Комплексные соединения меди. Медь — элемент одиннадцатой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком. Получение Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0% Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:
Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезем:
Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:
Получаемая черновая медь содержит 90,95% металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99% и используется для изготовления проводов, электротехнического оборудования, а также сплавов. Гидрометаллургический метод Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод Электролиз раствора сульфата меди:
Химические свойства Возможные степени окисления В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году. Простое вещество Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами. На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной горячей серной кислотой:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С "царской водкой":
С концентрированной горячей соляной кислотой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата(I) калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
Соединения меди(I) Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства. Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов. Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I). Соединения меди(II) Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет:
Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, при которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга). Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Соединения меди(III) и меди(IV) Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов. Аналитическая химия меди Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором. Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этом сульфид меди выпадает в далее взвешиваемый осадок. В растворах, при отсутствии мешающих ионов, медь может быть определена комплексонометрически или потенциометрически, ионометрически. Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Комплексные соединения меди Одним из основных свойств меди во всех степенях окисления является способность образовывать комплексные соединения. Большинство растворимых соединений меди является комплексными. Одновалентная медь проявляет координационное число, равное 2, двухвалентная – 4, реже 6. Для одновалентной меди характерны комплексы с такими лигандами как хлорид-, сульфид-, тиосульфат-анионы: [CuCl2]-, [CuS2]3-, [Cu(S2O3)2]3-. Двухвалентная медь образует комплексные соединения с кислород-, азот-, серу-, хлорсодержащими лигандами: [Cu(OH)4]2-, [Cu(NH3)4]2+. Для меди (II) характерны катионные и анионные комплексы, при растворении солей меди (II) в воде или при взаимодействии оксида гидроксида меди (II) с кислотами образуются голубые аквакомплексы [Cu(H2O)6]2+. Аммиачные комплексы образуются при действии аммиака на растворы солей меди (II) : CuSO4 + 4NH3 = [Cu(NH3)4]SO4. Анионные комплексы получаются при растворении гидроксида меди (II) в концентрированных растворах щелочей, при этом образуются синие гидроксокупраты: Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]. В избытке основных галогенидов образуются галогенокупраты (II): CuCl2 + 2NaCl = Na2[CuCl4]. Анионные комплексы меди (II) известны также с карбонат- и сульфат-ионами. Для меди (I) аквакомплексы неустойчивы, устойчивы амминокомплексы типа [Cu(NH3)2]+, гидроксокомплексы [Cu(OH)2]- и хлоридные комплексы [CuCl2]-. Комплексообразование имеет большое значение при переводе металла в раствор: 2Cu + 8NH3 + 2H2O + O2 = 2[Cu(NH3)4](OH)2. Продукт растворения гидроксида меди в аммиаке называется «реактив Швейцера» и используется при производстве медно-аммиачных волокон. |
24. d-элементы VI группы. Хром, молибден. Элементы подгруппы хрома занимают промежуточное положение в ряду переходных металлов. Имеют высокие температуры плавления и кипения, свободные места на электронных орбиталях. Элементы хром и молибден обладают нетипичной электронной структурой – на внешней s-орбитали имеют один электрон (как у Nb из подгруппы VB). У этих элементов на внешних d– и s-орбиталях находится 6 электронов, поэтому все орбитали заполнены наполовину, т. е. на каждой находится по одному электрону. Имея подобную электронную конфигурацию, элемент обладает особенной стабильностью и устойчивостью к окислению. Вольфрам имеет более сильную металлическая связь, нежели молибден. Степень окисления у элементов подгруппы хрома сильно варьирует. В надлежащих условиях все элементы проявляют положительную степень окисления от 2 до 6, максимальная степень окисления соответствует номеру группы. Не все степени окисления у элементов стабильны, у хрома самая стабильная – +3. Все элементы образуют оксид MVIO3, известны также оксиды с низшими степенями окисления. Все элементы данной подгруппы амфотерны – образуют комплексные соединения и кислоты. Хром, молибден и вольфрам востребованы в металлургии и электротехнике. Все рассматриваемые металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе или в среде кислоты-окислителя. Удалив пленку химическим или механическим способом, можно повысить химическую активность металлов. Хром. Элемент получают из хромитной руды Fe(CrO2)2, восстанавливая углем: Fe(CrO2)2 + 4C = (Fe + 2Cr) + 4CO?. Чистый хром получают восстановлением Cr2O3 с помощью алюминия или электролиза раствора, содержащего ионы хрома. Выделяя хром с помощью электролиза, можно получить хромовое покрытие, используемое в качестве декоративных и защитных пленок. Из хрома получают феррохром, применяемый при производстве стали. Молибден. Получают из сульфидной руды. Его соединения используют при производстве стали. Сам металл получают при восстановлении его оксида. Прокаливая оксид молибдена с железом, можно получить ферромолибден. Используют для изготовления нитей и трубок для обмотки печей и электроконтактов. Сталь с добавлением молибдена используют в автомобильном производстве. Вольфрам. Получают из оксида, добываемого из обогащенной руды. В качестве восстановителя используют алюминий или водород. Получившийся вольфрам в идее порошка впоследствии формуют при высоком давлении и термической обработке (порошковая металлургия). В таком виде вольфрам используют для изготовления нитей накаливания, добавляют к стали. Хром (Cr) – d-элемент расположенный в 4-м периоде, в VI группе побочной подгруппы. Высшая степень окисления – +6. В соединениях может проявлять степень окисления от + до +6, но наиболее характерными для хрома является степень окисления +3 и +6. В остальных степенях окисления соединения хрома неустойчивы. Физические свойства: хром – серовато-белый металл с характерным металлическим блеском. При обычной температуре хром устойчив к воздействию воды и воздуха. Химические свойства: электронная конфигурация: 1s22s22p23s23p63d54s1. В образовании химических связей хрома участвуют не только электроны внешнего 4 уровня, но и электроны предпоследнего уровня – 3d-подуровня. При высокой температуре хром горит в кислороде: 4Cr + 3О2 = 2Cr2О3. Раскаленный хром реагирует с парами воды, вытесняя из нее кислород: 2Cr + 3Н2О = Cr2О3 + 3Н2?. При нагревании реагирует с галогеноводородами, S, N2, P4, C, Si, B:
С галогенами реагирует не одинаково: а) со фтором взаимодействует даже на холоде: Cr + 3F2 = CrF6; б) с хлором реагирует при нагревании: 2Cr + 3Cl2 = 2CrCl3. Разбавленная соляная и серная кислоты растворяют хром с выделением водорода, а в холодной азотной он пассивируется. Хром образует три оксида: CrО, Cr2О3 и CrО3. Получение: В чистом виде хром получают двумя способами: 1) металлотермический – восстановление металла из его оксида с помощью другого металла; 2) электролитический – электролиз водного раствора хромовых кислот. При этом одновременно с хромом на катоде выделяется водород. Поэтому получаемый хром содержит включения водорода. Для получения чистого хрома его переплавляют в вакууме. Металлический хром получают алюмотерми-ческим способом (способ Бекетова) из оксида Cr2О3: Cr2О3 + 2Al = Al2О3 + 2Cr.
|
|
|
25. d-элементы VII группы. Марганец. Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn. Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой[2]. Получение 1.Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
2.Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (~80 % Mn). 3.Чистый металлический марганец получают электролизом. Химические свойства Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (+1, +5 мало характерны). При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде (Mn + O2 → MnO2). Марганец при нагревании разлагает воду, вытесняя водород (Mn + 2H2O →(t) Mn(OH)2 + H2↑), образующийся гидроксид марганца замедляет реакцию. Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды. Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды. C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив. Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7. Mn2O7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4). При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV). Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI). При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»). При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа». Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основной характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn2(CO)10. Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF3, NO, N2, P(C5H5)3). |
26. Общая характеристика триады железа. d-Металлы VIII группы включают три триады. В четвертом периоде это триада железа, а в пятом и шестом периодах две триады объединяют под общим названием платиновые металлы. В триаду железа входят: железо (Fе), кобальт (Со) и никель (Ni). Это основные конструкционные металлы. Электронные конфигурации данных атомов имеют соответственно вид: 3d64s2, 3d74s2 и 3d84s2. Для железа наиболее характерны степени окисления +2, +3 и +6, а для кобальта и никеля – +2, +3. Железо наиболее устойчиво при обычных условиях в степени окисления +3, поэтому соединения железа +2 являются восстановителями, а +6 – сильными окислителями. Для кобальта и никеля наиболее устойчива степень окисления +2, а в степени окисления +3 они обладают сильными окислительными свойствами. Железо, кобальт и никель – активные металлы, находящиеся в ряду напряжений до водорода. На воздухе данные металлы окисляются с образованием соответствующих оксидов. Накаленное железо сгорает по реакции 4Fe + 3О2 = 2Fe2О3. В мелкораздробленном состоянии (диаметр частиц около 5 мкм) данные металлы самовоспламеняются на воздухе, т.е. обладают пирофорными свойствами. Железо при температуре красного каления (~500 оС) окисляется водой: 3Fe + 4Н2О = Fe3О4 + 4H2. FeO – оксид железа(II) и соответствующий ему гидроксид Fe(OH)2 обладают основными свойствами. Fe2О3 – оксид железа(III) проявляет амфотерные свойства, т.е. растворяется в кислотах, а при сплавлении со щелочами образует соли железистой кислоты – метаферриты: Fe2О3 + 6НС1 = 2FeCl3 + 3Н2О; Fe2О3 + 2NaOH = 2NaFeО2 + H2О. Fe3О4 – смешанный оксид железа FeO·Fe2О3 или Fe(FeО2) 2 – метаферрит железа(II), представляющий собой соль, образованную при взаимодействии основного оксида (FeO) и амфотерного оксида(Fe2О3). Структурную формулу данной соли можно представить следующим образом: О=Fe–О–Fe–О–Fе=О. Соляная и разбавленная серная кислоты растворяют данные металлы с образованием двухвалентных солей: Fe + 2НCl = FeCl2 + Н2, Fe + H2SО4(разб.) = FeSО4 + H2. При растворении железа в азотной или концентрированной серной кислотах образуются соли железа (III): Fe + 4НNO3(разб.) = Fe(NO3)3 + NO + 2Н2О, 2Fe + 6H2SО4(конц.) = Fe2(SО4)3 + 3SО2↑ + 6H2О. Концентрированная азотная кислота, содержащая NO2, и концентрированная (близкая к 100 %) серная кислота пассивируют Fе, Со и Ni. Соединения железа (II) проявляют восстановительные свойства и окисляются до соединений железа (III) по реакции 4Fe(OH)2 + O2 + 2Н2О = 4Fe(OH)3. Данная реакция используется для обезжелезивания воды. Ионы Fe3+ проявляют относительно сильные окислительные свойства φ°(Fe3+/Fe2+) = +0,77 В. На практике это используется для «травления» печатных плат по реакции 2FeCl3 + Сu = 2FeCl2 + CuCl2. Ионы Fe2+ и Fe3+ являются типичными комплексообразователями. Наиболее устойчивы их цианидные комплексы: 1) К4[Fе(СN)6] – гексацианоферрат (II) калия (жёлтая кровяная соль) является чувствительным реактивом на ионы Fе3+: FeCl3 + K4[Fe(СN)6] → KFe[Fe(СN)6] + 3KCI. Образующийся малорастворимый гексацианоферрат(II) калия-железа(III) имеет интенсивно-синий цвет. Это соединение часто называют «берлинской лазурью». 2) Кз[Fе(СN)6] – гексацианоферрат(III) калия (красная кровяная соль) является чувствительным реактивом на ионы Fе2+: FeCl2 + K3[Fe(СN)6] → KFe[Fe(СN)6] + 2KCI. Образующийся осадок гексацианоферрат(III) калия-железа(II) окрашен в интенсивно-синий цвет. Его часто называют «турнбуллева синь». Соединения железа(VI) – очень сильные окислители (φ ~ +1,9 В) 2K2FeО4 + 16НС1 = 2FeCl3 + 3Cl2↑ + 4KCI + 8H2О. Железо образует с СО летучую жидкость – пентакарбонил железа Fe(СО)5; при нагревании разлагается на СО и порошковое высокочистое железо. Для железа в таблице 19.3 приведены образуемые им основные классы соединений. Из таблицы видно, что с повышением степени окисления характер оксидов изменяется от основных до кислотных, проходя через амфотерные. Обращает на себя внимание соответствие степеней окисления и характера оксидов железа и хрома. При обработке поверхности железа азотом (азотировании) оно приобретает твердость и коррозионную стойкость. С углеродом железо образует прочное соединение – цементит Fe3С. Большое практическое значение имеют соединения железа, кобальта и никеля с кремнием и бором, которые обладают твердостью, прочностью при высокой температуре и коррозионной стойкостью. Соединения никеля и кобальта сходны. Для них известны гидроксиды Ме(ОН)2 и Ме(ОН)3. Соли кобальта (II) в безводном состоянии обычно синего цвета, а их водные растворы и кристаллогидраты имеют розовую окраску. Фильтровальная бумага, пропитанная раствором хлорида кобальта(II) и затем высушенная, может служить грубым гигрометром (указателем влажности), так как в зависимости от содержания влаги в воздухе он принимает разные оттенки цветов – от синего до розового. Устойчивая степень окисления для них +2 и соответственно соединения Со(III) и Ni(III) обладают сильными окислительными свойствами. |
|