
Основные расчетные формулы
SVT-цикл. Полагаем, что процесс адиабатного расширения воздуха на участке 1-2 обратимый. Адиобатный процесс происходит без теплообмена с окружающей средой, δQ=0, поэтому
ΔU + δA = CVdT + pdV = 0
Из этого соотношения с помощью уравнения состояния идеального газа можно получить уравнение алиабатного процесса TV γ-1= const ,
где для воздуха показатель адиобаты равен 1,4.
1. Показатель политропы n при известных изменениях давлений Δp1, Δp3.
Продифференцируем уравнения политропы (рVn = const) и изотермы (рV = const):
рnV n1 dV + V n dр = 0 для политропы
рdV + V dр = 0 для изотермы
Преобразуем соотношения к виду
![]()
При относительно малых изменениях p и V угловые коэффициенты политропы и изотермы рассчитываются по формулам
![]() ,
где V = V2
V1.
,
где V = V2
V1.
Из отношения приведенных уравнений получаем
![]()
2. Холодильные коэффициенты ε для nVT и SVT- процессов при известных давлениях p2 и изменениях давлений Δp3, Δp3*.
Холодильный коэффициент определяется как отношение теплоты, отнятой от охлаждаемого газа, к затраченной в цикле работе. Для SVT-цикла

Для nVT-цикла
![]()
Перепишем выражения для , используя экспериментально измеренные величины давлений, для чего значения работы А12 и А12* определим графическим способом. В рV-координатах (рис. 2.2) они равны площадям трапеций, основания которых р1 и p2 = р2*, а высоты (V2 V1) и (V2* V1) соответственно. После преобразований получаем:
![]()
3. Холодильный коэффициент обратного цикла Карно εK при известных температурах нагревателя и холодильника T1, T2.
КПД прямого цикла Карно по определению
равен
![]() .
.
Холодильный коэффициент обратного
цикла Карно![]() .
.
4. Число молей воздуха в сосуде по известным значениям p2, V1, T1:
![]()
Запишем уравнение состояния идеального газа для процесса 1-2:

5. Изменения энтропии ΔS при известных давлениях Δp1 и p2, показателе политропы n и количестве молей газа ν.
По определению
![]() .
.
nVT: На участке 12 (политропический процесс)
S12 =

На участке 2-3 (изохорический процесс)
S23 =
На участке 3-1 (изотермический процесс)
S31 =

SVT: На участке 12* (адиабатический процесс) изменение энтропии равно нулю.
Изменения энтропии на участках 2-3 (изохорический процесс) и 3-1 (изотермический) равны по величине, но различаются знаком:
S3*1 =
![]()
Протокол наблюдений
Лабораторная работа № 10 : исследование термодинамических циклов
Таблица измерений
Атмосферное давление p2 = 102100 Па
Температура воздуха T1 = 294 К
|
N |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Δp1, Па |
670 |
680 |
680 |
680 |
690 |
690 |
700 |
700 |
710 |
720 |
|
Δp3, Па |
100 |
110 |
130 |
150 |
120 |
110 |
140 |
150 |
120 |
110 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Экспериментальный макет
Объем баллона V1 = 22,4 л = 22,4∙10-3 м3
Выполнил ХХХХХХХХХ
Факультет КТИ
Группа № 6ХХХ
“ ” ноября 2006
Преподаватель: Морозов В.В.
Протокол наблюдений подписывается преподавателем в конце лабораторного занятия.
ОБРАБОТКА РЕЗУЛЬТАТОВ
1. а) Определение избыточных давлений Δp1 и Δp3 (прямые измерения):



б) Определение показателя политропы n (перенос погрешностей.)
![]()

2. Определение параметров состояния (p, V, T) в точках 1, 2, 3, 1*, 2*, 3*.

Cостояние 1 (совпадает с 1*):
p1 = p2 + Δp1 = 102790 Па
V1 = 22,4 л = 22,4∙10-3 м3
T1 = 294 K
Состояние 2*:
p2* =
p2
= 102100 Па
Уравнение адиабаты:
Газ двухатомный, i
= 5.
Уравнение состояния:
Cостояние 3*:
T3*
= T1 = 294 K
Из уравнения изотермического процесса
1-3:
Процесс 2-3 изохорический, значит
V3* =
V2*.
Тогда имеем
Уравнение состояния:
![]()


![]()


Состояние 2:
p2 = 102100 Па
Уравнение политропы:

Уравнение состояния:

Cостояние 3:
p3 = p2 + Δp3 = 102220 Па
T3 = T1 = 294 K
Уравнение состояния:

Графики циклов (начало координат сдвинуто):
nVT (n = 1,2)

SVT (γ = 1,4)

3. Расчет холодильных коэффициентов ε (вывод формул – стр. 3).
Цикл nVT (1-2-3-1):
![]()
Цикл SVT (1-2*-3*-1):
![]()
Так как Δp3*
> Δp3,
![]() .
.
Обратный цикл Карно (идеальная холодильная машина):
Для T1,
T2:![]()
Для T1,
T2*:![]()
Так как T2*
< T2,
![]() .
.
Холодильные коэффициенты циклов Карно меньше, чем холодильные коэффициенты рассматриваемых циклов в силу идеальности холодильной машины Карно.
4. Определение числа молей воздуха ν в сосуде (вывод формул – стр. 3).
![]()
5. Изменение энтропии ΔS в циклах 1-2-3-1, 1-2*-3*-1 (вывод формул – стр. 4).
Цикл nVT (1-2-3-1):
Политропа 1-2 ![]()
Изохора 2-3 ![]()
Изотерма 3-1 ![]()
Изменение энтропии за цикл
![]()
Цикл SVT (1-2*-3*-1):
Адиабата 1-2* ΔS12 = 0
Изохора 2*-3* ![]()
Изотерма 2*-3* ![]()
Изменение энтропии за цикл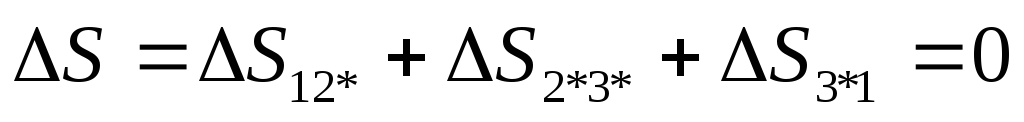
ИТОГИ
|
Таблица измерений |
||||||||||
|
N |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Δp1, Па |
670 |
680 |
680 |
680 |
690 |
690 |
700 |
700 |
710 |
720 |
|
Δp3, Па |
100 |
110 |
130 |
150 |
120 |
110 |
140 |
150 |
120 |
110 |
|
Вычисленные величины |
|
Избыточное давление Δp1 = (69020) Па |
|
Избыточное давление Δp3 = (12020) Па |
|
Избыточное давление Δp3* = 188 Па |
|
Показатель политропы
n =
|

|
Параметры состояния p, V, T |
|||
|
Состояние |
p, Па |
V, м3 |
T, К |
|
1 |
102790 |
22,4∙10-3 |
294 |
|
2 |
102100 |
22,53∙10-3 |
293,72 |
|
3 |
102220 |
22,53∙10-3 |
294 |
|
2* |
102100 |
22,51∙10-3 |
293,46 |
|
3* |
102288 |
22,51∙10-3 |
294 |
|
Изменение энтропии ΔS |
|
|
Процесс |
ΔS, Дж/К |
|
1-2 |
21,9∙10-3 |
|
2-3 |
21,9∙10-3 |
|
3-1 |
–43,8∙10-3 |
|
1-2* |
0 |
|
2*-3* |
37,5∙10-3 |
|
3*-1 |
–37,5∙10-3 |
ВЫВОДЫ
Выполнив данную лабораторную работу, я исследовал политропно-изохорно-изотермический (nVT) и адиабатно-изохорно-изотермический (SVT) циклы.
Пользуясь экспериментально измеренными величинами избыточных давлений Δp1 и Δp3, я определил показатель политропного процесса n, нашел холодильные коэффициенты ε для nVT- и SVT-циклов.
С помощью уравнения состояния идеального газа мной были вычислены параметры состояния (p, V, T). На основе полученных данных я построил графики nVT- и SVT-циклов в pV-координатах.
Также были найдены изменения энтропии ΔS для каждого процесса nVT- и SVT-циклов.
Результаты работы помещены на лист «Итоги» в табличной форме.
