
Минералогия_2 / Бетехтин / betehtin_2
.pdf666 |
Описательная часть |
в простые химические формулы. Общая химическая формула может быть выражена таким образом: АтХрО2р · nН2О, где Х = Si, Al. Каких либо опреде ленных соотношений между содержанием щелочей и кремнезема в различ ных минералах не наблюдается.
Многое еще не совсем ясно в наших представлениях о разных типах анионных радикалов, характеризующих минералы рассматриваемой груп пы. Тем не менее цеолиты обладают целым рядом общих совершенно свое образных свойств, и не вызывает никакого сомнения то, что они состав ляют особую группу или семейство. Рентгенометрические исследования показывают, что кристаллические структуры их состоят из каркасов алю мокремнекислородных тетраэдров, отличающихся от других типов кар касных структур тем, что полости в них представлены более широкими «каналами». Такая более открытая кристаллическая жесткая основа со держит в себе слабо связанные с ней молекулы воды. При осторожном нагревании вода может быть постепенно удалена без разрушения крис таллической структуры в целом. Замечательно, что удаленная этим пу тем вода вслед за тем снова может быть поглощена до прежних пределов или заменена молекулами других веществ (сероводорода, этилового спир та, аммиака и пр.), причем кристаллическая среда сохраняет однородность; соответственно меняются лишь оптические свойства. Отсюда естествен но, что содержание воды в цеолитах является переменной величиной и зависит от внешних условий (температуры и упругости паров воды в ок ружающей среде). Так называемая цеолитная вода именно тем и отлича ется от кристаллизационной, что при нагревании она выделяется не скач ками при каких либо определенных температурах, а постепенно.
Другой характерной особенностью, ярко выраженной у большинства цеолитов, является та легкость, с какой происходит обмен между катиона ми, уравновешивающими отрицательный заряд каркаса кристаллической решетки, и катионами в окружающем водном растворе. Те или иные кати оны раствора способны вытеснять катионы, располагающиеся в «пустотах» среди каркаса цеолитов, без нарушения их структуры. Это свойство исполь зуется в практике, главным образом при применении искусственно изго товляемых цеолитов в качестве пермутита для смягчения жестких вод.
В противоположность более «закрытым» каркасным структурам по левых шпатов, в которых каждая «пустая» ячейка занята катионами, в структурах цеолитов свободные пространства использованы не полнос тью. При сопоставлении данных химических анализов в соответствии со структурами выясняется, что, помимо обычно наблюдаемого в полевых шпатах типа замены катионов с сохранением общего заряда, числа ионов и объема (например, NaSi–CaAl или KSi–BaAl), в цеолитах существует другой тип замены: Са–Na2, Ba–K2, NaCa2–Na3Ca.
Как видим, в этих случаях общий заряд заменяемых катионов одина ков с зарядом заменяющих примерно равновеликих катионов, однако
Раздел V. Кислородные соли (оксисоли) |
667 |
число ионов различно. Очевидно, кристаллические структуры цеолитов имеют какой то «запас» пространства для такого рода подстановок.
Минералы группы цеолитов по сравнению с безводными алюмосили катами характеризуются меньшей твердостью, меньшим удельным весом, меньшими показателями преломления и более легкой разлагаемостью кислотами. Большинство их вспучивается перед паяльной трубкой, чем и обусловлено их название: от греч. цео — вскипать.
Много общего мы находим и в условиях их образования. При эндоген ных процессах они возникают в условиях низких давлений в самые по следние низкотемпературные стадии гидротермальных процессов, встре чаясь в ассоциации большей частью с кальцитом, халцедоном, кварцем, гиббситом и другими минералами. Они встречаются, как правило, в гидротермально измененных магматических породах, часто в пузырис тых эффузивах (мандельштейнах), особенно в базальтах (при подвод ных извержениях), затем в пегматитах, где образуется в числе после дних минералов, либо в пустотах, либо метасоматическим путем за счет ранее выделившихся минералов (полевых шпатов, нефелина и др.); в ряде гидротермальных рудных месторождений и в некоторых современных от ложениях горячих источников.
В экзогенных условиях цеолиты имеют также широкие области рас пространения. Имеются указания, например, на образование цеолитов в почвах. Как новообразования цеолиты встречаются в осадочных породах молодого возраста.
Цеолиты, как природные, так и их синтетические аналоги, находят широкое применение в промышленности, особенно в химической, в ка честве материала поверхностей для нанесения катализаторов, в роли сор бентов, ионообменников и молекулярных сит для разделения нефтепро дуктов на фракции, в вакуумных насосах и пр.
ШАБАЗИТ Ca — (Са,K2,Na2,Sr)[Al2Si4O8] · 6H2O. Название происхо дит от слова хабазиос, которым назывался какой то камень, воспетый гре ческим поэтом Орфеем. Синоним: хабазит. Обнаружены различные эк земпляры с преобладанием каждого из перечисленных в катионной позиции элементов, в связи с чем выделены еще три минеральных вида, отличающихся соответствующими суффиксами.
Химический состав непостоянный даже для образцов из одного и того же месторождения. Чаще всего отвечает написанной химической форму ле. В небольших количествах содержится также Ba и Sr.
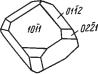
Сингония тригональная. Облик кристаллов ромбоэдрический, близ кий к кубическому (рис. 363). Двойники прорастания часты, нередко с выступающими на гребнях трехгранными углами. Чаще встречается в виде кристаллических друз, корочек, секреций и плотных агрегатов.
Цвет шабазита белый с красноватым или буроватым оттенком. Блеск стеклянный. Ng = 1,480–1,490 и Nm = 1,478–1,485.
668 |
Описательная часть |
Твердость 4–5. Хрупкий. Спайность по ромбоэдру ясная. Уд. вес 2,08–2,16.
Диагностические признаки. Для шабазита характер ны ромбоэдрические кристаллы и спайность по ромбо эдру, углы между гранями которого близки к прямым.
Рис. 363. Крис По этим признакам он отличается почти от всех других талл шабазита цеолитов. Кальцит обладает меньшей твердостью и лег
ко отличим по отношению к HCl.
П. п. тр. вспучивается и с трудом плавится в пузыристую просвечива ющую эмаль. В HCl разлагается с выделением иловатого кремнезема.
Происхождение и месторождения. Чаще всего встречается во мно гих странах в виде отдельных кристаллов и корок с кальцитом в соста ве миндалин в округлых пустотах пузыристых базальтов, фонолитов и других эффузивных пород, нередко в ассоциации с филлипситом KCa[Al3Si5O16] · ~8H2O, кальцитом и другими минералами. Известен в составе гидротермально переработанных туфов основного состава в басс. р. Нижняя Тунгуска (Эвенкия, Красноярский край), в пегматитах Хибинс кого щелочного массива (Кольский полуостров). Обильные выделения шабазита со стильбитом и кальцитом наблюдаются в пустотах среди желе зорудных скарнов Соколово Сарбайского месторождения (Северо Запад ный Казахстан). В Исландии был встречен в ископаемых раковинах мол люсков. В обилии образуется при устье некоторых горячих источников.
НАТРОЛИТ — Na2[Al2Si3O10] · 2H2O. Название «натролит» дано Клапротом, в переводе оно означае — натровый камень.
Химический состав. Na2O — 16,3 %, Al2О3 — 26,8 %, SiO2 — 47,4 %, Н2О — 9,5 %. Изредка присутствуют Fe2O3, а также К2О.
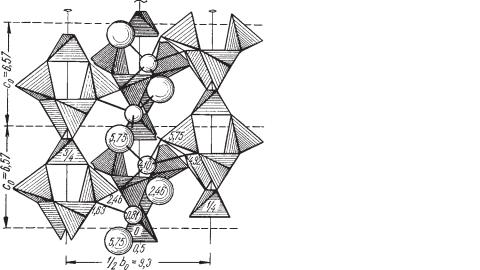
Сингония ромбическая; пирамидальный в. с. L22P. Пр. гр. Fdd2(C192v). a0 = 18,3; b0 = 18,6; с0 = 6,57. Кристаллическая структура. Основным струк турным элементом является группа [Al2Si3О10], состоящая из кольца четы рех тетраэдров состава [Al2Si2O8] с добавочным тетраэдром SiO4 или чере дующимся с ним AlО4 (рис. 364). Эти группы располагаются в виде беспрерывных цепочек вдоль оси с и связываются друг с другом с помо щью свободных вершин тетраэдров (Si,Al)O4. В целом четыре таких цепоч ки располагаются вокруг винтовой оси (на рис. 364 не показана лишь це почка над плоскостью чертежа). Молекулы Н2О образуют зигзагообразную цепочку, параллельную оси с, вокруг каждой двойной винтовой оси. Ионы Na1+ окружены четырьмя ионами О2– и двумя молекулами Н2О. Подобно другим цеолитам, в натролите ионы Na могут заменяться из окружающих растворов другими катионами. Облик кристаллов обычно столбчатый. Кри сталлы простые, образованы гранями призмы {110}, иногда пинакоидов {010}, {100} и дипирамиды {111} (рис. 365). Двойники по (110), также по (100). Агрегаты. Часто встречается в радиально лучистых агрегатах или в виде кристаллических корок, а также плотный в форме сферолитов и во локнистых масс, иногда скрытокристаллический — халцедоновидный.
Раздел V. Кислородные соли (оксисоли) |
669 |
Рис. 365. Кристаллы натролита
|
Цвет. Бесцветный или бе |
|
|
лый с желтоватым, зеленова |
|
|
тым и красноватым оттенком. |
|
|
Блеск стеклянный, у волокнис |
|
|
тых масс — шелковистый. |
|
|
Ng = 1,485–1,493, Nm = 1,476– |
|
Рис. 364. Кристаллическая структура натролита. |
1,482 и Np = 1,473–1,480. |
|
Проекция части остова на плоскость (100). По |
Твердость 5–5,5. Хрупкий. |
|
вертикали приведены две элементарные ячейки. |
Спайность по {110} средняя. |
|
Срединная вертикальная цепочка связанных |
Уд. вес 2,2–2,5. |
|
тетраэдров, располагающаяся сзади плоскости |
||
Диагностические призна8 |
||
чертежа, показана темнее. Крупные шары — |
||
молекулы H O, мелкие шары — ионы Na1+ |
ки. Макроскопически трудно |
|
2 |
отличить от других аналогич |
|
|
ных по форме и условиям нахождения цеолитов. Для точных определений приходится прибегать к измерению оптических констант, рентгенометрии или химическому анализу.
П. п. тр. легко плавится, не вспучиваясь, в прозрачное стекло. Вода при нагревании до 300 °С почти полностью удаляется, а по охлаждении вновь поглощается. В HCl растворяется с выделением студенистого кремнезема.
Месторождения. Часто встречается в миндалинах и жеодах эффузив ных изверженных пород (базальта). Как продукт гидротермального измене ния нефелина, а также в радиально лучистых агрегатах известен в пегмати тах нефелиновых сиенитов в Вишневых и Ильменских горах. Очень широко распространен в поздних гидротермальных жилах и в ядрах щелочных пег матитов в нефелиновых сиенитах Хибинского и Ловозерского массивов, где встречается с альбитом, калишпатом, эвдиалитом, апатитом и анальцимом.
СКОЛЕЦИТ — Ca[Al2Si3O10] · 3H2O. От греч. сколекс — червь. Назван по свойству червеобразно искривляться перед паяльной трубкой.
Химический состав (в %): CaO — 14,3, Al2О3 — 26,0, SiO2 — 45,9, Н2О — 13,8. Сингония моноклинная; диэдрический безосный в. с. Р. Пр. гр. Cc(С4s). a0 = 5,67; b0 = 6,54; c0 = 18,44. Псевдотетрагональный. Кристаллическая
структура близка к структуре натролита, с заменой двух атомов натрия одним кальция. Облик кристаллов столбчатый, с развитием граней {110},
670 |
Описательная часть |
{111}, а также {010}. По виду кристаллов не отличим от натролита. Двойни ки по (100) со штриховкой на гранях {010}. Агрегаты игольчатые, радиаль но лучистые. Наблюдается также в волокнистых сферолитовых массах.
Цвет. Бесцветный или белый. Блеск стеклянный, у волокнистых масс — шелковистый. Ng = 1,519, Nm = 1,518 и Np = 1,512.
Твердость 5–5,5. Хрупкий. Спайность по {110} средняя. Уд. вес 2,2–2,4. Диагностические признаки. Без данных химических анализов и по ведения п. п. тр. не отличим от натролита, с которым нередко образует тесные срастания, иногда в пределах одного кристаллического индивида. П. п. тр. вспучивается, червеобразно искривляется (отличие от натро лита). Плавится в пузыристое стекло. В HCl разлагается с образованием
студенистого кремнезема.
Месторождения. В России был встречен в качестве позднего минера ла в щелочных пегматитах Вишневых гор (Урал). Широко распространен в пузыристых лавах базальта в виде миндалин и жеод, в басс. Нижней Тунгус ки (Эвенкия, Красноярский край) в Исландии и в Колорадо (США). Круп ные кристаллы были встречены в Пуна, на юго восток от Бомбея (Индия).
ГЕЙЛАНДИТ8Ca — (Ca,Sr,K2,Na2)[Al2Si6O16] · 5H2O. Химический состав. CaO — 9,2 %, Al2О3 — 16,8 %, SiO2 — 59,2 %, Н2О — 14,8 %. Обыч но присутствует Na2O, К2О — до 3,5 %, часто SrO (иногда до 6,3 %), и BaO — до 2,5 %. Выделяются более редкие крайние члены твердых растворов этой группы: гейландит K и гейландит Sr.
Сингония моноклинная: моноклинно призматический в. с. Кристаллическая структура обладает элементами слоистой структуры. Облик кристаллов изометриче ский или таблитчатый (рис. 366); обычно они встречаются поодиночке. Господствующие формы: {010}, {001}, {100} и {101}. Агрегаты.
Рис. 366. Кристаллы гейландита Нередко наблюдается в листоватых массах с параллельным срастанием пластинок, в лу
чисто листоватых агрегатах в виде секреций в пустотах. Цвет. Бесцвет ный или белый, желтый, кирпично красный (благодаря микроскопиче ским включениям Fe2O3). Блеск стеклянный, на плоскостях спайности перламутровый. Ng = 1,505, Nm = 1,499 и Np = 1,498.
Твердость 3,5–4. Хрупкий. Спайность по {010} совершенная. Уд. вес 2,18–2,22.
Диагностические признаки. От других цеолитов отличается по харак терному пластинчатому облику кристаллов, совершенной спайности, обусловливающей перламутровый отлив, и пластинчато зернистым аг регатам.
П.п. тр. расщепляется, вспучивается и сплавляется в белую эмаль.
ВHCl легко разлагается с выделением студенистого кремнезема.
Раздел V. Кислородные соли (оксисоли) |
671 |
Месторождения. Распространён в пустотах траппов рек Нидым и Гончак бассейна Нижней Тунгуски, с кальцитом, анальцимом, апофиллитом и стиль битом. Встречается в пустотах эффузивных пород (базальтов и др.), напри мер в Исландии. Спорадически наблюдался в жильных серебряных место рождениях Андреасберг в Гарце (Германия), Конгсберг (Норвегия) и др.
ФИЛЛИПСИТ8K — (K2,Ca, Na2, Ba)2 3[Al4 6Si12 9O32] · 12H2O. Химический состав. SiO2 — 44–48 %, Аl2О3 — 22–24 %, CaO — 3–8 %,
К2О — 4–11 %, Na2O (до 6 %), Н2О — 15–17 %. В этой группе выделены также филлипсит Ca и филлипсит Na с доминированием соответствую щих катионов.
Сингония моноклинная: моноклинно призматический в. с. Облик кристаллов столбчатый (вдоль оси а). Простые крис таллы редки. Обычно наблюдаются двойники, часто ромбического или квадратного сечения, а также чет верники (рис. 367), иногда крестообразного сечения со
штриховкой по {010} параллельно ребру между b (010) Рис. 367. Четвер и m (110). Встречаются и более сложные двойниковые
срастания.
Цвет. Бесцветный или белый с сероватым, желтоватым и краснова тым оттенком. Блеск стеклянный. Ng = 1,503, Nm = 1,500 и Np = 1,498.
Твердость 4–4,5. Хрупкий. Спайность по {001} и {010} довольно яс ная. Уд. вес 2,2.
Диагностические признаки. Характерны формы двойников. Очень похож на более редко встречающиеся гармотом и стильбит, но отличает ся от них по оптическим константам.
П.п. тр. сильно крошится, частично вспучивается и затем плавится
вбелую эмаль. В HCl растворяется с выделением хлопьевидного или сту денистого кремнезема.
Месторождения. Как и другие многие цеолиты, встречается в пустотах эффузивных, в частности щелочных пород (лейцитовых базальтов и др.) в виде миндалин, секреций на стенках пустот, например, среди лав на Мон те Сомма (Везувий), в Сицилии, Исландии и в других местах. Образуется также в современных глубоководных осадках Тихого океана, вероятно, как продукт разложения вулканического пепла (до 20–30 % всего осадка).
ГАРМОТОМ —(Ba,К2,Na2,Ca)5[Al10Si22O64] · 24H2O. Сингония моноклин ная. Чрезвычайно характерны двойники крестообразного сечения, вытя нутые вдоль оси а, аналогичные двойникам филлипсита (рис. 368).
Цвет белый с сероватым или желтоватым оттенками, а также бурый, красный. Ng = 1,508, Nm = 1,505 и Np = 1,503.
Твердость 4,5. Спайность по {010} заметная, по {001} несовершенная. Уд. вес 2,44–2,50. П. п. тр. белеет, крошится и без вспучивания плавится довольно трудно в белое просвечивающее стекло. В HCl разлагается с вы делением порошкообразного кремнезема.

672 |
Описательная часть |
Встречается в сходных с другими цеолитами ус ловиях, главным образом в эффузивных извержен ных породах, иногда в гнейсах и некоторых гидротер мальных рудных месторождениях. В типичной для цеолитов ассоциации в полостях основных эффузи вов обнаружен в долине р. Воеволи Хан на севере Красноярского края. С кальцитом, хлоритом, натро литом и другими цеолитами гармотом содержится в полостях якупирангитов Африканды (Кольский по луостров), содержащих щелочные пироксен и амфи бол, магнетит и перовскит. Отмечены находки его в
месторождениях Андреасберг в Гарце (Германия) с галенитом, сфалеритом, кварцем и др.; в окрестностях Строншиана (Шотландия) с кальцитом, га ленитом и др.
СТИЛЬБИТ — (Ca, Na2)[Al2Si6O16] · 6H2O. От греч. стильбе — блис таю. Синоним: десмин.
|
Сингония моноклинная, моноклинно призматиче |
|
|
ский в. с. L2PC. Пр. гр. C2/m(С 3 ). Кристаллы уплощен |
|
|
2h |
|
|
но вытянутые призматически пинакоидальные. Ча |
|
|
сто встречается в виде двойников (рис. 369), нередко |
|
|
аналогично филлипситу и гармотому — в четверни |
|
|
ках с крестообразным сечением. Эти сложные двой |
|
|
никовые кристаллы обычно расщепляются в снопо |
|
Рис. 369. Стильбит. |
образные формы агрегатов (рис. 369), за что этот |
|
Слева — двойник |
минерал и получил свое второе название (десме по |
|
прорастания с двойни |
гречески — связка). |
|
ковой плоскостью |
Цвет белый с желтоватым или красноватым от |
|
(001); справа — |
||
тенком. Блеск стеклянный, по спайности перламут |
||
снопообразный |
||
агрегат двойниковых |
ровый. Ng = 1,500, Nm = 1,489 и Np = 1,493. |
|
индивидов |
Твердость 3,5–4. Спайность по {010} совершен |
|
|
ная и по {100} ясная. Уд. вес 2,09–2,20. П. п. тр. рас |
щепляется, вспучивается, принимает веерообразные и червеобразные формы и сплавляется в белую эмаль. В HCl разлагается с образованием порошковатого кремнезема.
Встречается в пустотах и трещинах в виде секреций, преимуществен но в эффузивных изверженных породах. Иногда устанавливается в руд ных гидротермальных жилах. В России наблюдался на Ангаре близ д. Черной, в бассейне Нижней Тунгуски (Красноярский край), в Малом Куналее (Бурятия) и в других местах. Известен в Крыму (Карагач около Симферополя, Украина), около Боржоми (Грузия).
ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ
Глава 1
МИНЕРАЛЬНЫЙ СОСТАВ ЗЕМНОЙ КОРЫ
Количественное значение различных типов химических соединений в земной коре. Общее число названий минералов, встречающихся в ста рой и новой геологической литературе, достигает 6000. Однако при кри тическом подходе к установлению минеральных видов и их разновидно стей на основе рациональной классификации подавляющее большинство этих названий должно быть оставлено по ряду соображений. Прежде все го, многие из них, как это доказано с помощью современных точных ме тодов исследования, представляют собой механические смеси. Весьма значительное число названий оказалось синонимами одних и тех же ми неральных веществ, отличающихся друг от друга либо по степени дис персности кристаллической фазы, либо по некоторым внешним призна кам (оттенку окраски, форме кристаллических индивидов и др.), либо по несущественным отличиям в химическом составе (особенно для назва ний разновидностей) и т. д.
Если упразднить все эти синонимы и вычеркнуть из списка минераль ные смеси, то число действительных минеральных видов в настоящее время выражается цифрой немного менее 1500. Кроме того, сохраняется около 200 названий для разновидностей. Правда, следует заметить, что в ряде случаев реально существующие разновидности минеральных видов не имеют специальных названий.
По главным типам химических соединений число минеральных ви дов распределяется следующим образом.
1.Силикаты и алюмосиликаты — 25,8 %.
2.Фосфаты и их аналоги — 18,0 %.
3.Сульфиды и их аналоги — 13,3 %.
4.Окислы и гидроокислы — 12,7 %.
5.Сульфаты — 9,4 %.
6.Галогениды — 5,8 %.
7.Карбонаты — 4,5 %.
674 |
Заключительная часть |
8.Самородные элементы — 4,3 %.
9.Бораты — 2,9 %.
10.Прочие — 3,3 %.
Как видим, наибольшее количество минеральных видов приходится на силикаты, фосфоры, окислы, сульфиды и сульфаты. На долю этих со единений в общей сложности падает около 80 %.
Однако в весовом отношении мы имеем существенно иную картину. Согласно данным пересчета кларков В. И. Вернадского, А. Е. Ферсмана и других, в известной нам части земной коры для главнейших типов хими ческих соединений мы получаем следующий порядок цифр содержания
ввесовых процентах.
1.Силикаты — около 75 % (на долю полевых шпатов приходится 55 %).
2.Окислы и гидроокислы — около 17 %, причем на кварц (вместе с хал цедоном и опалом) падает 12,6 %, а на окислы и гидроокислы железа — 3,6 %.
3.Карбонаты (главным образом кальцит и доломит) — около 1,7 %.
4.Фосфаты и их аналоги (преимущественно апатит) — около 0,7 %.
5.Хлориды и фториды — около 0,5 %, причем из хлоридов наиболь шим распространением пользуется галит, из фторидов — флюорит.
6.Сульфиды и сульфаты — около 0,3—0,4 %; из сульфидов главен ствующее значение имеет сульфид железа — пирит.
7.Самородные элементы — около 0,1 %; в том числе около 0,04 % при ходится на долю азота и около 0,01 % — на долю кислорода.
Эти данные показывают, что одни только силикаты и кварц в земной коре составляют около 87 % по весу, тогда как такие типы химических соединений, как фосфаты и их аналоги, сульфиды, сульфаты, окислы (кро ме кварца и окислов железа), которые в природных условиях представ лены многочисленными минеральными видами, в весовом отношении составляют очень незначительную долю валового состава земной коры. Тем не менее следует подчеркнуть, что именно эти типы химических со единений содержат многие ценные металлы, столь важные для горно ме таллургической, химической и других отраслей промышленности.
Некоторые особенности состава и распределения минералов в зем8 ной коре. Общее число природных химических соединений (минералов) несравненно меньше, чем их можно получить искусственным путем в лабораторных условиях, несмотря на то что природные реакции представ ляют гораздо более грандиозную по масштабам картину явлений. Число ежегодно открываемых новых минералов, несмотря на применение весь ма совершенных и мощных современных средств исследования вещества, за последние десятилетия не столь уже значительно (обычно не больше 10). Общее число известных в настоящее время минеральных видов в об ласти неорганической природы не выше 1500, тогда как число искусст венных соединений, полученных до последнего времени, выражается многими сотнями тысяч и при современном развитии технических средств
Глава 1. Минеральный состав земной коры |
675 |
синтеза весьма значительно увеличивается.
Если бы мы задались вопросом, каковы количественные значения раз ных по составу минералов в различных генетических типах природных образований в области земной коры, то на основе анализа фактических данных пришли бы к следующему выводу.
В эндогенных образованиях наименьшее число минеральных видов наблюдается в изверженных горных породах, возникших в условиях вы соких температур и давлений. В постмагматических образованиях, осо бенно в гидротермальных месторождениях, устанавливается несравнен но большее число самых разнообразных по типу соединений минеральных видов. Однако наиболее богаты минералами экзогенные образования, возникающие в условиях низких температур и давлений, в условиях вод но воздушной обстановки, т. е. при высоком парциальном давлении кис лорода, и, наконец, в условиях широко развитой органической жизни на земле. Но все же и здесь общее число минералов совершенно незначи тельно по сравнению с тем количеством искусственных соединений, ко торые могут быть получены в лабораториях и заводах.
Это обстоятельство обусловлено рядом причин. Прежде всего, как на это давно уже обратил внимание В. И. Вернадский, в природных соедине ниях принимают участие далеко не все ионы, которые могут быть получены для каждого элемента в лабораторных условиях. Например, марганец в минералах устанавливается в двух , трех или четырехвалентном состоя нии, а искусственно легко можно получить также соединения шести и се мивалентного марганца и, кроме того, металлический марганец и различ ные интерметаллические соединения. Вольфрам в природных условиях известен только в виде шестивалентного иона, а в лабораторных условиях, кроме того, получаются соединения двух , трех , четырех и пятивалент ного вольфрама. Металлы группы платины в природных условиях встре чаются главным образом в самородном виде и почти не образуют ионов (если не принимать во внимание редких сульфидов и арсенидов), тогда как среди искусственных продуктов мы знаем типичные ионные соедине ния с валентностью 2, 3, 4 и для Ru и Os даже 6 и 8. В соответствии с этим число известных минералов группы платины едва достигает 30, а число искусственных соединений выражается многими сотнями, и т. д.
Совершенно ясно, что в земной коре при процессах минералообразо вания, протекающих в сложной многокомпонентной среде, в условиях сравнительно нешироких пределов колебания окислительно восстанови тельных потенциалов создаются весьма ограниченные возможности об разования ионов различных валентностей. Следовательно, и число воз можных сочетаний ионов при минералообразовании резко сокращается.
Второе важное обстоятельство, на которое обратил внимание еще А. Е. Ферсман, заключается в том, что многие элементы, характеризующие ся низкими кларками, в природных условиях не образуют самостоятельных
