
- •О.И.Москвич общая физика Молекулярная физика
- •Предисловие
- •I. Основы молекулярной статистики
- •1.1. Предмет молекулярной физики
- •1.2. Масштабы физических величин в молекулярном мире
- •1.3. Теоретические и экспериментальные методы молекулярной физики
- •1.4. Эволюция молекулярных систем. Порядок и хаос
- •1.5. Принципы организации статистического и термодинамического методов изучения макросистем
- •Статистический метод
- •Термодинамический метод
- •2.1. Классификация моделей молекулярных систем
- •2.2. Идеальные статистические системы
- •Модели идеальных систем
- •2.3. Элементарные сведения из теории вероятностей
- •Случайные события
- •Определения вероятности событий
- •Статистическое или частотное определение вероятности.
- •Теоремы теории вероятностей
- •Условие нормировки вероятности
- •Случайная величина
- •Плотность вероятности
- •2.4. Основные понятия молекулярной статистики
- •Вероятность микроскопического состояния. Статистический ансамбль
- •Статистические постулаты
- •Комментарий к постулату равновероятности
- •Эргодическая гипотеза:
- •Постулат равновероятности доступных микроскопических состояний изолированной системы в состоянии термодинамического
- •Комментарий к эргодической гипотезе
- •Вероятность макроскопического состояния
- •3.1. Вывод закона распределения вероятностей Описание системы
- •Актуальные свойства модели системы
- •Постановка задачи
- •Вывод закона
- •Математические преобразования больших чисел. Введение общепринятых обозначений
- •Формула для вероятности макросостояния. Закон Бернулли, или биномиальное распределение.
- •3.2. Графическое представление биномиального распределения.
- •Основные характеристики биномиального распределении.
- •3.3. Предельные случаи биномиального распределения
- •4.1. Распределение энергии в статической системе
- •Вывод распределения Гиббса
- •4.2. Вывод распределения Максвелла
- •4.3. Плотность вероятности и характерные скорости распределения Максвелла
- •4.4. Распределение Максвелла по компонентам скорости
- •4.5. Экспериментальная проверка распределения Максвелла
- •5.1. Вывод формулы для давления идеального газа
- •5.2. Основное уравнение молекулярно-кинетической теории. Газовые законы
- •5.3. Уравнение эффузии
- •5.4. Измерение давления
- •5.5. Определение и измерение температуры
- •5.6. Построение эмпирической шкалы на основе газового термометра
- •Преимущества газовой шкалы температур
- •Построение газовой шкалы температур
- •Термодинамическая шкала температур
- •6.1. Распределение молекул по энергиям во внешнем потенциальном поле
- •6.2. Формула Больцмана для концентрации молекул в потенциальном поле
- •6.3. Зависимость концентрации молекул газа от координат в однородном гравитационном поле и поле центробежных сил
- •Графическое представление зависимости концентрации молекул от координат
- •6.4. Экспериментальное подтверждение распределения Больцмана: опыты Перрена
- •Получение макромолекул
- •Выделение частиц одинакового размера
- •Измерение диаметра макромолекулы
- •Подсчёт количества частиц на определённой высоте
- •6.5. Барометрическая формула
- •6.6. Закон распределения Максвелла – Больцмана
- •7.1. Формулировка теоремы и её доказательство Формулировка теоремы
- •Актуальные свойства модели статистической системы
- •Доказательство теоремы
- •7.2. Статистические степени свободы
- •7.3. Броуновское движение и его статистическое описание
- •Поступательное броуновское движение
- •Вращательное броуновское движение
- •7.4. Броуновский критерий точности физических измерений
- •7.5. Классическая теория теплоёмкости многоатомных газов. Область её применимости
- •7.6. Классическая теория теплоёмкости твёрдых тел.
- •7.7. Применение квантовых моделей в теории теплоёмкости твёрдых тел
- •Модель Эйнштейна
- •Модель Дебая
- •II. Основы термодинамики
- •8.1. Четыре постулата термодинамики
- •8.2. Нулевое (общее) начало термодинамики
- •Формулировка постулата
- •Свойство транзитивности термодинамического равновесия
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •8.3. Макроскопические процессы
- •8.4. Функция состояния
- •Математические свойства функции состояния
- •8.5. Внутренняя энергия системы. Работа и теплота Внутренняя энергия
- •Макроскопическая работа и теплота
- •8.6. Калорическое и термическое уравнения состояния
- •9.1. Первое начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •9.2. Теплоёмкость
- •Связь между теплоёмкостями и(общий случай)
- •Уравнение Роберта Майера
- •9.3. Политропические процессы в идеальном газе
- •Вывод уравнения политропического процесса в идеальном газе
- •9.4. Тепловые машины и их эффективность.
- •Принципиальная схема работы тепловой машины
- •Показатели эффективности тепловых машин
- •10.1. Цикл Карно
- •Расчёт кпд машины Карно
- •10.2. Теоремы Карно
- •Термодинамическая шкала температур
- •10.3. Метод циклов
- •Задача о нахождении зависимости внутренней энергии макроскопического тела от его объема
- •10.4. Неравенство Клаузиуса. Определение энтропии
- •10.5. Оценка эффективности тепловых машин сверху
- •Примеры оценок эффективности тепловых машин сверху кпд бензинового двигателя внутреннего сгорания
- •Кпд паровой турбины
- •Киэ бытового холодильника
- •Киэ кондиционера воздуха
- •Киэ теплового насоса
- •Тепловое загрязнение окружающей среды
- •11.1. Формулировки второго начала термодинамики
- •Энтропийная формулировка второго начала термодинамики Часть первая
- •Часть вторая
- •Информационное содержание постулата
- •11.2. Закон возрастания энтропии в изолированных системах
- •Демон Максвелла
- •Формулировка парадокса
- •Разрешение парадокса
- •11.3. Область применимости второго начала термодинамики
- •Статистический характер второго начала
- •11.4. Концепция тепловой смерти Вселенной
- •Концепция Клаузиуса
- •Флуктуационная гипотеза Больцмана
- •Несостоятельность концепции тепловой смерти Вселенной
- •11.5. Энтропия и её изменение в различных процессах
- •Постановка задачи
- •Описание системы
- •Актуальные свойства системы и процесса
- •Решение
- •Парадокс Гиббса Описание
- •По разные стороны перегородки находятся различные газы. После устранения перегородки начнется диффузия.
- •По разные стороны перегородки находится один и тот же газ.
- •12.1. Термодинамические функции
- •Свободная энергия
- •Термодинамический потенциал Гиббса
- •12.3. Условия термодинамической устойчивости макроскопических систем. Принцип Ле Шателье-Брауна
- •Принцип Ле Шателье-Брауна
- •Проведение полного термодинамического анализа вещества на полуэмпирической основе
- •12.4. Третье начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата (варианты)
- •Информационное содержание постулата
- •Статус постулата
- •Следствия третьего начала
- •III. Физика реальных макросистем
- •13.1. Твердые тела
- •13.2. Реальные газы и жидкости
- •Потенциал межмолекулярного взаимодействия
- •Природа межмолекулярного взаимодействия
- •Структура жидкостей
- •13.3. Переход из газообразного состояния в жидкое.
- •13.4. Уравнения состояния реального газа
- •13.5. Модель газа Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса
- •14.1. Изотермы газа Ван-дер-Ваальса
- •14.2. Критическое состояние вещества
- •Закон соответственных состояний
- •Свойства вещества в критическом состоянии
- •Анализ применения уравнения Ван-дер-Ваальса для описания свойств реальных газов
- •14.3. Внутренняя энергия газа Ван-дер-Ваальса
- •14.4. Эффект Джоуля-Томсона Основные определения
- •Описание процесса Джоуля-Томсона
- •Сущность эффекта Джоуля-Томсона
- •Расчет дифференциального эффекта Джоуля-Томсона
- •Расчет интегрального эффекта Джоуля-Томсона
- •14.5. Методы получения низких температур
- •Метод противоточного обмена теплотой
- •Метод адиабатического размагничивания
- •15.1. Условие равновесия фаз химически однородного вещества
- •15.2. Классификация фазовых переходов по Эренфесту
- •Фазовые переходы первого рода
- •Фазовые переходы второго рода
- •15.3. Фазовые переходы первого рода. Диаграмма состояний
- •15.4. Уравнение Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса методом циклов
- •Актуальные свойства процесса
- •Постановка задачи
- •Вывод уравнения
- •15.5. Диаграмма состояний гелия. Сверхтекучесть жидкого гелия.
- •16.1. Релаксационные процессы в молекулярных системах
- •16.2. Стационарные уравнения переноса в газах, жидкостях и твердых телах
- •Уравнение теплопроводности
- •Уравнение самодиффузии
- •Уравнение внутреннего трения
- •16.3. Внутренняя теплопроводность и внешняя теплопередача
- •Стационарное распределение температуры в бесконечной плоско-параллельной пластинке
- •Стационарное распределение температуры между двумя концентрическими бесконечно длинными цилиндрами
- •Стационарное распределение температуры между двумя концентрическими сферами
- •Внешняя теплопередача
- •17.1. Столкновения молекул и их количественные характеристики
- •Эффективное сечение молекул
- •Средняя длина свободного пробега молекулы
- •Кинематические параметры и
- •17.2. Обобщенное уравнение переноса
- •Вывод обобщенного уравнения процесса Описание системы
- •Актуальные свойства модели процесса
- •Постановка задачи
- •Вывод уравнения
- •17.3. Элементарная кинетическая теория теплопроводности,
- •17.4. Явления переноса в ультраразреженных газах
- •Трение и теплопроводность ультраразреженных газов
- •Тепловая и изотермическая эффузия
- •18.1. Атмосфера как открытая система и как открытая книга
- •18.2. Состав и структура атмосферы Земли.
- •18.3. Термофизическая модель атмосферы
- •18.4. Парниковый эффект
- •Сущность парникового эффекта
- •Парниковые газы
- •Проблема глобального потепления
- •Киотский протокол
- •18.5. Инверсия температуры в стратосфере. Озоносфера Земли
- •Мониторинг озонового слоя
- •Монреальский Протокол
- •18.6. Концепция «ядерной зимы»
- •«Ядерная зима» Сценарии ядерной войны
- •Огненные смерчи – суперподъемники
- •Антипарниковый эффект
- •Глобальный характер климатических последствий
- •Список литературы
- •Общая физика. Молекулярная физика
- •660041, Г. Красноярск, пр. Свободный, 79
15.5. Диаграмма состояний гелия. Сверхтекучесть жидкого гелия.
Сверхтекучесть жидкого гелия была открыта и изучена в 1938 году П.Л. Капицей. Квантовую теорию эффекта в 1941 году предложил Л.Д. Ландау. За открытие этого явления и создание его теории Капица (1978) и Ландау (1962) были удостоены Нобелевской премии по физике.
Вы уже знаете. Что жидкий гелий существует
в области не только низких, но и сверхнизких
температур, сколь угодно близких к
 .
Таким образом, гелий – самая холодная
жидкость в природе. В экспериментальной
физике гелий используется при многих
исследованиях, требующих низких
температур. Особенно важно использование
гелия при исследовании сверхпроводимости
и создания условий для эксплуатации
сверхпроводящих магнитов. Ярким примером
использования жидкого гелия служит
система Большого адронного коллайдера,
созданного международным проектом
ЦЕРНа. Для удержания пучков протонов,
разгоняемых до почти световой скорости
в 27-километровом кольце ускорителя
нужны настолько мощные магниты, которые
могут быть созданы лишь из сверхпроводников.
Рабочая температура магнитов составляет
около 1,9
.
Таким образом, гелий – самая холодная
жидкость в природе. В экспериментальной
физике гелий используется при многих
исследованиях, требующих низких
температур. Особенно важно использование
гелия при исследовании сверхпроводимости
и создания условий для эксплуатации
сверхпроводящих магнитов. Ярким примером
использования жидкого гелия служит
система Большого адронного коллайдера,
созданного международным проектом
ЦЕРНа. Для удержания пучков протонов,
разгоняемых до почти световой скорости
в 27-километровом кольце ускорителя
нужны настолько мощные магниты, которые
могут быть созданы лишь из сверхпроводников.
Рабочая температура магнитов составляет
около 1,9 и поэтому может быть достигнута только
в контакте с жидким гелием. Диаграмма
состояний гелия представлена на рис.
15.4.
и поэтому может быть достигнута только
в контакте с жидким гелием. Диаграмма
состояний гелия представлена на рис.
15.4.

Рис.15.4.
Гелий может существовать в газообразной, твердой и двух жидких модификациях:
IиII. Обращает внимание
отсутствие на диаграмме состояний гелия
кривой возгонки. Если охлаждать жидкий
гелийII, то при определенной
температуре (зависящей от внешнего
давления) он превращается в жидкий гелийII. Этот переход осуществляется
по линии .
Жидкость остается жидкостью, её плотность
не меняется
.
Жидкость остается жидкостью, её плотность
не меняется и отсутствует скрытая теплота перехода.
Нет ни одного признака фазового перехода
первого рода. Зато обнаруживается скачок
теплоемкости в окрестности температуры
фазового перехода.
и отсутствует скрытая теплота перехода.
Нет ни одного признака фазового перехода
первого рода. Зато обнаруживается скачок
теплоемкости в окрестности температуры
фазового перехода.

Рис.15.5.
Зависимость
 жидкого гелия приведена на рис. 15.5. Это
явный признак
жидкого гелия приведена на рис. 15.5. Это
явный признак -перехода,
или перехода второго рода.
-перехода,
или перехода второго рода.
 IIявляется бесцветной
прозрачной жидкостью и не отличается
по внешнему виду от
IIявляется бесцветной
прозрачной жидкостью и не отличается
по внешнему виду от I. Единственное внешнее
отличие наблюдается в точке кипения
при атмосферном давлении.
I. Единственное внешнее
отличие наблюдается в точке кипения
при атмосферном давлении. Iинтенсивно кипит по
всему объему, в то время как
Iинтенсивно кипит по
всему объему, в то время как IIобразует спокойную
поверхность без образования пузырьков
в объеме жидкости. Все превращения
жидкости в пар происходят на границе
фаз, это является следствием
сверхтеплопроводности
IIобразует спокойную
поверхность без образования пузырьков
в объеме жидкости. Все превращения
жидкости в пар происходят на границе
фаз, это является следствием
сверхтеплопроводности II.
II.
Самым важным и поразительным свойством
 IIявляется, конечно же,
его сверхтекучесть [7]. Сверхтекучий
гелий не обладает вязкостью. Он без
трения протекает через узкие капилляры
и щели
IIявляется, конечно же,
его сверхтекучесть [7]. Сверхтекучий
гелий не обладает вязкостью. Он без
трения протекает через узкие капилляры
и щели .
В то же время
.
В то же время IIоказывает сопротивление
движущимся в нем телам. Это кажущееся
противоречие находит свое разрешение
в следующем обстоятельстве. Оказывается,
жидкость состоит из двух компонент –
нормальной (вязкой) и сверхтекучей,
которые взаимно проникают друг в друга.
IIоказывает сопротивление
движущимся в нем телам. Это кажущееся
противоречие находит свое разрешение
в следующем обстоятельстве. Оказывается,
жидкость состоит из двух компонент –
нормальной (вязкой) и сверхтекучей,
которые взаимно проникают друг в друга.
При течении через узкий капилляр нормальная компонента покоится относительно стенок сосуда, а сверхтекучая компонента движется без трения. Относительно макроскопических тел движутся обе компоненты, поэтому появляется сила вязкого трения, направленная против направления скорости движения тела.
Плотность жидкого гелия IIравна сумме плотностей нормальной и сверхпроводящей компонент

Полная плотность
 не зависит от температуры, но её
распределение между
не зависит от температуры, но её
распределение между и
и сильно зависит от температуры. При
сильно зависит от температуры. При существует только сверхтекучая
компонента, при температуре
существует только сверхтекучая
компонента, при температуре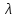 -перехода
- только нормальная компонента. Поэтому
на линии
-перехода
- только нормальная компонента. Поэтому
на линии сверхтекучесть исчезает.
сверхтекучесть исчезает.
Свойство сверхтекучести проявляется
лишь при достаточно малых скоростях
течения, не превышающих некоторой
критической скорости. Сверхтекучесть
определяет и сверхтеплопроводность
 II, поскольку передача
теплоты в нем осуществляется не в
процессе тепловой диффузии
(теплопроводности), а конвективными
потоками сверхтекучей жидкости. В
результате теплопроводность гелия в
сотни раз превышает теплопроводность
серебра.
II, поскольку передача
теплоты в нем осуществляется не в
процессе тепловой диффузии
(теплопроводности), а конвективными
потоками сверхтекучей жидкости. В
результате теплопроводность гелия в
сотни раз превышает теплопроводность
серебра.
Гелий IIобладает еще целым рядом интереснейших свойств, с некоторыми из них вы можете познакомиться в [1].
Сверхтекучесть – сугубо квантовое явление, не объясняемое классической физикой. Гелий II– это единственная квантовая жидкость. При теоретическом рассмотрении адекватной моделью материального тела является конденсат идеального газа, подчиняющегося статистике Бозе-Эйнштейна. Обсуждение этой модели выходит за рамки данного курса.
Контрольные вопросы
1. Какие превращения называются полиморфными? Приведите примеры.
2. Приведите примеры фазовых переходов первого и второго рода.
3. Назовите три признака равновесия фаз.
4. Сформулируйте условие равновесия фаз химически однородного вещества.
5. Дайте классификацию фазовых переходов по Эренфесту.
6. Какие свойства вещества могут меняться скачкообразно при фазовых переходах а) первого рода, б) второго рода?
7. Что называется диаграммой состояния? Поясните на рисунке. Какая точка на диаграмме называется тройной точкой? Сколько тройных точек может содержать диаграмма состояния.
8. Какую информацию можно получить с помощью фазовой диаграммы вещества?
9. Почему кривая испарения заканчивается критической точкой, а кривая плавления такой точки не имеет?
10. Запишите уравнение Клапейрона-Клаузиуса, поясните его смысл.
11. Каким способом можно вывести уравнение Клапейрона-Клаузиуса? К каким фазовым превращения оно применимо?
12. Опишите
 -переход
в жидком гелии. Как проявляется
сверхтекучесть
-переход
в жидком гелии. Как проявляется
сверхтекучесть II? Какие интересные свойства жидкого
гелия вам известны?
II? Какие интересные свойства жидкого
гелия вам известны?
ЛЕКЦИЯ 16
ПРОЦЕССЫ ПЕРЕНОСА В РЕАЛЬНЫХ СИСТЕМАХ
