
- •О.И.Москвич общая физика Молекулярная физика
- •Предисловие
- •I. Основы молекулярной статистики
- •1.1. Предмет молекулярной физики
- •1.2. Масштабы физических величин в молекулярном мире
- •1.3. Теоретические и экспериментальные методы молекулярной физики
- •1.4. Эволюция молекулярных систем. Порядок и хаос
- •1.5. Принципы организации статистического и термодинамического методов изучения макросистем
- •Статистический метод
- •Термодинамический метод
- •2.1. Классификация моделей молекулярных систем
- •2.2. Идеальные статистические системы
- •Модели идеальных систем
- •2.3. Элементарные сведения из теории вероятностей
- •Случайные события
- •Определения вероятности событий
- •Статистическое или частотное определение вероятности.
- •Теоремы теории вероятностей
- •Условие нормировки вероятности
- •Случайная величина
- •Плотность вероятности
- •2.4. Основные понятия молекулярной статистики
- •Вероятность микроскопического состояния. Статистический ансамбль
- •Статистические постулаты
- •Комментарий к постулату равновероятности
- •Эргодическая гипотеза:
- •Постулат равновероятности доступных микроскопических состояний изолированной системы в состоянии термодинамического
- •Комментарий к эргодической гипотезе
- •Вероятность макроскопического состояния
- •3.1. Вывод закона распределения вероятностей Описание системы
- •Актуальные свойства модели системы
- •Постановка задачи
- •Вывод закона
- •Математические преобразования больших чисел. Введение общепринятых обозначений
- •Формула для вероятности макросостояния. Закон Бернулли, или биномиальное распределение.
- •3.2. Графическое представление биномиального распределения.
- •Основные характеристики биномиального распределении.
- •3.3. Предельные случаи биномиального распределения
- •4.1. Распределение энергии в статической системе
- •Вывод распределения Гиббса
- •4.2. Вывод распределения Максвелла
- •4.3. Плотность вероятности и характерные скорости распределения Максвелла
- •4.4. Распределение Максвелла по компонентам скорости
- •4.5. Экспериментальная проверка распределения Максвелла
- •5.1. Вывод формулы для давления идеального газа
- •5.2. Основное уравнение молекулярно-кинетической теории. Газовые законы
- •5.3. Уравнение эффузии
- •5.4. Измерение давления
- •5.5. Определение и измерение температуры
- •5.6. Построение эмпирической шкалы на основе газового термометра
- •Преимущества газовой шкалы температур
- •Построение газовой шкалы температур
- •Термодинамическая шкала температур
- •6.1. Распределение молекул по энергиям во внешнем потенциальном поле
- •6.2. Формула Больцмана для концентрации молекул в потенциальном поле
- •6.3. Зависимость концентрации молекул газа от координат в однородном гравитационном поле и поле центробежных сил
- •Графическое представление зависимости концентрации молекул от координат
- •6.4. Экспериментальное подтверждение распределения Больцмана: опыты Перрена
- •Получение макромолекул
- •Выделение частиц одинакового размера
- •Измерение диаметра макромолекулы
- •Подсчёт количества частиц на определённой высоте
- •6.5. Барометрическая формула
- •6.6. Закон распределения Максвелла – Больцмана
- •7.1. Формулировка теоремы и её доказательство Формулировка теоремы
- •Актуальные свойства модели статистической системы
- •Доказательство теоремы
- •7.2. Статистические степени свободы
- •7.3. Броуновское движение и его статистическое описание
- •Поступательное броуновское движение
- •Вращательное броуновское движение
- •7.4. Броуновский критерий точности физических измерений
- •7.5. Классическая теория теплоёмкости многоатомных газов. Область её применимости
- •7.6. Классическая теория теплоёмкости твёрдых тел.
- •7.7. Применение квантовых моделей в теории теплоёмкости твёрдых тел
- •Модель Эйнштейна
- •Модель Дебая
- •II. Основы термодинамики
- •8.1. Четыре постулата термодинамики
- •8.2. Нулевое (общее) начало термодинамики
- •Формулировка постулата
- •Свойство транзитивности термодинамического равновесия
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •8.3. Макроскопические процессы
- •8.4. Функция состояния
- •Математические свойства функции состояния
- •8.5. Внутренняя энергия системы. Работа и теплота Внутренняя энергия
- •Макроскопическая работа и теплота
- •8.6. Калорическое и термическое уравнения состояния
- •9.1. Первое начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •9.2. Теплоёмкость
- •Связь между теплоёмкостями и(общий случай)
- •Уравнение Роберта Майера
- •9.3. Политропические процессы в идеальном газе
- •Вывод уравнения политропического процесса в идеальном газе
- •9.4. Тепловые машины и их эффективность.
- •Принципиальная схема работы тепловой машины
- •Показатели эффективности тепловых машин
- •10.1. Цикл Карно
- •Расчёт кпд машины Карно
- •10.2. Теоремы Карно
- •Термодинамическая шкала температур
- •10.3. Метод циклов
- •Задача о нахождении зависимости внутренней энергии макроскопического тела от его объема
- •10.4. Неравенство Клаузиуса. Определение энтропии
- •10.5. Оценка эффективности тепловых машин сверху
- •Примеры оценок эффективности тепловых машин сверху кпд бензинового двигателя внутреннего сгорания
- •Кпд паровой турбины
- •Киэ бытового холодильника
- •Киэ кондиционера воздуха
- •Киэ теплового насоса
- •Тепловое загрязнение окружающей среды
- •11.1. Формулировки второго начала термодинамики
- •Энтропийная формулировка второго начала термодинамики Часть первая
- •Часть вторая
- •Информационное содержание постулата
- •11.2. Закон возрастания энтропии в изолированных системах
- •Демон Максвелла
- •Формулировка парадокса
- •Разрешение парадокса
- •11.3. Область применимости второго начала термодинамики
- •Статистический характер второго начала
- •11.4. Концепция тепловой смерти Вселенной
- •Концепция Клаузиуса
- •Флуктуационная гипотеза Больцмана
- •Несостоятельность концепции тепловой смерти Вселенной
- •11.5. Энтропия и её изменение в различных процессах
- •Постановка задачи
- •Описание системы
- •Актуальные свойства системы и процесса
- •Решение
- •Парадокс Гиббса Описание
- •По разные стороны перегородки находятся различные газы. После устранения перегородки начнется диффузия.
- •По разные стороны перегородки находится один и тот же газ.
- •12.1. Термодинамические функции
- •Свободная энергия
- •Термодинамический потенциал Гиббса
- •12.3. Условия термодинамической устойчивости макроскопических систем. Принцип Ле Шателье-Брауна
- •Принцип Ле Шателье-Брауна
- •Проведение полного термодинамического анализа вещества на полуэмпирической основе
- •12.4. Третье начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата (варианты)
- •Информационное содержание постулата
- •Статус постулата
- •Следствия третьего начала
- •III. Физика реальных макросистем
- •13.1. Твердые тела
- •13.2. Реальные газы и жидкости
- •Потенциал межмолекулярного взаимодействия
- •Природа межмолекулярного взаимодействия
- •Структура жидкостей
- •13.3. Переход из газообразного состояния в жидкое.
- •13.4. Уравнения состояния реального газа
- •13.5. Модель газа Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса
- •14.1. Изотермы газа Ван-дер-Ваальса
- •14.2. Критическое состояние вещества
- •Закон соответственных состояний
- •Свойства вещества в критическом состоянии
- •Анализ применения уравнения Ван-дер-Ваальса для описания свойств реальных газов
- •14.3. Внутренняя энергия газа Ван-дер-Ваальса
- •14.4. Эффект Джоуля-Томсона Основные определения
- •Описание процесса Джоуля-Томсона
- •Сущность эффекта Джоуля-Томсона
- •Расчет дифференциального эффекта Джоуля-Томсона
- •Расчет интегрального эффекта Джоуля-Томсона
- •14.5. Методы получения низких температур
- •Метод противоточного обмена теплотой
- •Метод адиабатического размагничивания
- •15.1. Условие равновесия фаз химически однородного вещества
- •15.2. Классификация фазовых переходов по Эренфесту
- •Фазовые переходы первого рода
- •Фазовые переходы второго рода
- •15.3. Фазовые переходы первого рода. Диаграмма состояний
- •15.4. Уравнение Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса методом циклов
- •Актуальные свойства процесса
- •Постановка задачи
- •Вывод уравнения
- •15.5. Диаграмма состояний гелия. Сверхтекучесть жидкого гелия.
- •16.1. Релаксационные процессы в молекулярных системах
- •16.2. Стационарные уравнения переноса в газах, жидкостях и твердых телах
- •Уравнение теплопроводности
- •Уравнение самодиффузии
- •Уравнение внутреннего трения
- •16.3. Внутренняя теплопроводность и внешняя теплопередача
- •Стационарное распределение температуры в бесконечной плоско-параллельной пластинке
- •Стационарное распределение температуры между двумя концентрическими бесконечно длинными цилиндрами
- •Стационарное распределение температуры между двумя концентрическими сферами
- •Внешняя теплопередача
- •17.1. Столкновения молекул и их количественные характеристики
- •Эффективное сечение молекул
- •Средняя длина свободного пробега молекулы
- •Кинематические параметры и
- •17.2. Обобщенное уравнение переноса
- •Вывод обобщенного уравнения процесса Описание системы
- •Актуальные свойства модели процесса
- •Постановка задачи
- •Вывод уравнения
- •17.3. Элементарная кинетическая теория теплопроводности,
- •17.4. Явления переноса в ультраразреженных газах
- •Трение и теплопроводность ультраразреженных газов
- •Тепловая и изотермическая эффузия
- •18.1. Атмосфера как открытая система и как открытая книга
- •18.2. Состав и структура атмосферы Земли.
- •18.3. Термофизическая модель атмосферы
- •18.4. Парниковый эффект
- •Сущность парникового эффекта
- •Парниковые газы
- •Проблема глобального потепления
- •Киотский протокол
- •18.5. Инверсия температуры в стратосфере. Озоносфера Земли
- •Мониторинг озонового слоя
- •Монреальский Протокол
- •18.6. Концепция «ядерной зимы»
- •«Ядерная зима» Сценарии ядерной войны
- •Огненные смерчи – суперподъемники
- •Антипарниковый эффект
- •Глобальный характер климатических последствий
- •Список литературы
- •Общая физика. Молекулярная физика
- •660041, Г. Красноярск, пр. Свободный, 79
1.2. Масштабы физических величин в молекулярном мире
Пока не будем касаться масштабов величин
в мире элементарных частиц и прочей
экзотики. Рассмотрим обычные атомы и
молекулы. Самый малый и самый
распространенный во Вселенной атом,
атом водорода, имеет размер
 .
Эту величину надо обязательно запомнить!
С ней мы будем сравнивать все другие
пространственные размеры и расстояния.
Ясно, что другие атомы имеют несколько
большие размеры, а именно до
.
Эту величину надо обязательно запомнить!
С ней мы будем сравнивать все другие
пространственные размеры и расстояния.
Ясно, что другие атомы имеют несколько
большие размеры, а именно до м
(атом урана). Размеры молекул изменяются
в более широких пределах
м
(атом урана). Размеры молекул изменяются
в более широких пределах ÷
÷ .
Кстати, 1 нанометр =
.
Кстати, 1 нанометр = м,
а с приставки НАНО начинается название
новой, бурно развивающейся науки
нанотехнологии.
м,
а с приставки НАНО начинается название
новой, бурно развивающейся науки
нанотехнологии.
Использование методик, основанных на манипуляциях с отдельными атомами и молекулами, позволяет создавать устройства, имеющие размеры 1÷ 100 нм. В настоящее время это направление является наиболее перспективным для получения новых материалов, полупроводниковых приборов, устройств для записи информации, фармацевтических препаратов и многого другого.
Вернемся к масштабам. Массы атомов по
порядку величины заключены в пределах
от
 кг
(атом водорода) до
кг
(атом водорода) до кг
(атом урана). Массы молекул имеют значения
от 10-27кг (молекула водорода) до
кг
(атом урана). Массы молекул имеют значения
от 10-27кг (молекула водорода) до кг
(крупные белковые молекулы).
кг
(крупные белковые молекулы).
Количество частиц в макросистемах столь велико, что его удобно измерять в особых единицах – молях. Моль это количество вещества, содержащее число структурных элементов, равное постоянной Авогадро:

В молях можно измерять количества любых
структурных элементов. Например, если
в некотором сосуде содержится 1 моль
молекул кислорода
 ,
то там имеется 2 моль атомов кислорода,
или 16 моль протонов, 16 моль нейтронов и
16 моль электронов.
,
то там имеется 2 моль атомов кислорода,
или 16 моль протонов, 16 моль нейтронов и
16 моль электронов.
Молю соответствует масса, её называют
молярной массой µ, для различных веществ
она разная, поскольку массы их молекул
 отличаются друг от друга
отличаются друг от друга
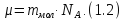
Молярная масса выражается в кг/моль. Её
можно рассчитать для каждого вещества
на основе его химической формулы,
используя массовые числа из таблицы
Менделеева. Зная
 и массу вещества
и массу вещества легко найти количество молей его молекул.
легко найти количество молей его молекул.

Представление о масштабах времени в
молекулярных системах можно получить
хотя бы из того факта, что при нормальных
условиях в воздухе каждая молекула газа
за 1 с испытывает около
 столкновений с другими частицами. Такая
яркая, насыщенная событиями жизнь. Ведь
при каждом столкновении, происходящем
в среднем через
столкновений с другими частицами. Такая
яркая, насыщенная событиями жизнь. Ведь
при каждом столкновении, происходящем
в среднем через с,
меняется скорость и энергия молекулы,
изменяется ее состояние. Наблюдая
макросистемы, мы, как правило, измеряем
длительность происходящих в них
макропроцессов в интервале 10-6÷105с.
с,
меняется скорость и энергия молекулы,
изменяется ее состояние. Наблюдая
макросистемы, мы, как правило, измеряем
длительность происходящих в них
макропроцессов в интервале 10-6÷105с.
1.3. Теоретические и экспериментальные методы молекулярной физики
Дискретная структура вещества не
вызывает сомнений, но для теоретического
описания макросистем во многих случаях
оказывается полезным представление о
веществе как о сплошной среде. Такое
представление материи называется
макроскопическим в отличие от
молекулярного, микроскопического. Его
правомерность основана на том, что
размеры молекул и расстояния между ними
много меньше размеров макроскопических
тел. Вещество как непрерывный континуум
характеризуется плотностью
 .
Для однородных тел
.
Для однородных тел

где
 и
и – масса и объем тела соответственно.
– масса и объем тела соответственно.
Анализ возможностей изучения систем многих частиц показал, что динамическое описание таких систем «неосуществимо с технической, не пригодно с теоретической и бесполезно с практической точек зрения» [11]. Поэтому поиск теоретических подходов шел в направлении использования информации, имеющей обобщенный характер, т.е. относящейся ко всей системе в целом. В результате были разработаны два радикально отличающихся друг от друга метода исследования макросистем: статистический и термодинамический. Эти методы имеют и другие названия, которые приведены ниже на схеме 1.3.1. Следует иметь в виду, что зачастую молекулярной физикой называют только статистическую физику, точнее её основы, например, в названии учебника «Термодинамика и молекулярная физика» [14].
Далее в 1.5 мы дадим развернутые характеристики статистического и термодинамического подходов в описании макросистем и сформулируем их задачи.
Говоря об экспериментальных методах молекулярной физики отметим, что они чрезвычайно разнообразны. Действительно, изучение структурных, электрических, магнитных, тепловых и механических свойств макросистем требует совершенно разных измерительных инструментов и методов. Их разнообразие обязано также специфике свойств разных агрегатных состояний вещества. Газ, жидкость, твердое тело, плазма – это по сути объекты относительно самостоятельных научных направлений, каждое из которых имеет развитую экспериментальную базу (физика твердого тела, физика плазмы и т.д.).
Схема 1.3.1.

Дисциплина «Молекулярная физика» основывается на обобщении многочисленных результатов экспериментальных исследований в этих разных областях. Поэтому вам следует приготовиться к накоплению знаний о реальных макросистемах, необходимых для практической деятельности и для дальнейшего изучения дисциплин естественнонаучного цикла. Главная цель, которая ставится перед вами, заключается в освоении методов изучения макросистем. Заявив о наших целях, необходимо уточнить предметную область дисциплины, определенную в 1.1.
