
XAXANINA
.pdfбавьте по 15 мл 1 н HNO3, 10 мл 10%-ного раствора тиомочевины, дистиллированной во-
ды до метки и перемешайте.
Измерив оптическую плотность всех растворов, постройте калибровочный график.
При этом по оси абсцисс отложите известные концентрации ионов Bi3+ (т.е. 0,02; 0,04; 0,06; 0,10 мг висмута в 1 мл), а по оси ординат - соответствующие им оптические плотно-
сти растворов.
Для определения висмута в исследуемом растворе, приготовленном в колбе на 50
мл, добавьте 15 мл 1 н HNO3, 10 мл 10%-ного раствора тиомочевины, дистиллированной воды до метки и перемешайте.
Наполните раствором кювету и измерьте оптическую плотность раствора при тех же условиях, при каких был получен калибровочный график.
Зная оптическую плотность, найдите по графику концентрацию иона Bi3+ в мг на 1
мл раствора. Умножив ее на объем всего анализируемого раствора (50 мл), вычислите об-
щее количество висмута.
51
Работа № 8 Определение титана и ванадия при их совместном присутствии
Определение титана и ванадия при их совместном присутствии основано на разли-
чии спектров поглощения пероксидных комплексов титана [TiO(H2O2)]2+ и ванадия
[VO(H2O2)]3+.
Приготавливают окрашенный раствор смеси катионов титана и ванадия и измеряют ее оптическую плотность при 619 нм, когда свет поглощает практически лишь окрашен-
ный комплекс ванадия, и при 400 нм, когда наблюдается суммарное светопоглощение ок-
рашенными соединениями обоих катионов.
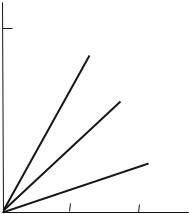
Методом калибровочного графика измеряют оптическую плотность серии стан-
дартных растворов титана и ванадия при двух длинах волн: λ = 400 нм и λ = 619 нм (кривые 1
и 2 на рис.3) и стандартных растворов ванадия при λ = 400 нм (кривая 3 на рис.3).
A
1,0
3
0,8 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||
0,6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,4 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
0,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
0 |
0,1 |
0,3 |
0,5 |
||||
|
|
|
|
|
C, мг/50 мл |
||
Рис.3. Калибровочные графики для определения титана и ванадия при их совместном присутствии: 1 - ванадий (λ = 400 нм); 2 - ванадий (λ = = 619 нм); 3 - титан (λ = 400 нм)
Затем измеряют оптическую плотность (Ax619) исследуемого раствора, содержащего вместе ионы титана и ванадия, при λ = = 619 нм и по кривой 2 сразу же определяют концен-
трацию ванадия в анализируемом растворе. Одновременно по кривой 3 находят по этой кон-
центрации оптическую плотность (Ax400) раствора ванадия при λ = 400 нм, оставив только долю (ATi400 = A400Ti+V – AV400), и по кривой 1 определяют концентрацию Ti в исследуемой смеси.
52
Оборудование и реактивы
Фотоколориметр или спектрофотометр.
Кюветы на 2 см, 3 - 4 шт.
Пипетки на 10 мл, на 2 мл по 2 шт.
Колбы мерные на 50 мл, 12 шт.
Пероксид водорода, 3%-ный раствор.
Серная кислота, 5%-ный раствор.
Стандартный раствор ванадия - 0,2 мг V (V) в 1 мл - готовят растворением 0,4593 г
NH4VO3 в 100 мл H2SO4 (1:1) и разбавлением водой до 1 л.
Стандартный раствор титана - 0,2 мг Ti (IV) в 1 мл - готовят растворением 0,8183 г
TiOSO42H2O в 100 мл H2SO4 (1:1) и разбавлением водой до 1 л.
Описание определения
Для построения калибровочных графиков для ванадия в четыре мерные колбы на
50 мл добавьте соответственно 0,2; 0,4; 0,8; 1,2 мл стандартного раствора ванадия, по 20
мл воды, по 5 мл 5%-ной H2SO4, по 3 мл 3%-ной H2O2. Содержимое колб разбавьте водой до метки. Растворы фотометрируйте относительно воды при λ = 619 нм и λ = 400 нм.
Для построения калибровочного графика для титана в четыре мерные колбы на 50
мл добавьте соответственно 0,2; 0,4; 0,8; 1,2 мл стандартного раствора титана, по 20 мл воды, по 5 мл 5%-ной H2SO4, по 3 мл 3%-ной H2O2. Содержимое колб разбавьте водой до метки. Растворы фотометрируйте относительно воды при λ = 400 нм.
Анализируемую пробу воды, содержащую ванадий и титан, перенесите в мерную колбу на 50 мл, добавьте 5 мл 5%-ной H2SO4, 3 мл 3%-ной H2O2 и воды до метки. Фото-
метрируйте относительно воды при λ = 400 нм и λ = 19 нм.
Определение концентрации титана и ванадия проведите, как описано в начале ра-
боты.
53
Работа № 9 Спектрофотометрическое определение примесей нефти и
нефтепродуктов в природной воде
Нефть и нефтепродукты являются наиболее распространенными загрязняющими веществами в Мировом океане. К началу 80-х годов в океан ежегодно поступало около 6
млн т нефти, что составляло 0,23% всей мировой ее добычи.
Аварийные ситуации, слив за борт танкерами промывочных и балластных вод и т.п. обуславливают присутствие постоянных полей загрязнения на трассах морских путей.
Большие массы нефти и нефтепродуктов поступают в море по рекам, с бытовыми и лив-
невыми стоками. Объем загрязнений из этого источника составляет 2,0 млн т/г. С про-
мышленными стоками в природные воды попадает дополнительно 0,5 млн т/г.
Нефть представляет собой вязкую маслянистую жидкость темно-коричневого цве-
та, обладающую слабой флуоресценцией.
Основные компоненты нефти - углеводороды - подразделяют на четыре класса:
а) парафины (алканы) (до 50% по массе от общего состава) - устойчивые вещества,
молекулы которых состоят из прямой или разветвленной цепи атомов углерода, соеди-
ненных между собой одинарными связями. Легкие парафины обладают максимальной ле-
тучестью и растворимостью в воде;
б) циклопарафины (30 - 60% по массе от общего состава) - насыщенные цикличе-
ские соединения с пятью - шестью атомами углерода в кольце. Кроме циклопентана и циклогексана в нефти встречаются бициклические и полициклические соединения этой группы. Они очень устойчивы и плохо поддаются биоразложению;
в) ароматические углеводороды (арены) (20 - 40% по массе от общего состава) -
ненасыщенные циклические соединения ряда бензола. В нефти присутствуют в основном бензол, толуол, ксилол, пирен и его производные, а также нафталин;
г) олефины (алкены) (до 10% по массе от общего состава) - ненасыщенные нецик-
лические соединения с прямой или разветвленной углеродной цепью, содержащей одну или две двойные связи.
Выделяют пять типов воздействия нефти на водные экосистемы:
1)непосредственное отравление живых организмов с летальным исходом;
2)нарушение физиологической активности у гидробионтов;
3)прямое обволакивание нефтепродуктами живого организма;
4)возникновение болезней, вызванных попаданием в организм углеводородов;
5)негативные изменения в среде обитания.
54
Попадая в водоемы, нефть и нефтепродукты растекаются по поверхности воды, об-
разуя пленку различной толщины. По внешнему виду пленки можно определить ее тол-
щину (табл.8)
Таблица 8
Внешний вид пленки нефти на поверхности воды в зависимости от ее толщины и количества нефти
Внешний вид пленки нефти |
Толщина, мкм |
Количество нефти, л/км2 |
Едва заметна |
0,038 |
44 |
Серебристый отблеск |
0,076 |
88 |
Следы окраски |
0,152 |
176 |
Ярко окрашенные разводы |
0,305 |
352 |
Тускло окрашенные разводы |
1,016 |
1170 |
Темно окрашенные разводы |
2,032 |
2310 |
Нефтяная пленка изменяет спектральный состав и интенсивность попадающего в воду света. Пропускание света тонкими пленками нефти на длине волны 280 нм составля-
ет 1 - 15%, а на длине волны 400 нм - 60 - 70%. Пленка толщиной 30 - 40 мкм полностью поглощает инфракрасное излучение.
При естественном перемешивании воды пленки нефти разрушаются с образова-
нием устойчивых эмульсий в толще воды, которые частично растворяются или осед а-
ют на дно. Аэробные бактерии, деятельность которых обуславливает естественное с а-
моочищение водоемов, окисляют компоненты нефти до нетоксичных соединений, а в конечном счете до углекислого газа и воды. Большинство метаболических превращ е-
ний углеводородов нефти под действием бактерий сводятся к следующему:
H3C (CH2 )n CH3 O2 H3C (CH2 )n 1 COOH CO2 H2O .
Таким образом, в окружающей среде оказываются значительно менее вредные со-
единения. Однако эти превращения идут очень медленно и лишь при определенных усло-
виях (достаточной концентрации кислорода и температуре воды не ниже 5 - 10 С).
Бактерии разных видов селективно разрушают определенные компоненты нефтя-
ного загрязнения, поэтому для полного самоочищения воды требуется наличие опреде-
ленного комплекса микроорганизмов. При этом н-алканы, например, разлагаются значи-
тельно быстрее и легче, чем более устойчивые циклопарафины и ароматические углеводороды, однако последние быстрее растворяются. Легколетучие низкомолекуляр-
ные компоненты нефтяного загрязнения испаряются с поверхности нефтяной пленки и могут вызвать локальное загрязнение тропосферы. Предельно допустимая концентрация паров нефти составляет 10 мг/л. Содержание паров нефти в воздухе выше этого значения может вызвать болезни органов дыхания и нервной системы человека.
55
В пресноводных водоемах летальной концентрацией нефтепродуктов для взрослых особей рыб считается около 10 - 15 мг/л; при значительно более низких концентрациях
(0,05 - 1,0 мг/л) гибнут икра и мальки, а также планктон - кормовая база рыб.
Определение содержания нефти и нефтепродуктов в воде базируется на измерении светопоглощения на длинах волн 400 и 280 нм, а также в ИК-диапазоне. При таком опре-
делении удобно использовать метод калибровочного графика.
Оборудование и реактивы
Спектрофотометр.
Кварцевые кюветы на 1 см, 3 - 4 шт.
Пипетки на 10 мл, 2 шт.
Колбы мерные на 25 мл, 10 шт.
Бензин.
Описание определения
Построение калибровочного графика. Готовят две серии стандартных растворов:
первая серия - растворы, содержащие от 4 до 15% бензина в воде; вторая серия - растворы,
содержащие от 50 до 70% бензина в воде. Для этого в мерные колбы на 25 мл помещают соответственно 1,0; 2,0; 3,0 и 4,0 мл (первая серия) и 12,0; 15,0; 17,0 и 19,0 мл (вторая се-
рия) бензина. Добавляют дистиллированную воду до метки и измеряют оптическую плот-
ность первой серии стандартных растворов на длине волны 280 нм, а второй серии - на длине волны 400 нм в кюветах с толщиной слоя 1 см по отношению к чистой дистиллиро-
ванной воде. По полученным данным строят калибровочные графики зависимости опти-
ческой плотности от концентрации бензина в воде.
Анализ проб воды. Исследуемую воду, содержащую бензин, помещают в кювету с толщиной слоя 1 см и измеряют оптическую плотность раствора на длинах волн 280 и 400
нм аналогично тому, как это делалось при построении калибровочного графика. По вели-
чине оптической плотности выбирают необходимый калибровочный график, по которому и определяют содержание бензина в воде.
Пример контрольного теста
1. Закон Бугера - Ламберта - Бера: а) имеет вид …; б) размерность С:
1)а) A = Cℓ; б) моль/л;
2)а) A = ℓC; б) моль/л;
56
3)a) A = ℓC; б) мг/л;
4)а) A = C; б) моль/л.
2. Молярный коэффициент поглощения комплекса алюминия с алюминоном равен
2,4·104. Какова чувствительность определения алюминия (в моль/л) с помощью алюмино-
на, если A = 0,05, а ℓ = 1 см?
1)3,5·10–8;
2)2,1·10–6;
3)2,7·10–3;
4)4,3·10–5.
3.Каким из перечисленных методов нельзя фотометрически определять примеси? 1) методом калибровочного графика; 2) методом добавок; 3) методом Грана;
4) методом ограничивающих растворов.
4.Выразить концентрацию (в моль/л) анализируемого раствора KMnO4, если опти-
ческая плотность раствора А = 0,8, = 2420, а толщина кюветы 20 мм.
1)1,65·10–4;
2)3,11·10–5;
3)2,65·10–3;
4)1,65·10–6.
5. Содержание Hg2+ в воде, определенное методом добавок на фотоэлектроколо-
риметре, составило 5∙10–6 ммоль/л. Истинное значение Hg2+ в этом растворе равнялось
0,011 мг/л. ПДК Hg - 0,0005 мг/л, А(Hg) = 200,59. Определить: а) относительную ошибку
анализа; б) соотношение к ПДК примеси.
1) |
а) |
1,0%; |
б) в 20 раз превышает ПДК; |
2) |
а) |
–0,01; |
б) в 2 раза превышает ПДК; |
3) |
а) |
9,0%; |
б) в 20 раз превышает ПДК; |
4) |
а) |
91%; |
б) в 2 раза превышает ПДК. |
57
АНАЛИЗ ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ ЭЛЕКТРОХИМИЧЕСКИМИ МЕТОДАМИ
Потенциометрия и ионометрия
Каждый электрохимический параметр (потенциал, сила тока, сопротивление и др.)
связан с концентрацией анализируемого раствора.
В основе электрохимических методов лежит процесс электролиза - химические ре-
акции, протекающие под действием электрического тока на электродах, помещенных в
раствор электролита.
Различают прямые и косвенные электрохимические методы. В прямых методах ис-
пользуют зависимость потенциала (силы тока и т.д.) от концентрации определяемого ком-
понента, в косвенных методах потенциал (силу тока и т.д.) измеряют с целью нахождения конечной точки титрования, т.е. используют зависимость измеряемого параметра от объе-
ма титранта.
Для любого рода электрохимических измерений необходима электрохимическая
ячейка, составной частью которой является анализируемый раствор.
Если электрохимическая ячейка работает в режиме гальванического элемента (ГЭ) (ток возникает в результате самопроизвольной химической реакции), необходимо наличие
двух электродов: индикаторного и электрода сравнения.
Индикаторными электродами могут служить: стеклянный, хингидронный, сурьмя-
ный, водородный, серебряный, платиновый.
Индикаторный электрод обратим по катиону:
|
|
Me – nē Men+. |
|
|
|||
Уравнение Нернста для него имеет вид: |
|
|
|||||
|
RT |
ln a |
|
или |
0,059 |
ln Men , |
|
|
Men |
|
|||||
|
nF |
|
|
n |
|||
|
|
|
|
||||
a = [Men+] f,
где а - активность ионов; f - коэффициент активности; φ - стандартный электрод-
ный потенциал; [Men+] - концентрация ионов металлов, моль/л.
Электродами сравнения могут быть: хлоридсеребряный, каломельный, водородный.
Для измерения pH раствора необходим электрод, который реагирует на изменение
[H+]. Такими электродами могут быть водородный, хингидронный, стеклянный, сурьмя-
ный.
Наиболее удобен в работе стеклянный электрод, состоящий из тонкой pH-
чувствительной мембраны, изготовленной из стекла, содержащего 22% оксида натрия, 6%
58
оксида кальция и 72% оксида кремния. Внутри стеклянной мембраны находится хлорид-
серебряный электрод, погруженный в 0,1 н раствор HCl.
В качестве электрода сравнения наиболее часто применяют хлоридсеребряный электрод, состоящий из серебряной проволочки, электролитически покрытой слоем хло-
рида серебра и погруженной в раствор хлорида калия. Потенциал такого электрода оп-
ределяется уравнением AgCl + ē = Ag + Cl− , φ = φ AgCl/Ag,Cl− − 0,059lg[Cl−] и при 25 С
равен 0,222 В.
Схема ГЭ имеет вид:
Ag|AgCl|0,1 н HCl|стекло[H+]|HClнасыщ.|AgCl|Ag.
Потенциал стеклянного электрода описывается уравнением
φ = K +0,059lg aH+,
где K - константа, зависящая от сорта стекла и устройства электрода; aH+ - актив-
ность ионов водорода.
Для определения K стеклянный электрод калибруют по нескольким буферным рас-
творам. Электрод позволяет измерять pH от 0 до 13. На рис.4 показаны стеклянный и хло-
ридсеребряный электроды.
В качестве электрода сравнения вместо хлоридсеребряного электрода можно при-
менять каломельный электрод. Он состоит из ртути, покрытой пастой Hg2Cl2, и погружен в насыщенный раствор KCl. Проволочка из пластины, опущенная в эту пасту, осуществ-
ляет контакт.
В основе работы каломельного электрода лежит окислительно-восстановительная полуреакция:
Hg2Cl2 (тв.) + 2ē 2Hg + 2 Cl–.
Схема ГЭ с использованием каломельного электрода в качестве электрода сравне-
ния имеет вид:
Ag|AgCl|0,1 н HCl|стекло|[H+]|KClнасыщ.|Hg2Cl2|Hg.
Потенциал насыщенного каломельного электрода при 25 C равен 0,24 B.
Электроды сравнения содержат два раствора хлорида калия, один из которых
(внешний) служит солевым мостиком и одновременно предотвращает загрязнение другого
(внутреннего) раствора, исключая его контакт с анализируемым раствором.
59
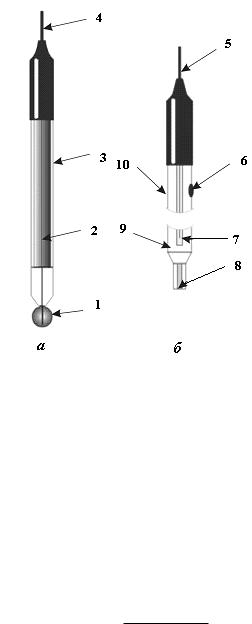
Рис.4. Стеклянный (а) и хлоридсеребряный (б) электроды: 1 - рН-чувствительная мембрана; 2 - 0,1 М раствор HCl, насыщенный AgCl; 3, 7 - серебряная проволочка, покрытая осадком AgCl и погруженная в KCl насыщ. (внутренний раствор); 4, 5 - контакты; 6 - отверстие для ввода раствора KCl; 8 - асбестовое волокно, обеспечивающее контакт с анализируемым раствором; 9 - внешний раствор KCl насыщ.; 10 - стеклянный корпус
Такие электроды называют электродами с двойным солевым мостиком. ЭДС ГЭ Е
рассчитывается по разнице потенциалов электродов сравнения и индикаторного: E = φAgCl/Ag, Cl− − φстекл, так как φстекл = 0,059[H+],
E = φAgCl/Ag, Cl− − 0,059[H+] (pH = − lg[H+]),
pH = E AgCl/Ag,Cl .
0,059
Этот расчет автоматически выполняет иономер, и на панели прибора сразу выдает-
ся значение pH.
60
