
- •Электронное строение атома и периодический закон
- •Особенности состояния электронов в атоме
- •Атом
- •Число электронов в нейтральном атоме равно числу протонов.
- •Модели строения атома
- •Квантово-механическая модель
- •Движение микрочастиц в квантолвой механике описыватся уравнением Шредингера.
- •Электроны движущиеся на орбиталях близких размеров образуют энергетические уровни.
- •Квантовые числа
- •Главное квантовое число
- •Орбитальное квантовое число
- •Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например,
- •Магнитное квантовое число
- •Оно принимает все целочисленные значения от
- •Формы s-, p-, d- и f-орбиталей
- •Спиновое число
- •Общая таблица по квантовым числам
- •Энергетический уровень
- •При составлении электронных конфигураций многоэлектронных атомов учитывают:
- •Последовательность заполнения электронных подуровней
- •Применим правило Клечковского
- •3. Запрет Паули
- •При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда: в
- •Составление электронных формул
- •3. электронная формула в виде энергетических ячеек.
- •Валентность - способность атома к образованию химических связей
- •Периодический закон
- •Атомный радиус
- •уменьшение
- •Зависимость радиуса атомов от заряда ядра
- •Атомные радиусы
- •Энергия ионизации
- •Первая энергия ионизации
- •Первая энергия ионизации
- •Сродство к электрону
- •Электроотрицательность
- •Таблица электроотрицательностей элементов по Полингу
- •Электроотрицательности атомов

Электронное строение атома и периодический закон

Особенности состояния электронов в атоме
Свойства элементов определяются количеством электронов и их пространственным расположением относительно ядра в атоме.
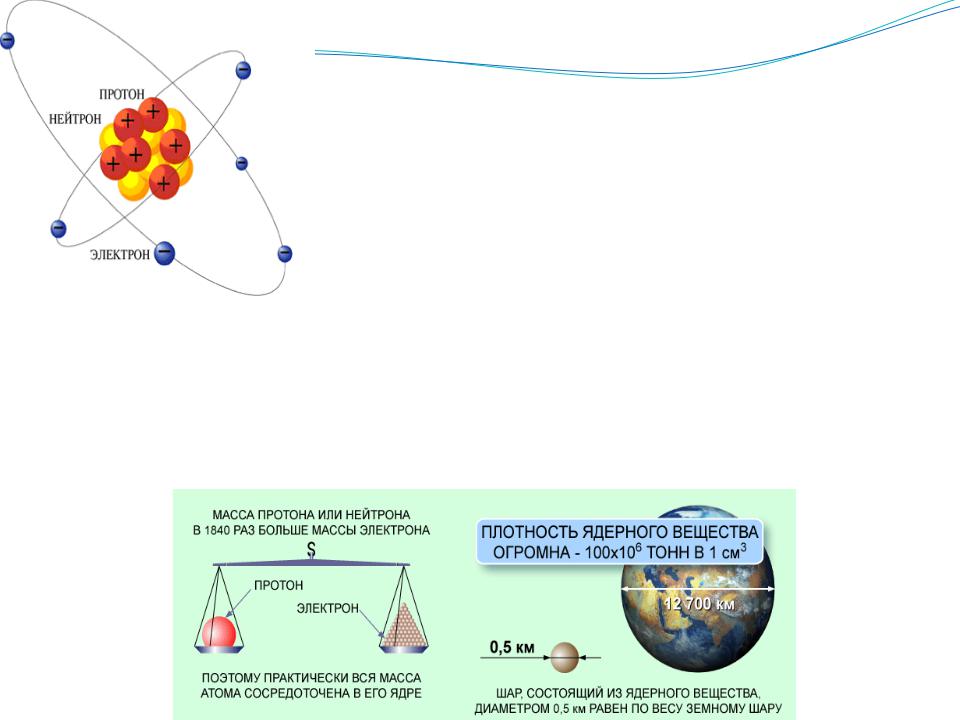
Атом
ААтом— наименьшая часть химического элемента, являющаяся носителем его свойств.
Ядро атома состоит из положительно заряженных протонов(p) и электрически нейтральных нейтронов (n), а окружающее его облако состоит из отрицательно заряженных электронов.
Масса атома сосредоточена в ядре. ядро занимает примерно 1/10 часть объема атома
Число электронов в нейтральном атоме равно числу протонов.
Порядковый номер элементов в таблице Д. И. Менделеева (Z) равен заряду ядра (т.е. количеству протонов).
Атомы одного элемента с одинаковыми зарядами ядер, но разными массовыми числами
A=p+n (суммой протонов и нейтронов), называются изотопами

Модели строения атома

Квантово-механическая модель
атома
Уравнение Шредингера
|
h |
2 |
|
|
2 |
|
|
2 |
|
|
2 |
|
|
|
|
|
|
d |
|
d |
|
d |
|
U E |
|||||
|
2 |
|
|
2 |
|
2 |
||||||||
8 |
|
|
dx |
2 |
dy |
dz |
|
|||||||
|
|
m |
|
|
|
|
|
|
|
|||||
Двойственная природа электрона:
e
 me 10 28 г
me 10 28 г
hmv 10 8 см

Движение микрочастиц в квантолвой механике описыватся уравнением Шредингера.
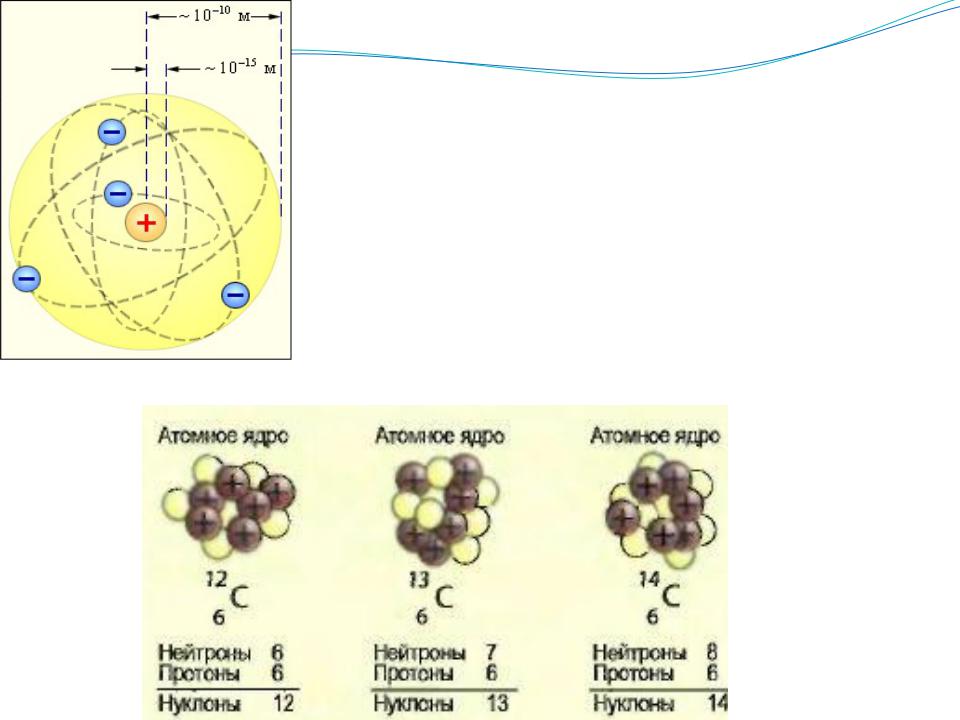
Ψ- называется волновой функцией, квадрат которой характеризует плотность вероятности нахождения частицы в данном месте пространства.
Атомная орбиталь - трехмерная область пространства, вероятность нахождения электрона в которой превышает 90%

Электроны движущиеся на орбиталях близких размеров образуют энергетические уровни.
Энергетические уровни, кроме первого, состоят из подуровней.
Каждая атомная орбиталь (ее энергия, форма, размер, ориентация в пространстве) характеризуется набором целочисленных параметров n, l, m- называемых квантовыми числами.

Квантовые числа
Главное квантовое число n
Орбитальное квантовое число l
Магнитное квантовое число m
Спиновое квантовое число s

Главное квантовое число
Главное квантовое число может принимать положительные целочисленные значения:
n=1, 2, 3,..7..,∞
Главное квантовое число характеризует: * удаленность уровня от ядра
*уровень энергии электрона в атоме *количество подуровней на данном уровне.
