
- •Электрохимические
- •процессы
- •Механизм образования двойного электрического слоя
- •Двойной электрический слой
- •Электродный потенциал
- •Уравнение Нернста
- •Cтандартный электродный потенциал
- •Типы электродов
- •Электроды 1-го рода
- •Металлический электрод
- •Неметаллический электрод
- •Электроды второго рода
- •Стандартный водородный электрод
- •Водородный электрод
- •Кислородный электрод
- •Гальванические
- •гальванические
- •Cхема гальванического элемента
- •Мерой работоспособности ГЭ элемента
- •Типы гальванических элементов
- •Концентрационные
- •Окислительно-восстановительный электрод
- •Необратимые гальванические
- •Электрический аккумулятор
Электрохимические
системы

процессы
Любые процессы взаимного превращения химической и электрической форм энергии называются
электрохимическими.
Электрохимический способ – хаотический перенос электронов преобразуется в направленный процесс, т.е. от восстановителя
через внешнюю цепь к
В электрохимическом процессе полуреакции окисления и восстановления

Механизм образования двойного электрического слоя
Cu 0 – 2e = Cu2+ Cu2+ + 2e = Cu0
Электродный потенциал E – разность потенциалов между металлом и его катионами в растворе, возникающая при образовании двойного электрического слоя.
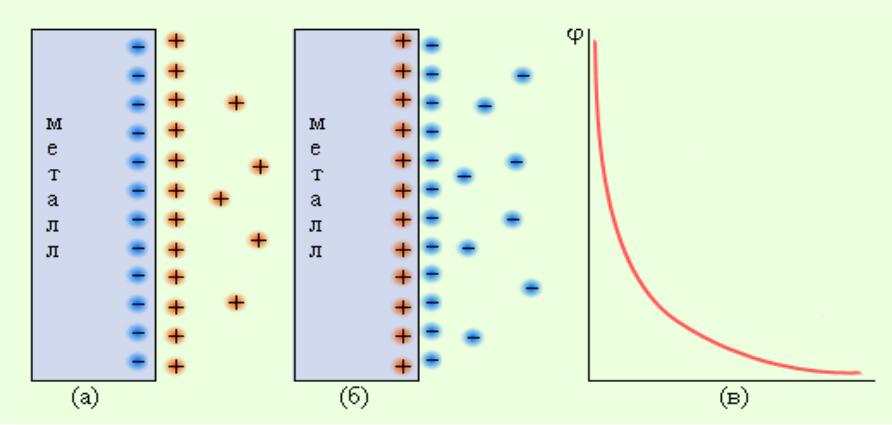
Двойной электрический слой
Возникновение электронного потенциала на границе раздела фаз связано с неравноценностью энергетического состояния компонентов в контактирующих фазах.

Двойной электрический слой Pb2++S2-→PbS
ДЭС может образоваться в результате:
1.Обмена ионами между металлом и раствором
2.Адсорбции ионов на поверхности электрода
3.Выхода электронов из кристаллической решётки электрода

Электродный потенциал
•Потенциал, который устанавливается на
границе раздела фаз (электрод- электролит) в результате протекания равновесной электродной реакции
Зависит от:
•Химической природы электрода и электролита и вида электродной реакции
•Концентрации веществ, участвующих в электродной реакции
•Температуры

Уравнение Нернста
Электродная
реакция
ОК + ze- ВОС
Еок/вос-стандартный электродный потенциал
R |
–универсальная |
газовая |
постоянная |
|||||||||||
(8.31Дж/моль К) |
|
|
|
|
|
|
|
|
|
|
||||
T – абсолютная температура, К |
(96500кулон/моль |
|||||||||||||
F |
– |
число |
|
Фарадея |
||||||||||
электронов) |
|
0,059 |
lg |
Сок |
Eок0 |
вос |
0.0257 |
ln |
Сок |
|||||
Eок / вос Еок0 |
/ вос |
|
z |
|
Свос |
z |
Свос |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||

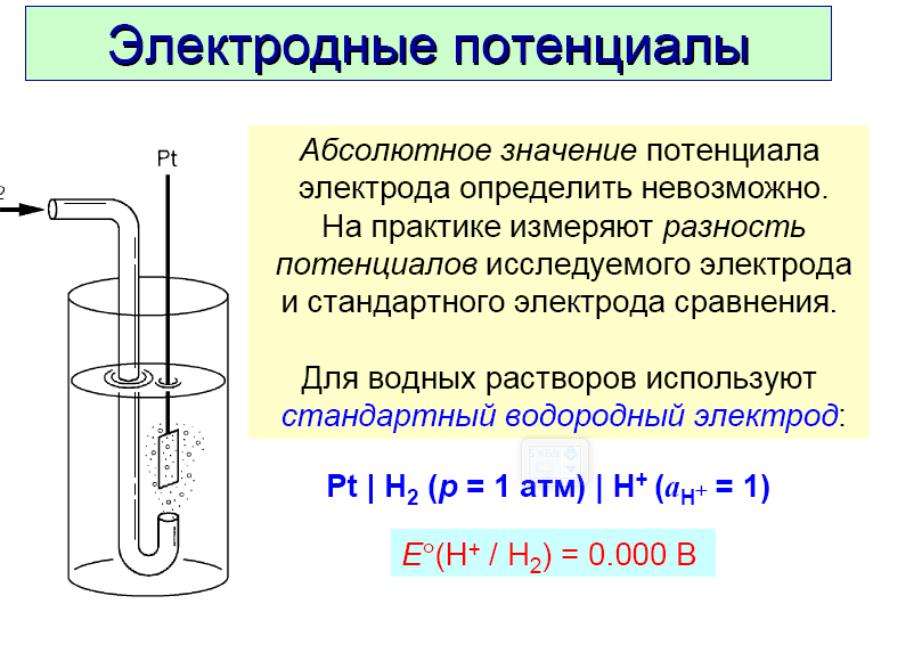
Cтандартный электродный потенциал
Величина электродного потенциала определяется по водородной шкале. В качестве «0» выбран стандартный водородный электрод. По сравнению с водородным электродом потенциал других элементов имеет положительное или отрицательное значение.
Типы электродов
•Электроды 1-го рода
•Электроды 2-го рода
•Окислительно-восстановительные электроды
•Ионоселективные электроды
•Газовые электроды
