
- •Химическая связь
- •Природа химической связи
- •ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- •Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния
- •1.Энергия химической связи (Есв) -
- •Длины и энергии химических
- •3. Полярность связи – возникновение
- •Чем больше разность электроотрицательностей, взаимодействующих атомов, тем более полярна связь.
- •Смещение электронной
- •Поляризуемость химической
- •Теории химической связи
- •Основные положения метода ВС
- •5.В пространстве х. с. располагается в том направлении, в котором возможность перекрывания АО
- •8. Связь, образованная перекрыванием АО по линии, соединяющей центры атомов, называется – σ-
- •Основные виды химической
- •Ковалентная связь
- •Механизмы образования ковалентной связи
- •Обменный механизм
- •Донорно-акцепторный механизм
- •Гибридизация атомных орбиталей
- •Формы гибридных орбиталей
- •Гибридизация
- •Ионная связь
- •При возникновении ионной связи более электроотрицательный
- •Металлическая связь
- •Свойства соединений с металлической связью
- •Металлическая связь не проявляет свойств насыщаемости, направленности, но ей характерны высокие координационные числа
- •Водородная связь
- •Водородная связь
- •Температуры кипения соединений водорода
- •белки
- •Межмолекулярные взаимодействия
- •.Межмолекулярные взаимодействия

Химическая связь
Природа химической связи
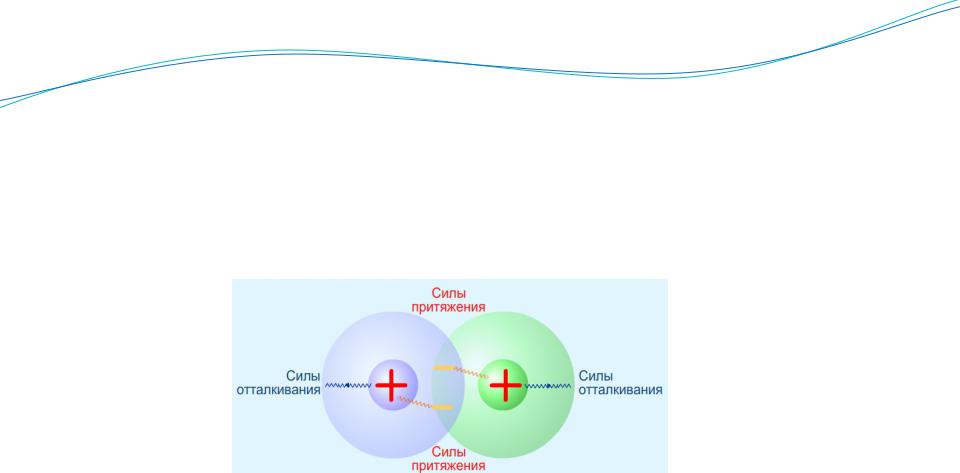
Химическая связь – совокупность сил притяжения и отталкивания, создающая динамически устойчивую систему из двух и более атомов.
Основной причиной образования химических связей между атомами является понижение полной энергии системы при переходе от свободных атомов к молекуле.

ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
1. Энергия связи (Прочность
связи)
2.Длина связи
3.Полярность связи
4.Валентный угол
5.Поляризуемость связи

Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами атомов
Е
кДж/моль
- 435
|
Хим. св. не обр. |
|
0,074 |
↑↑ |
|
|
|
|
r0 |
↑↓r,нм |
|
|
||
Fпр.< Fотт. Fпр. >Fотт. |
Хим. св. обр. |
|
Fпр.= Fотт. |
|
|

1.Энергия химической связи (Есв) -
доля энергии расщепления молекулы газообразного вещества на газообразные атомы, приходящаяся на одну связь
Н2О(г) = 2Н(г) + О(г), ΔH-энергия диссоциации Н—О —Н Н2О - газ
Е= ΔH/2, (т.к. 2 связи)
2. Длина связи (lсв) – среднее
равновесное расстояние между ядрами химически связанных атомов в молекуле.

Длины и энергии химических
связей
Химическая связь |
Е, В |
L, нм |
|
Ковалентная |
435 |
|
|
Н—Н |
|
|
|
=С=С= |
600-700 |
0.1 |
- 0.3 |
О =О |
|
|
|
—С≡ С— |
>1000 |
0.1 |
– 0.3 |
N≡ N |
|
|
|
Ионная |
10-500 |
0.3 |
|
Межмолекулярная |
0.1-10 |
0.3-0.5 |
|
При длине связи больше 0.5 |
нм связь между атомами не |
||
образуется |
|
|
|

3. Полярность связи – возникновение
эффективных электрических зарядов на химически |
|||||
связанных атомах в молекуле за счет смещения |
|||||
электронной плотности из-за разной |
|||||
электроотрицательности. |
|||||
|
|
|
|
– длина химической связи; |
|
|
|
= |q| · |
|||
|
|
|
q - эффективный заряд; |
||
|
|
|
|
- дипольный момент |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|

Чем больше разность электроотрицательностей, взаимодействующих атомов, тем более полярна связь.
Степень ионности Δǽ= |ЭО1-ЭО2|Δǽ = 0 – 0.4 – ковалентная неполярная
Δǽ =0.4-2.0 – ковалентная полярная связь;
Δǽ > 2.1 - ионная
Дипольный момент молекулы зависит:от полярности связей;от геометрии молекулы;
от наличия неподелённых пар электронов.

Смещение электронной |
H |
Cl |
плотности к более ЭО |
|
|
атому |
|
|
Возникновение |
17 17 |
эффективных зарядов ( ) |
H C |
Степень ионности
Cвязь в молекуле HCl полярная, имеет на 17 % ионный характер.

0,83 |
0,83 |
Na |
Cl |
т.е. степень ионности равна 83%.
Полного перетягивания связующих пар электронов от более электроположительного к более электроотрицательному атому и образования 100 % -ной ионной связи практически не наблюдается.
