
- •1. ПРЕДЫСТОРИЯ
- •2. НАЧАЛО ИСТОРИИ ЯДЕРНОЙ ФИЗИКИ
- •3. ЭПОХА ПРАКТИЧЕСКОГО ПРИМЕНЕНИЯ ИДЕЙ ЯДЕРНОЙ ФИЗИКИ
- •4. СОВРЕМЕННАЯ ЯДЕРНАЯ ФИЗИКА
- •5. РАЗВИТИЕ МЕТОДОВ РЕГИСТРАЦИИ ИЗЛУЧЕНИЙ
- •6. РАЗВИТИЕ УСКОРИТЕЛЬНОЙ ТЕХНИКИ
- •7. РАЗВИТИЕ РЕАКТОРОСТРОЕНИЯ
- •1. ОСНОВНОЙ ЗАКОН РАДИОАКТИВНОГО РАСПАДА
- •2. СТАТИСТИКА РАСПАДА
- •3. РАСПАД СМЕСИ РАДИОНУКЛИДОВ
- •4. ПРОЦЕССЫ НАКОПЛЕНИЯ И РАСПАДА ГЕНЕТИЧЕСКИ СВЯЗАННЫХ РАДИОНУКЛИДОВ
- •4.1 Цепочка из двух изотопов
- •4.2 Цепочки из трёх и более изотопов
- •4.3 Радиоактивные равновесия
- •4.3.1 Случай отсутствия равновесия
- •4.3.2 Подвижное равновесие
- •4.3.3 Вековое равновесие
- •4.4 Разветвленный распад
- •4.5 Степень равновесности
- •4.6 Примеры радиоактивных распадов
- •1. ПРИМЕРЫ РАДИОАКТИВНЫХ СЕМЕЙСТВ
- •1.1 Семейства урана, тория и актиния
- •1.2 Семейство нептуния
- •2. ПРИРОДНЫЕ РАДИАКТИВНЫЕ СЕМЕЙСТВА
- •3. ТЕХНОГЕННЫЕ РАДИОНУКЛИДЫ – РОДОНАЧАЛЬНИКИ ЕСТЕСТВЕННЫХ РЯДОВ
- •4. ОТКРЫТОСТЬ СИСТЕМЫ И СДВИГИ РАДИОАКТИВНЫХ РАВНОВЕСИЙ
- •5. КОНЦЕПЦИЯ ЭКВИВАЛЕНТНОСТИ РАДИОТОКСИЧНОСТИ ПРИРОДНЫХ И РЕАКТОРНЫХ РАДИОАКТИВНЫХ СЕМЕЙСТВ
- •6. РАДИОАКТИВНЫЕ ЦЕПОЧКИ ТЕХНОГЕННЫХ НУКЛИДОВ
- •1. ЯВЛЕНИЕ ИЗОТОПИИ
- •1.1 Историческая справка
- •1.2 Изотопы и изобары
- •1.3 Применение изотопов
- •2. ЯДЕРНО-ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ИЗОТОПОВ
- •3. КОММЕРЧЕСКИЕ РАДИОАКТИВНЫЕ ИЗОТОПЫ
- •4. ИЗОТОПНЫЕ ЭФФЕКТЫ
- •5. АНАЛИЗ ИЗОТОПНОГО СОСТАВА
- •6. РАЗДЕЛЕНИЕ ИЗОТОПОВ
- •6.1 Общие замечания
- •6.2 Газовая диффузия
- •6.3 Диффузия в потоке пара (противопоточная масс-диффузия)
- •6.4 Термодиффузия
- •6.5 Газовое центрифугирование
- •6.6 Электромагнитное разделение.
- •6.7 Химическое обогащение
- •6.8 Аэродинамическая сепарация
- •6.9 AVLIS (испарение с использованием лазера).
- •6.10 Дистилляция
- •6.11 Электролиз
- •6.12 Изотопный обмен
- •7. ПРОИЗВОДСТВО ИЗОТОПОВ
- •7.1 Производство стабильных изотопов
- •7.2 Получение изотопов в ядерных реакторах
- •7.3 Получение изотопов на ускорителях
- •1. ИОНИЗИРУЮЩЕЕ ИЗЛУЧЕНИЕ И ЕГО ПОЛЕ
- •2. ВИДЫ ИЗЛУЧЕНИЙ
- •2.1. Корпускулярное излучение
- •2.1.1 Альфа-излучение
- •2.1.2 Протонное излучение
- •2.1.3 Нейтронное излучение
- •2.1.4 Электронное излучение
- •2.1.5 Бета-излучение
- •2.2 Космическое излучение.
- •2.3 Электромагнитное излучение
- •2.3.1 Рентгеновское излучение
- •2.3.2 Гамма излучение
- •2.3.3 Тормозное излучение
- •2.3.4 Излучение Черенкова-Вавилова
- •2.3.5 Синхотронное излучение
- •2.3.6 Переходное излучение
- •3. СВОЙСТВА ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
- •4. ИСТОЧНИКИ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
- •4.1 Терминология: радиоактивные источники излучений и их характеристики
- •4.2 Классификация источников излучения.
- •4.2.1 Источники рентгеновского излучения.
- •4.2.2 Ускорители
- •4.2.3 Нейтронные источники
- •1. ПРОХОЖДЕНИЕ ИЗЛУЧЕНИЯ СКВОЗЬ ВЕЩЕСТВО
- •1.1 Терминология: взаимодействие ионизирующих излучений со средой
- •1.2 Типы взаимодействия излучения с веществом
- •1.3 Ионизация и возбуждение
- •2. ВЗАИМОДЕЙСТВИЕ ТЯЖЕЛЫХ ЧАСТИЦ С ВЕЩЕСТВОМ
- •2.1 Взаимодействие заряженной частицы с электроном
- •2.2 Ионизация и возбуждение атома
- •2.3 Тормозная способность
- •2.4 Пробег
- •3. ВЗАИМОДЕЙСТВИЕ ЭЛЕКТРОНОВ С ВЕЩЕСТВОМ
- •3.1 Потери энергии движущимися электронами
- •3.2 Эффективный пробег электронов
- •3.4 Каскадный ливень
- •4.1 Процессы поглощения гамма-излучения
- •4.2 Поглощение гамма-излучения.
- •5. ВЗАИМОДЕЙСТВИЕ НЕЙТРОНОВ С ВЕЩЕСТВОМ
- •1. ЯДЕРНЫЕ РЕАКЦИИ С УЧАСТИЕМ НЕЙТРОНОВ
- •1.1 Радиационный захват нейтрона
- •1.2 Реакции с образованием протонов
- •1.4 Реакции деления под действием нейтронов
- •1.6 Неупругое рассеяние нейтронов
- •1.7 Упругое рассеяние нейтронов
- •2. ЯДЕРНЫЕ РЕАКЦИИ С УЧАСТИЕМ ЗАРЯЖЕННЫХ ЧАСТИЦ
- •2.2 Реакции под действием протонов
- •2.3 Ядерные реакции под действием заряженных частиц, ускоренных при высоких энергиях
- •2.4 Ядерные реакции с тяжёлыми ионами
- •2.5 Ядерные реакции с участием электронов, мюонов, мезонов, гиперонов и античастиц
- •3. ФОТОЯДЕРНЫЕ РЕАКЦИИ
- •4. ТЕРМОЯДЕРНЫЕ РЕАКЦИИ
- •1. КЛАССИФИКАЦИЯ ЯДЕРНЫХ РЕАКЦИЙ
- •2. ЗАКОНЫ СОХРАНЕНИЯ В ЯДЕРНЫХ РЕАКЦИЯХ
- •2.1 Барионный заряд
- •2.2 Энергия и импульс
- •2.3 Закон сохранения импульса
- •2.4 Момент количества движения
- •2.5 Чётность
- •2.6 Изотопический спин
- •3. КИНЕТИКА И ВЫХОД ЯДЕРНОЙ РЕАКЦИИ
- •3.1 Сечение ядерной реакции
- •3.2 Скорость ядерной реакции
- •4. МЕХАНИЗМЫ ЯДЕРНЫХ РЕАКЦИЙ
- •4.1 Модель составного ядра
- •4.2 Оптическая модель
- •4.3 Модель прямых механизмов
- •1. ВЫНУЖДЕННОЕ ДЕЛЕНИЕ ЯДЕР
- •1.1 Особенности процесса деления
- •1.2 Жидкокапельная модель ядра в описании деления
- •1.3 Оболочечная модель ядра в интерпретации процесса деления
- •2. ПРОЦЕСС ВЫНУЖДЕННОГО ДЕЛЕНИЯ
- •2.1 Вероятность деления
- •2.2 Стадии процесса деления
- •2.3 Энергетика процесса деления
- •2.4 Продукты деления
- •1. ЦЕПНЫЕ ПРОЦЕССЫ
- •1.1 Цепные реакции в химии
- •1.2 Ядерные цепные реакции
- •1. 3 Цепная реакция деления
- •1.4 Ядерный взрыв
- •1.5 Ядерная безопасность
- •2 КРИТИЧЕСКАЯ МАССА
- •3. ЯДЕРНЫЕ РЕАКЦИИ В АТОМНОЙ БОМБЕ
- •3.1 Урановый заряд
- •3.1.1 Делящиеся изотопы урана
- •3.1.2 Устройство и принцип работы урановой атомной бомбы
- •3.2 Плутониевый заряд
- •4 НЕЙТРОННОЕ ОРУЖИЕ
- •1. ВЗАИМОДЕЙСТВИЯ НЕЙТРОНОВ С ВЕЩЕСТВОМ
- •1.1 Свойства нейтронов
- •1.2 Свойства нейтронов различных энергий
- •1.3 Замедление нейтронов
- •1.4 Замедлители нейтронов
- •1.5 Диффузия нейтронов
- •1.6 Альбедо нейтронов
- •2. НЕЙТРОНЫ В ЯДЕРНОМ РЕАКТОРЕ
- •2.1 Генерация нейтронов
- •2.2 Радиационный захват
- •2.3 Рассеяние нейтронов в реакторе
- •2.4 Основные характеристики нейтронных полей
- •2.5 Размножение нейтронов
- •2.6 Критичность реактора
- •2.7 Распространение нейтронов в среде
- •3. УПРАВЛЕНИЕ ЯДЕРНЫМ РЕАКТОРОМ
- •3.1 Реактивность реактора
- •3.2 Нейтронный цикл
- •3.3 Управление реактором на тепловых нейтронах
- •1. ИСТОРИЯ АТОМИЗМА
- •2. ОБЩАЯ ХАРАКТЕРИСТИКА
- •2.1 Размеры атома
- •2.2 Масса атома
- •2.3 Заряд ядра атома
- •2.4 Внутренняя энергия атома
- •3. ВНУТРЕННЕЕ СТРОЕНИЕ АТОМА
- •3.1 Атом Бора
- •3.2 Теория атома водорода
- •3.3 Квантовомеханическая теория сложных атомов
- •3.4 Электронные оболочки атома и периодическая система элементов
- •4. АТОМНЫЕ ПРОЦЕССЫ
- •4.1 Ионизация
- •4.2 Эмиссия рентгеновского излучения
- •1. РАСПРОСТРАНЕНИЕ ЭЛЕМЕНТОВ И ИЗОТОПОВ
- •2. НАЧАЛЬНЫЙ НУКЛЕОСИНТЕЗ
- •3. ЭВОЛЮЦИЯ ЗВЁЗД
- •4. СКОРОСТЬ ТЕРМОЯДЕРНЫХ РЕАКЦИЙ
- •5. ЗВЁЗДНЫЙ НУКЛЕОСИНТЕЗ
- •5.1 Ядерные реакции в звёздном нуклеосинтезе
- •5.3 Горение гелия
- •5.4 Синтез ядер с А<60
- •5.5 Синтез ядер с А>60
- •5.5.1 s-Процесс
- •5.5.3 р-Процесс
- •6. ПРОБЛЕМА СОЛНЕЧНОГО НЕЙТРИНО
- •6.1 Ожидаемые источники солнечного нейтрино, энергии и потоки
- •6.2 Детектирование нейтрино
- •6.3 Проблема солнечного нейтрино
- •7. СИНТЕЗ Li, Be и B
- •1. ФИЗИЧЕСКИЕ ОСНОВЫ ЯДЕРНОГО СИНТЕЗА
- •1.1 Термодинамика ядерного синтеза
- •1.2 Реакции ядерного синтеза
- •1.3 Термоядерные топлива
- •2. ТЕРМОЯДЕРНЫЙ СИНТЕЗ В ЗЕМНЫХ УСЛОВИЯХ
- •2.1 Водородная бомба
- •2.2 Термоядерный синтез в тепловом урановом реакторе
- •3. УПРАВЛЯЕМЫЙ ТЕРМОЯДЕРНЫЙ СИНТЕЗ
- •3.1 Временные и температурные условия
- •3.2 Магнитное удержание плазмы
- •3.2.1 Плазма
- •3.2.2 Плазма и УТС
- •3.2.3 Системы с замкнутой магнитной конфигурацией
- •3.2.4 Открытые магнитные конфигурации
- •4. УСТАНОВКИ С МАГНИТНЫМ УДЕРЖАНИЕМ
- •4.1 Токамак
- •4.2 Пинч с обращенным полем (ПОП)
- •4.3 Стелларатор
- •4.4 Открытая ловушка
- •4.5 Плазменный фокус
- •4.6 Галатея
- •5. УСТАНОВКИ ИНЕРЦИОННОГО СИНТЕЗА
- •6. ВОДОРОДНАЯ БОМБА
- •1. АКТИВАЦИОННЫЙ АНАЛИЗ
- •1.1 Основы метода
- •1.2 Практика нейтронно-активационного анализа
- •1.2.2 Анализ наведённой активности
- •1.3 Применения активационного анализа.
- •1.4 Преимущества и недостатки активационного анализа
- •2. РЕНТГЕНОВСКИЙ ЭМИССИОННЫЙ АНАЛИЗ
- •3. РЕЗЕРФОРДОВСКОЕ ОБРАТНОЕ РАССЕЯНИЕ
- •1. ОСОБЕННОСТИ КВАНТОВОЙ МЕХАНИКИ
- •2. КОРПУСКУЛЯРНО-ВОЛНОВОЙ ДУАЛИЗМ
- •3. ПРИНЦИП НЕОПРЕДЕЛЁННОСТИ ГЕЙЗЕНБЕРГА
- •4. МАТЕМАТИЧЕСКИЙ АППАРАТ КВАНТОВОЙ МЕХАНИКИ
- •4.1 Уравнение Шрёдингера
- •4.2 Волновая функция
- •4.3 Потенциальная яма
- •5. ПРИНЦИП ПАУЛИ
- •6. РАСПРЕДЕЛЕНИЯ
- •6.1 Распределение Максвелла-Больцмана
- •6.2 Распределение Бозе-Эйнштейна
- •6.3 Распределение Ферми-Дирака
- •1. АТОМНОЕ ЯДРО – общие сведения
- •2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЯДРА
- •2.1 Открытие ядра
- •2.2 Заряд атомного ядра
- •2.3 Масса атомного ядра
- •2.4 Размеры ядра и распределение плотности ядерной материи
- •2.5 Спин и магнитный момент ядра
- •Как и составляющие его нуклоны, ядро имеет собственные моменты: спин, магнитный момент и электрический квадрупольный момент.
- •2.6 Энергия связи и устойчивость ядер
- •2.7 Электрический момент ядра
- •2.8 Чётность
- •2.9 Изоспин нуклонов и ядер
- •3. ЯДЕРНЫЕ СИЛЫ
- •1. МОДЕЛИ СТРОЕНИЯ АТОМНОГО ЯДРА
- •1.1 Классификация моделей
- •1.2 История развития моделей ядра
- •2. КАПЕЛЬНАЯ МОДЕЛЬ СТРОЕНИЯ ЯДРА
- •3. ОБОЛОЧЕЧНАЯ МОДЕЛЬ ЯДРА
- •3.1 Экспериментальное обоснование оболочечной модели
- •3.2 Построение оболочечной модели
- •3.3 Ядерные потенциалы и энергетические уровни ядра
- •3.4 Систематика энергетических уровней
- •3.5 Следствия оболочечной модели
- •1. ЧАСТИЦЫ
- •2. КЛАССИФИКАЦИЯ ЭЛЕМЕНТАРНЫХ ЧАСТИЦ
- •3. СВОЙСТВА НЕКОТОРЫХ ФУНДАМЕНТАЛЬНЫХ ЧАСТИЦ
- •3.1 Фотон
- •3.2 Протон
- •3.3 Нейтрон
- •3.4 Нейтрино
- •4. КВАРКИ
- •5. ЯДЕРНЫЕ ВЗАИМОДЕЙСТИЯ
- •5.1 Виды взаимодействий
- •5.2 Сильные взаимодействия
- •5.3 Квантовая хромодинамика
- •6. АНТИМАТЕРИЯ
- •1. РАДИОАКТИВНОСТЬ
- •2. ИСТОРИЧЕСКАЯ СПРАВКА
- •3. СТАТИСТИКА РАСПАДА
- •4. ЗАКОНЫ СОХРАНЕНИЯ В РАСПАДАХ
- •5.1 Долина ядерной стабильности
- •5.2 Новые тяжёлые элементы
- •5.3 «Доводородные» элементы
- •5.4 «Экзотические» ядра
- •5.5 На пути к нейтронной материи
- •1. РАДИОАКТИВНЫЙ РАСПАД И ИОНИЗИРУЮЩИЕ ИЗЛУЧЕНИЯ
- •2. ОСНОВНЫЕ ТИПЫ ЯДЕРНЫХ ПРЕВРАЩЕНИЙ
- •2.1 Альфа-распад
- •2.1.1 Основные особенности
- •2.2 Бета - распад
- •2.2.3 Электронный захват
- •2.3.1 Внутренняя конверсия электронов
- •2.3.2 Ядерная изомерия
- •1. КЛАССИФИКАЦИЯ ПРОЦЕССОВ РАСПАДА
- •2. СПОНТАННОЕ ДЕЛЕНИЕ
- •2.1 Самопроизвольное деление тяжёлых ядер
- •2.2 Механизм деления
- •2.3 Энергетика спонтанного деления
- •2.4 Продукты деления
- •2.5 Спонтанное деление из изомерного состояния
- •3. ПРОТОННАЯ РАДИОАКТИВНОСТЬ
- •4. НЕЙТРОННАЯ РАДИОАКТИВНОСТЬ
- •7. ЗАПАЗДЫВАЮЩЕЕ ДЕЛЕНИЕ
- •8. КЛАСТЕРНАЯ РАДИОАКТИВНОСТЬ
- •9. БЕТА-РАСПАД ПОЛНОСТЬЮ ИОНИЗИРОВАННОГО АТОМА
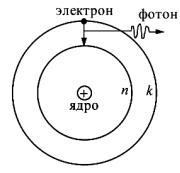
Значения дозволенных энергий атома можно определить, либо изучая возбуждение его электронным ударом – по значениям энергии возбуждающих электронов (потенциалов возбуждения), либо путём расшифровки атомных спектров; последний метод является основным для определения уровней энергии атома, поскольку частоты ν испускаемых и поглощаемых фотонов определяются с гораздо большей точностью, чем потенциалы возбуждения.
Замечание. Не следует полагать, что атомы испускают исключительно оптические спектры. При переходах электронов с внешних электронных оболочек атома на внутренние возникает рентгеновское излучение (линейчатый спектр, диапазон длин волн 10-3 – 102 нм). Линейчатый характер подобных спектров отличает их от рентгеновских лучей, возникающих при торможении быстрых электронов в веществе (непрерывный спектр).
Квантование энергии атома является следствием волновых свойств электрона, которыми он (как и другие микрочастицы) обладает наряду с корпускулярными свойствами. Движению электрона в атоме соответствует стоячая волна с длиной ν 10-8 см, т.е. порядка линейных размеров атома. Поскольку для стоячей волны в ограниченном объёме возможны лишь определённые значения λ, то и энергия атома также может принимать лишь дискретный ряд значений. Свободный электрон, оторванный от атома, имеет непрерывный энергетический спектр.
3. ВНУТРЕННЕЕ СТРОЕНИЕ АТОМА
3.1 Атом Бора
Отличительная черта квантовой теории – дискретность возможных значений для ряда физических величин: энергии электронов в атомах, момента количества движения и его проекции на произвольное направление и т.д.; в классической теории все эти величины могут изменяться лишь непрерывно.
При движении электронов по этим орбитам атом находится в устойчивом состоянии. Испускание или поглощение атомом излучения происходит только при
Рис. 5. Схема атома Бора (Линейная скорость электрона на n-ой боровской орбите и радиус n-ой боровской орбиты квантуются. Излучение или поглощение кванта излучения происходит при переходе атома из одного стационарного состояния в другое).
переходе электрона с одной орбиты на другую, причем излучаемая частота ν однозначно связана с разностью энергий, участвующих в переходе состояний,
Е=hν, где h=2π ћ.
Бора постулаты – основные допущения в квантовой теории атома Н.Бора: 1) существование ряда стационарных состояний атома, соответствующих определённым значениям его внутренней энергии Е; 2) условие частот ν излучения при переходе атома из одного стационарного состояния (Е1) в другое (Е2): ν=(Е1-Е2)/h, h – постоянная Планка. Позднее установлено, что постулаты Бора – следствия квантовой механики.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию: электрон может вращаться вокруг ядра неопределенно долго, не излучая энергию, если на его орбите укладывается целое число длин волн де Бройля.
Таким образом, устойчивые орбиты в атоме это орбиты, радиусы которых rn определяются
соотношением |
|
mevrn = n ћ |
(1) |
где me –масса электрона, v- скорость электрона, r – радиус орбиты, n – целое число. Каждая орбита расположена на вполне определенном расстоянии
|
r =n2 |
h2 |
|
|
|
|
(2) |
|
|
|
|
|
|
|
|||
|
n |
|
Zmee2 |
|
||||
от ядра (Z – заряд ядра, е – заряд электрона) и характеризует энергетическое состояние |
||||||||
E |
= −Z2e4me |
* |
1 |
. |
(3) |
|||
|
||||||||
n |
|
2h2 |
|
n2 |
|
|||
|
|
|
|
|||||
Орбита с самым малым радиусом соответствует наименьшему значению энергии и называется К - орбитой, за ней следует L- орбита, М – орбита и т.д. При движении электронов по этим орбитам атом находится в устойчивом состоянии.
С учётом некоторых положений квантовой механики (корпрускулярно-волнового дуализма и волн деБройля) оценим величину радиуса боровского атома.
Начнем с того, что, воспользовавшись положениями классической механики, рассмотрим, как движется притягивающийся к ядру электрон. Сила притяжения компенсируется центробежной силой, то есть
е2 |
= |
mv2 |
. |
(4) |
||
r2 |
|
r |
||||
|
|
|
|
|
||
Отсюда радиус орбиты электрона |
|
|
|
|
|
|
r = |
|
e2 |
|
. |
(5) |
|
|
mv2 |
|
||||
|
|
|
|
|
|
|
Каков он, сказать невозможно. Фактически он может быть каким угодно: чем меньше скорость, тем расстояние от ядра больше, поскольку полная энергия движущегося электрона Е тем больше, чем электрон дальше от ядра. Сумма потенциальной и кинетической энергий
|
|
|
|
E = − |
e2 |
+ |
mv2 |
. |
(6) |
|
|
|
|
r |
2 |
||||
|
|
|
|
|
|
|
|
||
Но mv2 = − |
e2 |
, т.е. E = − |
e2 |
. |
|
|
|
|
|
2r |
|
|
|
|
|
|
|||
|
|
2r |
|
|
|
|
|
||
Получается, что в одном атоме водорода электрон может быть ближе к ядру, в другом - дальше. Потенциальная энергия электрона U(r), соответствующая силе электростатического притяжения
F = − |
e2 |
, |
(7) |
|
r2 |
||||
c |
|
|
есть U (r) = − e2 r
плюс постоянная, которую удобно принять равной нулю. Тогда при бесконечном расстоянии электрона от ядра энергия обращается в нуль. При отрицательной энергии электрон вращается вокруг ядра, а при положительной не связан с ядром и может удалиться на бесконечность. Считая траекторию электрона окружностью, мы заметно упростили картину. Движение по окружности под действием электростатической кулоновской силы - частный случай. В общем случае частица с отрицательной энергией движется по эллипсу, в одном из фокусов которого находится притягивающий центр. Формула, связывающая радиус орбиты частицы с энергией, остается справедливой, если под 2r понимать большую ось эллипса. Классический подход не объясняет, почему все атомы водорода имеют одинаковые размеры. Движение микроскопических частиц описывается не классической механикой Ньютона, а квантовой механикой, математический аппарат которой весьма непрост. Не претендуя на строгость, можно поступить так: к классическим формулам добавить условие, вытекающее из того, что движение электрона сопровождает волна де-Бройля.
Условие, вытекающее из существования волны де-Бройля, выглядит так: на траектории электрона
обязано поместиться целое число волн де-Бройля, т. е. |
|
2pr = nl, |
(8) |
где n = 1, 2, 3 … - целые числа. Но l = 2pћ/mv (где ћ = h/2p). Значит,
|
h |
|
|
r = |
|
n , |
(9) |
|
|||
mv |
|
||
где n = 1,2,3… Сравнив последнее выражение с формулой, связывающей радиус орбиты со скоростью, получим:
r = a |
|
= a |
|
n2 |
; |
a |
|
= |
h2 |
, |
(10) |
|
n |
B |
B |
me2 |
|||||||||
|
|
|
|
|
|
|
|
где n = 1, 2, 3 …, индекс «В» - в честь Бора. Величину аВ так и называют - радиус Бора. Радиус Бора равен 0,053 нанометра (1 нм = = 10-9 м). Подставив это значение в выражение для энергии, имеем:
|
e |
2 |
|
me |
4 |
|
|
|
|
||
|
|
|
|
1 |
|
||||||
E = En = − |
|
|
|
|
|
|
|
|
|
, |
(11) |
|
|
|
2 |
|
2 |
||||||
2an |
= − |
2h |
|
||||||||
|
|
|
|
n |
|
|
|
||||
где n = 1,2,3 …
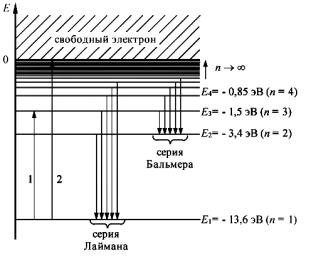
Величину (me4/2ћ2) называют ридбергом в честь шведского оптика И.Р.Ридберга (1854-1919) и обозначают Ry, 1 Ry = = 13,6058 эВ. Энергию, равную 1 ридбергу, нужно придать электрону, чтобы он оторвался от ядра, то есть это энергия ионизации атома водорода.
Итак, электрон в атоме может иметь только дискретные значения энергии, причём существует состояние электрона с энергией, меньше которой электрон иметь не может. Это состояние называется основным. Все остальные состояния называют возбужденными. Основное состояние электрона в атоме устойчиво.
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
hνnm=En–Em,= Е |
(12) |
Здесь h=2π ћ.
Отсюда можно выразить частоту излучения.
Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона.
Вычисления на основе этой модели позволили рассчитать спектральные закономерности и постоянную Ридберга. Модель Бора объясняет спектры водорода и водородоподобных атомов, но не годится для атомов с числом электронов больших 2. В более продвинутом варианте рассматриваемой здесь модели учтено движение ядра вокруг общего центра тяжести; круговые орбиты заменены эллиптическими с определенными положениями их плоскости. Все это привело к лучшему пониманию оптических спектров, и, в частности, позволило объяснить простой эффект Зеемана.
Зеемана эффект – расщепление уровней энергии, а, следовательно, спектральных линий атома и других атомных систем в магнитном поле. Во внешнем магнитном поле атомная система, обладающая магнитным моментом μ, приобретает дополнительную энергию, зависящую от проекции μ на направление магнитного поля. Это приводит к расщеплению уровней энергии системы. Открыт в 1896 П.Зееманом.
Модель Бора не позволяет дать физическую интерпретацию правилу квантования. Это было сделано десятилетием позже де Бройлем на основе представлений о волновых свойствах частиц. Де Бройль предложил, что каждая орбита в атоме водорода соответствует волне, распространяющейся по окружности около ядра атома. Стационарная орбита возникает в том случае, когда волна непрерывно повторяет себя после каждого оборота вокруг ядра. Другими словами, стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты. Это явление очень похоже на стационарную картину стоячих волн в струне с закрепленными концами. В стационарном квантовом состоянии атома водорода на длине орбиты должно укладываться по идее де Бройля целое число длин волн λ, т.е.
Рис.6. Энергетический спектр электрона в атоме водорода.
nλn=2πrn. (13)
В результате, боровское правило квантования оказалось связанным с волновыми свойствами электронов.
Дискретность энергетических состояний атома была продемонстрирована в опыте Д.Франка и Г.Герца (1913), в котором исследовалось столкновение электронов с атомами ртути.
Франка-Герца опыт – эксперимент, доказывающий, что внутренняя энергия атома может принимать лишь дискретные значения.
3.2 Теория атома водорода
Теорию одноэлектронного атома – атома, состоящего из ядра с зарядом – Ze и одного электрона с зарядом е, обычно называют теорией атома водорода. Прежде, чем её рассматривать, коротко остановимся на свойства электрона, как элементарной частицы.
Элементарные частицы характеризуются массой, зарядом, величиной собственного момента количества движения (спина) и величиной магнитного момента. Существование собственного механического и магнитного моментов у электрона позволяет представить его условно в виде заряженного волчка, вращающегося вокруг собственной оси. При этом в отличие от классического волчка, который может иметь любое значение механического момента, спин электрона имеет только одно вполне определенное значение,
равное ћ/2. Соответственно магнитный момент электрона также имеет только одно вполне определенное
значение M В = е * h = 9,27*10-21 эрг/г.с, которое получило название mес 2
магнетона Бора. Знак магнитного момента электрона отрицателен, т.е. его направление противоположно направлению спина. Понятие спина электрона позволило объяснить тонкую структуру атомного излучения.
Рис. 7. Тонкая структура спектра атома водорода
Движение электрона относительно ядра представляет собой движение частицы с тремя степенями свободы в кулоновском поле ядра (центральное поле). Потенциальная энергия электрона в таком поле зависит только от расстояния электрона от ядра и не зависит от направления радиуса-вектора. Таким образом, имеет место сферическая симметрия. Возможные значения энергии одноэлектронного атома (и соответствующие волновые функции, характеризующие состояние электрона в нём) получаются при решении уравнения Шредингера, в гамильтониан которого
подставляется выражение для потенциальной энергии электрона. Когда энергия электрона отрицательна (для связанного электрона), возможные её значения задаются формулой:
E |
n |
= − |
hcRZ 2 |
= − |
13,6Z 2 |
, |
(14) |
|
n2 |
n2 |
|||||||
|
|
|
|
|
где n=1, 2, 3… - главное квантовое число, определяющее энергию различных состояний атома, а постоянная hcR (R – постоянная Ридберга) представляет собой энергию ионизации атома водорода, равную энергии его основного состояния (Z=1, n=1), взятой с обратным знаком.
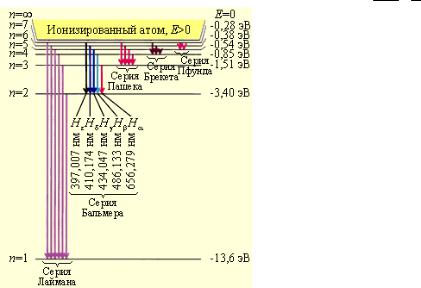
В простейшем случае атома водорода расстояния между уровнями энергии (Рис. 5) закономерно уменьшаются и, бесконечно сгущаясь, уровни сходятся к границе ионизации и Е , соответствующей отрыву электрона. Выше границы ионизации лежит непрерывный энергетический спектр. Разность энергий E -Ei есть энергия ионизации атома. Схема уровней энергии водородоподобных ионов Не+, Li2+, … отличается от приведённой на Рис.5 только увеличением масштаба в Z2 раз. Для атомов, содержащих два электрона и более, схему уровней энергии усложняются.
Каждый электрон в атоме характеризуется четырьмя квантовыми числами: главным квантовым числом n, принимающим значения n=1, 2, 3, 4 …., азимутальным (орбитальным) l =0, 1, 2,…n-1, магнитным ml, принимающим значения (2l+1) значений, и спиновым ms, принимающим значения +1/2 и -1/2. Состояния с l=0, 1, 2, 3, 4… принято обозначать буквами s, p, d, f, g… и соответственно называть s-, p-, d-, f-, g-… состояниями. Электроны с данным n образуют электронный слой, который состоит из n оболочек с l=0, 1, 2…(n-1) и в соответствии с принципом Паули содержит 2n2 электронов. Таким образом, общее число различных состояний с заданными n и l при учёте, что l может принимать значения от 0 до n—1, равно:
l −n−1 |
|
∑2(2l +1)= 2n2. |
(15) |
l =0
Каждому уровню энергии атома водорода соответствует 2, 8, 18, ..., 2n2 (при n = 1, 2, 3, ...) различных стационарных квантовых состояний (Рис.7). Если уровню энергии соответствует лишь одно квантовое состояние, то его называют невырожденным, если два или более — вырожденным, а число таких состояний g называется степенью или кратностью вырождения (для невырожденных уровней энергии g = 1). Уровни энергии атома водорода являются вырожденными, а их степень вырождения gn = 2n2.

Рис. 8. Возможные состояния атома водорода при значениях n = 1, 2, 3. Графически показаны ориентации орбитального и спинового моментов.
Квантовое число l = 0, 1, 2, …, n-1 определяет величину орбитального момента атома, т.е. момента импульса электрона Ml относительно ядра:
|
|
h |
2 |
|
|
|
2 |
|
|
|
|
|
|
Ml |
|
|
|
(16) |
||
= |
4π |
2 l(l +1). |
||||
|
|
|
|
|
||
При заданном n, число l принимает n различных значений. Квантовое число ml определяет величину проекции орбитального момента Mlz на произвольно выбранное направление z; при заданном l число ml принимает 2l+1 значений: ml=-l, l-1,…,-l. Квантовые числа n, l и ml полностью характеризуют состояние электрона в атоме. Состояния с l=0, 1, 2, 3, 4, 5, 6, принято обозначать буквами s, p, d, f, g, h, l,….соответственно.
Точное положение электрона в атоме в определённый момент времени установить нельзя вследствие соотношений неопределённостей. Состояние электрона в атоме определяется волновой функцией Ψ, которая при заданных значениях n, l и ml определённым образом зависит от координат; |Ψ|2 даёт плотность вероятности нахождения электрона в данной точке пространства. Таким образом, состояние электрона в атоме можно охарактеризовать распределением в пространстве его электрического заряда с некоторой плотностью – распределение электронной плотности е|Ψ|2.
При этом электроны как бы размазаны в пространстве и образуют электронное облако, размеры которого растут пропорционально n2. Для s-состояний (l=0) волновая функция и распределение электронной плотности обладают сферической симметрией и обращаются в нуль на (n-1)-й сфере, т.е. имеют n-1 узловую сферическую поверхность; при этом в центре (начале координат) Ψ и |Ψ|2 отличны от нуля, что является характерной особенностью s-состояний; в точке, где находится ядро, вероятность нахождения электрона не равна нулю. Для р-состояний (l=1) и d-состояний (l=1) значение волновой функции и распределение электронной плотности в разных направлениях различны и зависят от абсолютного значения ml; при этом Ψ и |Ψ|2 обращаются в нуль на некоторых узловых поверхностях и всегда равны нулю в начале координат.
В явном виде волновые функции получаются при решении уравнения Шредингера. Важным свойством состояний водородоподобного атома является независимость его энергии от l и ml. Атом с определённым значением энергии может находиться в нескольких состояниях с различными значениями l и ml, т.е. имеет место вырождение состояний (вырождение уровней энергии) атома, причём число состояний с одинаковой энергией называются степенью или кратностью вырождения.
