
- •Лекция 5
- •Классификация расплавов
- •Классификация расплавов
- •Вторая группа расплавов типа А–В
- •Вторая группа расплавов типа А–В
- •Оценка устойчивости соединений
- •Третья группа расплавов типа
- •Ассоциированные растворы
- •Ассоциированные растворы
- •Заключение по расплавам:
- •Модуль 2. Жидкое состояние, затвердевание и кристаллизация
- •Формирование структуры при
- •Контролируемое затвердевание расплава
- •Контролируемое затвердевание
- •Контролируемое затвердевание расплава
- •Контролируемое затвердевание расплава
- •Закономерности затвердевания
- •Закономерности затвердевания
- •Рост твердой фазы
- •Рост твердой фазы (продолжение)
- •Распределение легирующих элементов и примесей в разбавленных сплавах при
- •Распределение легирующих элементов и примесей в разбавленных сплавах при
- •Нормальное затвердевание
- •Нормальное затвердевание (продолжение)
- •Зонная плавка
- •Затвердевание с искривленной поверхностью раздела
- •Особенности роста кристаллов
- •Неустойчивость сферических центров кристаллизации
- •Условия роста центрального ствола дендрита
- •Неравновесный рост дендритов
- •Неравновесный рост дендритов (продолжение)
- •Образование ячеистой структуры
- •Образование ячеистой структуры (продолжение)
- •Образование ячеистой структуры (продолжение)
- •Ячеистые дендриты
Лекция 5
Модуль 2. Жидкое состояние, затвердевание и кристаллизация.
Тема 2.1. Расплавы металлов и сплавов, жидкое состояние
(продолжение)
Классификация расплавов
Напоминание пройденного материала:
1.Структура расплавов определяется энергией межатомного
взаимодействия атомов - ij , а точнее энергией взаимообмена |
||||
= z·NA·[ AB – 1/2( AA + BB)], энергией смешения |
AA BB |
|||
или энергией упорядочения |
AA BB |
ñì AB |
2 |
|
AB |
||||
|
|
|
||
2.Описание структуры (строения)2расплава проводят на основе |
||||
анализа парциальных структурных факторов : |
a11(K), |
|||
a12(K), a22(K); |
|
|
|
|
3.В расплавах существуют флуктуации плотности и концентрации атомов, которые описывают флуктуационными
структурными факторами: SNN , SNC , SCC .
4.Все структурные факторы зависят от энергии взаимодействия атомов.
5.Классификацию расплавов по структуре можно рассматривать с позиций анализа структурных факторов и энергии
взаимообмена, а точнее сравнения энергий взаимодействия
ABразличныхAA атомов:BB AB AA 2 BB AB AA 2 BB
2
Классификация расплавов
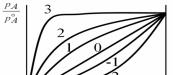
Первая группа расплавов типа А–В: AA BB AB.
При кристаллизации этих расплавов формируются широкие области растворов (Al–Ag, Cd–Hg, Bi–Sn, In–Sn и др.), и некоторые эвтектики с определенной растворимостью, образованные атомами с примерно равными размерами и строением электронных оболочек (Na–K, Pb–Bi, K– Cs и др.). Для этих расплавов характерны минимальные значения избыточных значений термодинамических потенциалов Hизб, Gизб (т.е.Физб min), минимальное изменение объема ( V min) и a 0, т.е. эти расплавы близки к идеальным.
Структурные факторы аij(K) имеют симметричные первые максимумы (металлическая связь), причем первый максимум а12(0) лежит между а11(0) и а22(0) . С ростом температуры пики аij(0) уменьшаются. Флуктуационный структурный фактор SCC(0) x1x2.
Характерен плавный ход изотермических свойств (вязкость, поверхностное
натяжение, электросопротивление) от состава. При Тликв в расплаве образуются группировки одноименных атомов (кластеры) типа Аm и Вn.
Например, в расплаве Bi–Sb предполагают существование кластеров типа Bi4 и Sb4. Сюда примыкают расплавы: AA BB AB
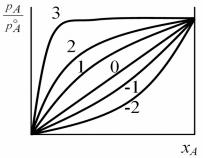
Вторая группа расплавов типа А–В
AB > AA и BB
Энергия взаимодействия разнородных атомов больше энергии взаимодействия одноименных атомов.
Для этой группы расплавов характерно отрицательное отклонение от закона Рауля (кривые, соответствующие = –1 и –2). Расплавы кристаллизуются с образованием твердых растворов или конгруэнтных соединений. Характерно отрицательные изменения термодинамических функций ( Физб 0), причем, чем больше разница в энергиях ij, тем больше эффект, т.е. экзотермическое смешение
атомов, уменьшение объема – V 0, особенно, если ионы компонентов А и В значительно отличаются по размеру, заряду и электроотрицательности.
Парциальные структурные факторы аij(K) имеют субпик (слева),
образование которого – признак химического упорядочения в виде соединения. Сдвиг пика а12 к а22 или к а11 признак твердого раствора
замещения. Как для твердого раствора, так и для соединения наблюдаются отрицательные отклонения активности от идеальности. Однако для соединения это отклонение более сильное. К тому же при образовании соединения сильно уменьшается объем и SCC(0) 0.
Вторая группа расплавов типа А–В
(продолжение)
В случае непрерывных рядов (твердых) растворов
изотермы вязкости – монотонные линии, изогнутые в ту или иную сторону: Ag–Au, Cu–Ag, Cu–Au или линейная зависимость: Pb–Sn, Sb–Bi, Sn (компоненты имеют близкие атомные объемы, сходное строение электронных оболочек).
Для систем с соединением изотермы вязкости имеют максимум при концентрациях, соответствующих составу соединения (AmBn.).
При повышении температуры максимумы на изотермах вязкости уменьшаются по высоте и сглаживаются. Максимумы свидетельствуют о том, что в жидких сплавах действуют те же силы, которыми обусловлено существование соединений в твердом теле. Эти силы
приводят к определенной координации атомов или даже к возникновению преимущественных группировок атомов внутри жидкого расплава, что соответствует данным структурных исследований жидких сплавов. С ростом
температуры группировки атомов разрушаются.
К группе расплавов относятся сплавы щелочных,
Оценка устойчивости соединений
Устойчивость соединения определяется (в первом приближении) формой конгруэнтного максимума на диаграмме и температурой плавления. Чем «острее» максимум на кривой ликвидуса, тем больше оснований ожидать наличия структурных группировок соединения в расплаве. Мерой устойчивости соединений является величина изменения энергии Гиббса или энтальпии при образовании соединения, отнесенная к одному грамм-атому или молю сплава. Для соединения AmBn:
1ат = /(m+n)
Чем больше изменение H1ат при образовании соединения, тем
прочнее соединение.
Устойчивость соединения зависит от типа межатомной связи. В соединениях чаще всего комбинация ионной и ковалентной связей.
Если величина Н1ат = (–40)÷(–180) кДж/моль·сплава, то связь – ионная, если H1ат = (–12)÷(–35) кДж/моль·сплава, то ковалентная.
Кроме того, для оценки устойчивости соединений можно использовать разницу электроотрицательностей компонентов расплава путем
использования следующей зависимости:
H = –аZ( A – B)2
Чем больше разница электроотрицательностей компонентов, тем больше изменение энтальпии на один атом соединения ( H1ат) и тем прочнее
соединение (Z – число валентных связей; а – константа).

Третья группа расплавов типа
AA > BB > AB
Такие расплавы характеризуются расслоением в жидком состоянии (Li–Na, Na–Cs, Zn–Pb, Zn–Bi и др.). Это – эвтектические сплавы со склонностью к расслоению, с перегибом на кривой ликвидуса. Для расплавов этой группы наблюдается положительное отклонение от
идеальности ( |
0 |
), |
положительное |
отклонения |
||||||
избыточных Sизб > 0 и Gизб 0, энтальпии H > 0, V > 0. |
||||||||||
|
На зависимостях структурного фактора от состава |
|||||||||
при |
определенных |
|
(критических)1 |
значениях |
||||||
|
|
|
|
|
|
2 |
|
2 |
|
|
концентрации (x ) и температуры (T ) наблюдается пик: |
||||||||||
|
c |
|
b1 |
(T |
Tc ) b2 (x xcc ) |
|
b3K |
|
|
|
|
|
|
|
а (К)= |
|
|
|
|
|
|
При соответствующих значениях волнового вектора K |
||||||||||
флуктуационный структурный фактор SCC(K) имеет максимум (рис |
||||||||||
справа). |
На концентрационной зависимости |
|
изотерм свойств |
|||||||
|
|
|||||||||
(например, вязкости) расплавов этого типа, как правило, наблюдаются линейные зависимости или небольшие (отрицательные) отклонения от линейной зависимости.
Расплавы склонны к образованию кластеров (размером 0,55–1,04
Ассоциированные растворы
Существует определенная связь между диаграммами состояния систем элементов, структурой расплава и термодинамическими функциями.
В расплавах возможны образования кластеров различного типа одноименных (Ai, Bj) или разноименных (AiBj) атомов.
Кластеры атомов называют ассоциациями, комплексами, группировками, областями локального порядка и т.п.
Время жизни кластера составляет ~10–7–10–8 с. Например, в расплаве In2Bi
при температуре 853 К время «жизни» кластеров составляет ~ 4·10–7 с.
Это намного больше, чем время существования флуктуаций концентрации, которое определяется периодом тепловых колебаний атомов (~ 10–14 с), или диффузионного перескока атомов (~ 10–10 с). Напомним, что флуктуация – это случайное отклонение статистических величин (концентрации) от средних. Комплексы находятся в равновесии друг с другом и с атомами (мономерами) расплава А и В, т.е. идет постоянное образование
(возникновение) и разрушение комплексов. При равновесии выполняются |
||
равенства химических потенциалов комплексов и отдельных атомов: |
||
Ai i A1 |
Bi i B1 |
μAi B j i μA1B j |
- химические потенциалы комплексов.
Раствор, в котором есть комплексы, называют ассоциированным.
Ассоциированные растворы
(продолжение)
Образование комплексов чистых компонентов дает положительное отклонение активности от идеальности, а комплексов АiBj отрицательное отклонение.
Состав разноименных комплексов в расплаве А–В обычно близок составу соединений в твердой фазе, особенно, если соединение плавится конгруэнтно.
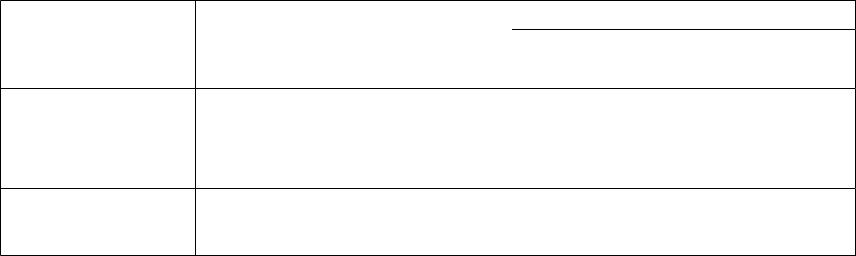
Примеры приведены в табл. |
|
Комплексы |
|
||
Система А–В |
Интерметаллиды |
T, К |
|||
|
|
в сплаве |
|
Состав |
|
Ag–Al |
A3B, A2B |
|
A3B, A2B, AB |
1273 |
|
Au–Zn |
A3B, A5B3, AB, AB2, AB3, |
A3B, AB, AB2, |
1080 |
||
|
AB8 |
|
|
AB3 |
|
Na–Sn |
A15B4, A3B, A2B, A3B2, |
|
A2B, AB |
1273 |
|
Для исследования |
строения |
кластеров перспективным |
|||
|
AB, AB2, |
AB3, AB4, AB6 |
|
|
|
является EXAFS (Extended X-ray Absorption Fine Structure) –
метод, в основе которого лежит изучение тонкой структуры поглощения рентгеновского излучения в области энергий выше края поглощения (порядка 1 кэВ). Метод позволяет
определить расположение (расстояние) соседних атомов.
Заключение по расплавам:
В расплавах существует ближний порядок в расположении атомов; во всех видах сплавов выше температуры ликвидуса существуют комплексы или одноименных, или разноименных атомов; степень ближнего порядка и концентрация комплексов снижаются по мере нагревания расплава и приближения температуры к температуре испарения (кипения); комплексы представляют собой подвижные ассоциации атомов, время жизни которых составляет ~10–7–10–8 с.
В расплавах металлов межатомная связь всегда металлическая, при которой электроны делокализованы. Если металлы и металлоиды образуют устойчивые химические молекулы (соединения), то усиливается локализация электронов, что отражается в увеличении электросопротивления расплава. Удельное электросопротивление бинарного расплава может измениться при относительно небольшом изменении состава в несколько раз.
Различие между жидким и твердым состояниями наиболее сильно проявляется при приложении напряжений: жидкость под действием сколь угодно малых напряжений изменяет форму за счет вязкого течения, а твердое тело сначала деформируется упруго.
