
- •Лекция 12
- •СТАБИЛИЗАЦИЯ СТРУКТУРНО-ФАЗОВОГО СОСТОЯНИЯ МАТЕРИАЛОВ
- •СТАБИЛИЗАЦИЯ СТРУКТУРНО-ФАЗОВОГО СОСТОЯНИЯ МАТЕРИАЛОВ
- •1. Проблемы стабильности структурно-фазового состояния материалов
- •1.Проблемы стабильности структурно-фазового состояния материалов
- •1.Проблемы стабильности структурно-фазового состояния материалов
- •1.Проблемы стабильности структурно-фазового состояния материалов
- •2. Движущие силы изменения структурно-фазового состояния
- •2. Движущие силы изменения структурно- фазового состояния
- •2. Движущие силы изменения структурно-фазового состояния
- •3. Основные механизмы изменения структурно-фазового состояния
- •3. Основные механизмы изменения структурно-фазового состояния
- •4. Нестабильность СФС, вызванная изменением химической составляющей
- •4.1. Нестабильность, вызванная неравномерным распределением растворенных компонентов
- •4.2.Внутрикристаллитная ликвация и междендритная сегрегация атомов
- •4.2.Внутрикристаллитная ликвация и междендритная сегрегация атомов
- •4.2.Внутрикристаллитная ликвация и междендритная сегрегация
- •4.2.Пути устранения ликвации и сегрегации атомов
- •Проблемы гомогенизации (продолжение):
- •4.3. Распад пересыщенного твердого раствора
- •Особенности спинодального распада
- •4.3. Распад пересыщенного твердого раствора
- •Зарождение частиц второй фазы
- •Гетерогенное зарождение второй фазы
- •Образование переходных фаз
- •Влияние примесей на зарождение выделений второй фазы
- •Рост выделений из пересыщенного твердого раствора
- •Рост выделений, контролируемый диффузией
- •Рост выделений, контролируемый диффузией
- •концентрации компонента В при росте выделения во времени t в направлении Х (Ri
- •Растворение, контролируемое диффузией
- •Роль кинетики реакций на поверхности раздела
- •Управление распадом твердых растворов
- •Управление распадом твердых растворов
- •Управление распадом с целью упрочнения сплава
- •5. Нестабильность структуры, обусловленная влиянием энергии деформации
- •5.1. Запасенная энергия холодной деформации
- •5.2. Механизмы накопления энергии деформации
- •5.2. Механизмы накопления энергии деформации
- •Фильм по процессам в деформированном материале
- •5.3. Возврат
- •Механизмы возврата
- •Модели зарождения новых зерен
- •Модели зарождения новых зерен
Особенности спинодального распада
Особенностью спинодального распада является то, что он происходит одновременно во всем объеме сплава.
Системы со спинодальным распадом, очень немногочисленны: Cu–Ni–Fe, в которой после превращения образуется структура из:
-правильно расположенных квазисферических частиц, занимающих небольшую долю объема;
-решетки стерженьковых выделений, располагающихся по направлению 100 и занимающих преобладающую долю объема.
Такая структура обладает высоким сопротивлением усталости среди медных сплавов вследствие высокой устойчивости выделений к повторному растворению и укрупнению.
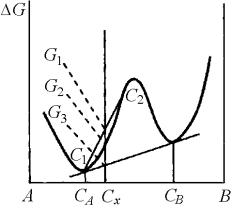
4.3. Распад пересыщенного твердого раствора
Сх – исходный состав сплава; G1 – средний
уровень свободной энергии сплава состава С1–С2; G2 – свободная энергия сплава Сх; G3 –
средняя свободная энергия сплава А–В)
Распад по механизму зарождения и роста частиц второй фазы.
Изменение свободной энергии при классическом распаде пересыщенного раствора по механизму зарождения и роста второй фазы показано на рис.
Сплав состава Сх при свободной энергии G2 является нестабильным по отношению к смеси двух фаз с составами СА и СВ, так как G2 > G3. Величина G = G2 – G3 является движущей силой распада. При этом начальные стадии распада сплава Сх на С1 и С2 приводят к возрастанию свободной энергии до значения G1.
Дальнейший распад, сопровождающийся итоговым снижением свободной энергии, не будет происходить до тех пор, пока не возникнет значительного изменения состава, например за счет некоторых флуктуаций. Как видно на рис., необходима флуктуация, приводящая к преодолению разности свободной энергии G = G1 – G2 = GА
Таким образом, стадия возникновения зародыша служит неким барьером GА, до
преодоления которого не может развиваться процесс фазового превращения.
Подобный тип превращения, начинающегося с обычного зарождения и роста выделений новой фазы, наблюдается в большинстве дисперсионно-стареющих сплавах.
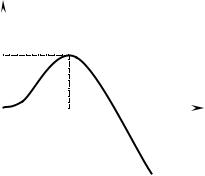
Зарождение частиц второй фазы
G |
|
|
|
Зарождение |
частиц второй |
фазы при |
распаде твердого |
|
|
|
|||||||
G* |
|
|
|
|||||
|
|
|
раствора может быть гомогенным и гетерогенным. |
|
||||
|
|
|
|
|
||||
|
|
|
|
Гомогенное |
зарождение |
происходит |
в |
отсутствие |
|
|
|
|
неоднородностей структуры. Изменение свободной энергии G, |
||||
|
|
r0 |
r |
|||||
|
|
|
|
связанное с гомогенным зарождением докритического зародыша |
||||
|
|
|
|
(эмбриона) новой фазы, равно сумме |
|
|
||
|
|
|
|
|
|
|||
объемной свободной энергии GV, поверхностной энергии , необходимой для
возникновения новой поверхности, и упругой энергии деформации матрицы:
G GV + +
Для сферического зародыша радиусом r
G 4 r2 + (4/3) r3( GV + ).
График зависимости свободной энергии сферического зародыша от его радиуса приведен на рис. Продолжающийся рост зародыша возможен в том случае, если его радиус превышает значение r0, при котором d( G)/dr = 0, т.е.
r0 = –2 /( GV + ) r0 1/(Тпл – Т)
и критическая свободная энергия, или энергия активации процесса образования
зародыша, определяется соотношением
G* = (16 /3) 3/( GV + ) G* 1/(Тпл – Т)2.
Скорость гомогенного зарождения выделения второй фазы может быть представлена
IV K exp |
А |
3 |
/( GV ε) |
2 |
GD |
||
следующим упрощенным соотношением |
: |
|
|
|
|||
|
|
|
|
k Т |
|
|
|
|
|
|
|
|
|
||
где А и K – постоянные, причем А характеризует геометрическую форму зародыша; GD – свободная энергия активации диффузии.
Гетерогенное зарождение второй фазы
Гетерогенное зарождение второй фазы происходит на структурных неоднородностях и дефектах (например, границах зерен, дислокациях, скоплениях примесей и дефектов), т.е. на местах с повышенным уровнем свободной энергии.
Обычная сегрегация атомов растворенного компонента на границах зерен и дислокациях также облегчает возникновение соответствующей группы атомов, формирующих зародыш новой фазы, рост которого происходит за счет ускоренной диффузии.
Энергетический барьер для гетерогенного зарождения пропорционален величине 16 3/3 GV2. Если этот барьер велик, то
преобладает гомогенное зарождение.
Энергия гетерогенного зарождения меньше энергии гомогенного зарождения, и отношение Gгет/ Gгом уменьшается по мере увеличения
безразмерного параметра от 0 до 1:
= GV b2/2 2 2.
Существующие теории гетерогенного зарождения позволяют анализировать особенности и тенденции гетерогенного зарождения новой фазы, но не позволяют получать количественные данные.
Образование переходных фаз
При распаде твердого раствора может возникнуть метастабильная(ые) или переходная(ые) фаза(ы) до образования равновесного выделения или одновременно с
этим выделением.
Основными причинами образования этих фаз являются:
-наличие некоторого локального избытка растворенного элемента (чем больше пересыщение раствора, тем вероятнее образование метастабильной фазы; -наличие избытка «закалочных» вакансий;
-наличие хорошего размерного соответствия решеток метастабильной фазы и матрицы,
заметно снижающего поверхностную энергию.
Виды переходных фаз:
-полностью когерентная с матрицей - зоны Гинье–Престона в сплавах системы Al–Cu, (плоские скопления (кластеры) атомов меди на плоскостях 100 алюминиевой матрицы, причем диаметр такого кластера порядка 10 нм.). Такие когерентные зоны в дальнейшем могут играть роль центров зарождения других метастабильных
выделений, благодаря чему путем правильно подобранной термообработки можно
обеспечить равномерное распределение этих вторичных выделений в
микроструктуре сплава.
-полукогерентные переходные фазы зарождаются преимущественно на дислокациях и на некоторых участках, не поддающихся обнаружению при помощи просвечивающей микроскопии (например, на вакансионных кластерах);
Напомним, равновесные выделения преимущественно зарождаются на большеугловых границах зерен.
Влияние примесей на зарождение выделений второй фазы
Высокая скорость выделения метастабильных фаз существенно уменьшает избыток свободной энергии, превращая процесс распада пересыщенного твердого раствора в многостадийный процесс, заканчивающийся образованием
стабильных фаз и растворением менее стабильных фаз.
Влияние примесных элементов на зарождение выделений второй фазы достаточно велико и проявляется посредством ряда механизмов:
1.Примеси могут взаимодействовать с вакансиями, уменьшая скорость объемной диффузии компонентов сплава.
2.Примеси могут изменять энергию поверхности раздела между выделением и матрицей, что влияет на скорость зарождения образующейся фазы.
3.Примеси могут изменять зависимость свободной энергии от состава, что может способствовать образованию выделений различных избыточных фаз.
Например, добавка 0,1%Ag в сплав Al–Cu–Mg вызывает гомогенное зарождение тройной Т-фазы вместо обычных зон Гинье–Престона и S-фазы, зарождающейся на дислокациях.
4.Примеси могут сегрегировать на границах зерен и препятствовать
образованию выделений.
В заключение отметим, что перечисленные механизмы влияния примесей на распад пересыщенных твердых растворов могут проявляться в конкретных системах сплавов и не проявляться в других, т.е. не являются универсальными.
Рост выделений из пересыщенного твердого раствора
Стадия зарождения выделений второй фазы заканчивается образованием большого количества зародышей, поэтому стадию роста выделений обычно рассматривают при предположении, что все зародыши существуют с самого начала превращения.
Предполагается, что рост выделений из пересыщенного твердого раствора контролируется:
-диффузией атомов к поверхности (и от поверхности) раздела;
-скоростью перехода через поверхность.
На начальной стадии роста частиц основным контролирующим механизмом роста, по-видимому, можно считать переход атомов через поверхность.
По мере роста размера и площади поверхности частиц второй фазы основным механизмом, контролирующим рост частиц, по- видимому, становится диффузия атомов в матрице, поскольку непрерывный уход растворенных атомов в выделения приводит к снижению градиента концентрации и замедлению диффузии. При любом превращении, сопровождающимся переносом атомов на значительные расстояния, должно выполняться уравнение диффузии:
D 2С С / t
Рост выделений, контролируемый диффузией
Для изолированного выделения в бесконечной матрице, когда объемный коэффициент диффузии в матрице равен D, а концентрация растворенного элемента в матрице составляет Cм = C(r,t), при соответствующих начальных и краевых условиях получим для радиуса сферического выделения следующее соотношение:
R = j (Dt)1/2,
где j – параметр, определяющий кинетику роста выделения, зависящий от степени пересыщения раствора .
Параболическая зависимость – признак диффузионного роста.
Пересыщение раствора K определяют:
K = 2(С – См) / (СВ – С).
Здесь С – концентрация растворенного элемента в матрице вблизи поверхности выделения; См – концентрация растворенного элемента в матрице вдали от выделения; СВ – концентрация растворенного элемента в выделении.
Рост выделений, контролируемый диффузией
(продолжение)
Для плоского выделения тоже получена параболическая зависимость
для полуширины выделения S от времени t:
S = j (Dt)1/2
На границах раздела кинетика роста частиц второй фазы подчиняется тоже закономерности параболического роста для плоской и разупорядоченной межфазной границы.
При образовании на границах зерен фазы АВ (нитридов или карбидов) процесс контролируется диффузией элемента замещения А, так как элемент внедрения В диффундирует достаточно быстро.
Например, по расчету скорость роста пластинчатых выделений NbC и AlN на границах аустенитных зерен в обычных углеродистых сталях очень мала. В частности, при температуре 1300 С рост пластинчатого выделения до толщины 0,2 мкм продолжается 105 с.
Таким образом, представленные выше теоретические соотношения могут быть использованы для оценок размеров выделений (и возможного изменения свойств) при знании коэффициентов диффузии и растворимости (концентрации) компонентов в образующемся выделении.
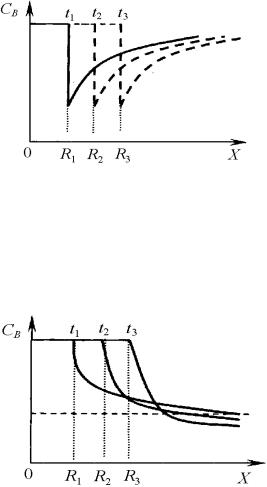
концентрации компонента В при росте выделения во времени t в направлении Х (Ri – радиус выделения;
t3 > t2 > t1)
концентрации компонента В при растворении выделения во времени t в направлении Х (Ri – радиус выделения; t3 > t2 > t1)
Растворение выделений
Устойчивость образовавшихся при распаде твердого раствора выделений зависит от многих факторов, и, прежде всего, от температуры.
Если температура сплава превышает температуру сольвуса (растворимости) для этого выделения, то происходит растворение кристаллов выделившейся фазы из-за химической нестабильности этих кристаллов при повышенной температуре.
Сопоставление процессов роста и растворения (рис.) выделений показывает, что нельзя рассматривать процесс растворения как обратный процессу роста.
Существует разный характер изменения концентрации в области, окружающей выделение, что объясняется неодинаковым значением исходного радиуса.
Если рост выделения сопровождается обеднением матрицы растворенным компонентом на участке перед движущейся поверхностью раздела, то во время растворения выделения концентрация растворенного компонента в дальних областях матрицы увеличивается с течением времени, а на участке, непосредственно примыкающем к выделению, она непрерывно уменьшается.
