
- •2. Ионный источник, ионизационная камера.
- •3. Разделение ионов по массе в масс-анализаторе (магнит и анализатор)
- •I. Фрагментация насыщенных ув
- •Б) Фрагментация циклоалканов.
- •Фрагментация гетероорганических соединений
- •Применение масс-спектрометрии
- •Масс-спектрометрия позволяет решить следующие задачи:
Лекция 9
МАСС-СПЕКТРОМЕТРИЯ
Масс-спектрометрия – один из наиболее эффективных и широко применяющихся в настоящее время аналитических методов. Его отличают высокая селективность, чувствительность и точность.
Принцип метода состоит в том, что определяемое вещество переводят в газообразное состояние, ионизируют и образовавшиеся ионы (заряженные фрагменты исходных молекул) разделяют в магнитном поле по величинам отношения массы к заряду. Газообразные ионы разделяются в магнитном поле в зависимости от отношения m/z (m/e), где m – масса, z (e) – заряд иона. Чаще всего ионизация молекул в газообразном состоянии происходит под действием потока электронов. Электроны, сталкиваются с молекулой, причем в условиях глубокого вакуума на результат соударений сказывается энергия налетающих электронов. Как только энергия электронов окажется выше порога ионизации (10-12 eV), происходит ионизация молекулы и отрыв валентного электрона с образованием положительно заряженного иона. Наиболее вероятными являются процессы образования однозарядных положительных ионов:

 М
+ e
= M+
+ 2 e
М
+ e
= M+
+ 2 e
Образование двух- и более высокозаряженных ионов, а также захват электрона с образованием отрицательных ионов являются менее вероятными процессами. Сущность метода коротко описать можно так: вещество, попадая в ионизационную камеру ионизируется (распадается на ионы), формируется пучок ионов с последующим разделением их в электрических или магнитных полях по величине отношения массы к заряду, улавливания ионов с одинаковыми значениями этого отношения и фиксирования прибором. По величине m/z (m/e) определяют массовое число иона, а по интенсивности соответствующего сигнала судят о концентрации ионов.
Поэтому масс-спектрометрический анализ обычно включает несколько этапов: 1) Ввод газа или получение и ввод пара исследуемого вещества в источник ионов; 2) Получение ионов из атомов или молекул и формирование их в пучок; 3) Разделение ионов по отношению масс к заряду; 4) Детектирование ионов с последующим измерением их числа или ионного тока. Принципиальная схема масс-спектрометра:

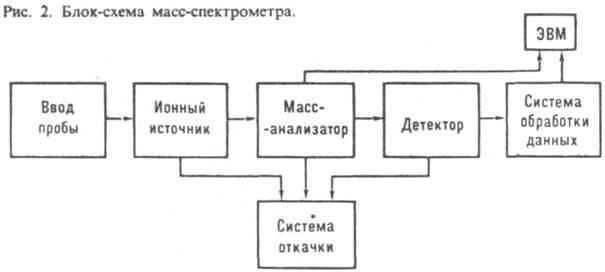
1 – система ввода пробы (система напуска) – ввод газа (пара из жидкости);
2 - ионный источник предназначен для образования газообразных ионов исследуемого вещества и формирования ионного пучка, который направляется далее в масс-анализатор (наиболее универсальный метод ионизации вещества - электронный удар);
3 – масс-анализатор (катод, анод, ускоряющие пластинки, постоянный магнит)
4 – детектор;
5– система откачки
1. Система ввода (напуска) пробы
В системе напуска (ввода) пробы, представляющей собой камеру, анализируемое вещество при нагревании переводится в газообразное состояние при остаточном давлении Р=10-2 --10-3 Па (мм. рт. ст.) Если анализируемый образец - газообразное вещество, то стадия испарения отпадает. Жидкие вещества, не летучие при комнатной темп-ре, нагревают до Т= +300оС. В современных приборах предусмотрен прямой ввод образца в ионизационную камеру. Далее молекулярный пучок вещества ионизируется. В ионизационной камере высокий вакуум Р=10-6 Па. При таком давлении большинство веществ переходит в газообразное состояние (становится летучим) не подвергаясь деструкции.
2. Ионный источник, ионизационная камера.
Ионизация – превращение молекулы в ионы, для этого требуется затратить определенную энергию. Способы ионизации. Выбор способа ионизации зависит от свойств определяемого вещества, матрицы, в которую оно включено, и желаемой степени ионизации. При помощи стандартного оборудования можно ионизировать вещества с ММ до 20 000, но есть приборы и для ионизации соединений, ММ которых достигает 150 000 –200 000.
А) При ионизации электронным ударом молекулы газообразного вещества бомбардируют потоком электронов, в результате чего образуется множество осколочных ионов. Масс-спектры в этом случае весьма сложны, и для их интерпретации используют специальные каталоги спектров.
Б) Один из наиболее распространенных методов мягкой ионизации летучих веществ – химическая ионизация. В этом методе в ионизационной камере поддерживают высокую концентрацию метана (аммиака), который ионизируется при бомбардировке электронами в первую очередь. Затем ионы метана сталкиваются с молекулами исследуемого вещества, и в результате ион-молекулярных реакций образуются ионы (M + 1)+ и (M – 1)+.
В) Для мягкой ионизации жидких образцов используют бомбардировку быстрыми атомами. Для элементного и изотопного анализа применяют индуктивно-связанную аргоновую плазму. С ее помощью осуществляют отбор и ионизацию образца, а в масс-спектрометре проводят разделение ионов. Для элементного анализа поверхностей используют метод масс-спектрометрии вторичных ионов. Потоком ионов Ar+ или Xe+ бомбардируют поверхность образца, и высвободившиеся молекулярные вторичные ионы направляют в масс-анализатор. Еще один метод мягкой ионизации – так называемая полевая десорбция; в этом случае ионы образуются под действием сильного электрического поля. Его чаще используют для ионизации неполярных, термически нестабильных веществ, а также соединений с большой мол. массой (полимеров), т.е. в тех случаях, когда нельзя применять бомбардировку быстрыми атомами.
Если энергия ионизации повышается, то молекулярный ион распадается на более мелкие осколочные ионы, которые могут участвовать затем в реакциях перегруппировки с образованием других ионов. Следовательно, масс-спектр является своего рода «отпечатком» вещества. Ионизацию, которая приводит к значительной фрагментации, называют жесткой. В отличие от нее при мягкой ионизации наблюдается значительно меньшая фрагментация, но увеличивается высота пика молекулярного иона.
Г) Все более широкое распространение получает ионизация распылением (электрораспыление, термораспыление и т.д.). В этом методе ввод растворенного вещества и его ионизация осуществляются в одну стадию.
Для ионизации электронным ударом используется стабилизированный пучок электронов, перпендикулярный потоку пробы вещества. Энергия электронов обычно составляет 10-100 eV. При бомбардировке электронами одновременно происходит несколько процессов: образование положительных молекулярных ионов (при невысоких энергиях 10-15 eV) и фрагментация молекул с образованием осколочных ионов (при высоких энергиях 50-70 eV).
 Процессы,
протекающие под действием электронного
удара:
Процессы,
протекающие под действием электронного
удара:
А )
Е = J,
энергия e
равна (близка) потенциалу ионизации,
т.е. энергии, необходимой для получения
иона, то получается молекулярный ион;
)
Е = J,
энергия e
равна (близка) потенциалу ионизации,
т.е. энергии, необходимой для получения
иона, то получается молекулярный ион;
Б) Е > J, энергия e больше потенциала ионизации, при этом образуются осколочные ионы;
В )
Е>>>J,
энергия e
намного больше потенциала ионизации,
при этом образуются перегруппировочные
ионы.
)
Е>>>J,
энергия e
намного больше потенциала ионизации,
при этом образуются перегруппировочные
ионы.
Например. Молекула А-Б-С-Д попадает под действие пучка электронов:
Е= J
А –Б
– С – Д --
e
[А–Б – С – Д]+
+ 2 e
молекулярные ионы
–Б
– С – Д --
e
[А–Б – С – Д]+
+ 2 e
молекулярные ионы
Е > J -- e [А – Б]+ + С – Д* осколочные ионы (связи не нарушаются)
Е > J -- e [А – Б – С]+ + Д* осколочные ионы
Е>>>J -- e [А – Б – Д]+ + С* перегруппировочные ионы
Процессы образования положительно заряженных молекулярных и осколочных ионов можно рассмотреть на примере этана СН3 – СН3. В результате взаимодействия молекулы этана с ионизирующими электронами образуется молекулярный ион, характеризующий молекулярную массу и эмпирическую формулу соединения: СН3 – СН3 -- e [СН3– СН3]+ + 2e m/z =30
Только 11-12 % образовавшихся ионов не диссоциируют, остальные распадаются с разрывом связей С-С и С-Н на осколочные ионы:
[СН3 – СН3]+ -- e [СН3 – СН2]+ + Н* m/z =29
-- e [СН3]+ + СН3* m/z =15
-- e [СН2]+ + [СН3]+ + Н* m/z =14
-- e [СН]+
-- e [С]+
Образовавшиеся положительно заряженные ионы и осколки проходят через ускоряющие пластины, разность потенциалов между которыми достаточно высока (несколько тысяч вольт). Здесь они приобретают энергию eV, (где V = 5-100 V, потенциал, ускоряющий движение электронов e - заряд) а их скорость возрастает до v. Энергия eV будет равна кинетической энергии ионов mv2/2 (m – масса иона, v – скорость иона):
eV = mv2/2
Потенциалы ионизации J (eV):
органические соединения - 8 – 13
алканы - 10 – 13
непредельные соединения - 9 – 10
ароматические - 8,5 – 9
полициклические аромат. соединения - менее 8,5
Направления распада ионов для каждого класса соединений строго определенные и эти направления получили название «пути фрагментации».
