
§ 9.4 Распределение молекул газа по скоростям (распределение Максвелла)
При изучении газов принята основная модель — модель идеального газа как большого коллектива невзаимодействующих частиц, непрерывно участвующих в беспорядочном тепловом движении. К этому коллективу частиц применим статистический метод, базирующийся на математической теории вероятностей, на понятиях о средних, среднеквадратичных и наиболее вероятных параметрах, характеризующих поведение частиц в коллективе.
Рассмотрим распределение Максвелла или распределение молекул по скоростям.
Скорости молекул газа имеют различные значения и направления, причём как величина, так и направление скорости каждой отдельной молекулы изменяются в результате соударений, поэтому нельзя определить число молекул, обладающих точно заданной скорости в данный момент времени, но можно подсчитать число молекул, скорости которых лежат в интервале от υ1 до υ2.
Такая теоретическая зависимость была установлена Максвеллом на основании теории вероятностей: число молекул dN, скорость которых лежит в узком интервале между υ и υ +dυ, пропорциональна общему числу молекул N, ширине интервала dυ и зависит от скорости υ.
 (9.36)
(9.36)
Функцию
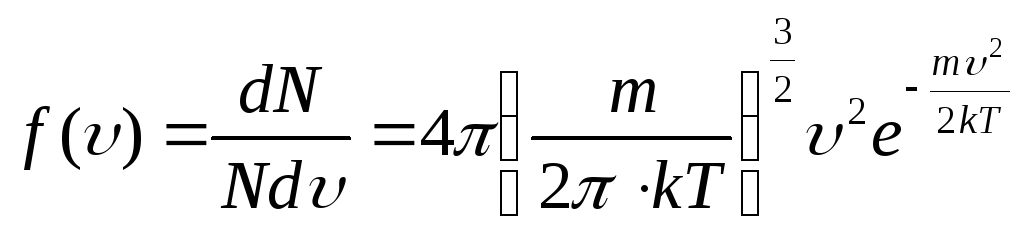 (9.37)
(9.37)
показывающую относительное число молекул, скорость которых лежит в интервале скоростей dυ, называют функцией распределения молекул газа по скоростям.
Г рафически
эта функция показана на рис. 9.12, а.
Заштрихованная площадкаf(υ)dυ
равна dN/N,
т. е. относительному числу молекул газа,
скорости которых лежат в интервале от
υ до υ + dυ.
Максимум кривой распределения
соответствует наиболее вероятной
скорости молекул υВ,
которую можно найти, исследовав на
максимум функцию f(υ).
рафически
эта функция показана на рис. 9.12, а.
Заштрихованная площадкаf(υ)dυ
равна dN/N,
т. е. относительному числу молекул газа,
скорости которых лежат в интервале от
υ до υ + dυ.
Максимум кривой распределения
соответствует наиболее вероятной
скорости молекул υВ,
которую можно найти, исследовав на
максимум функцию f(υ).
Беря производную от
 (9.38)
(9.38)
по скорости и приравнивая её нулю, получаем
 ,
,
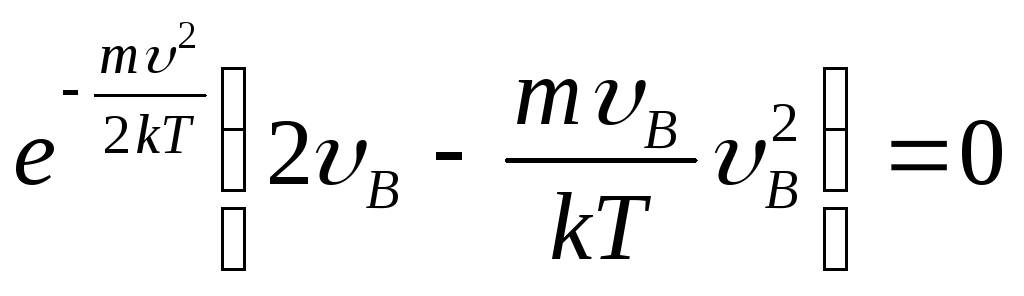
откуда
![]() (9.39)
(9.39)
- наиболее вероятная скорость молекул газа.
Именно около этого (а не среднего, которое в 1.13 раза больше) значения группируется большинство скоростей, с которыми движутся молекулы газа.
Вид функции распределения f(υ) зависит от рода газа (массы молекул) и температуры Т. Давление и объем газа на распределение молекул по скоростям не влияют.
При повышении температуры (Т2 > Т1) υВ возрастает, поэтому максимумы кривой распределения молекул по скоростям сдвигаются в сторону больших скоростей (υ2>υ1); следовательно, с ростом температуры возрастает относительное число молекул, обладающих большой скоростью. Площади, ограниченные кривыми 1 и 2 (рис. 9.12, б), должны быть равны между собой, так как их величина пропорциональна общему числу молекул, которое в обоих случаях сохраняется неизменным.
Кроме наиболее вероятной скорости движение молекул газа характеризует средняя арифметическая скорость, определяемая формулой
![]() (9.40)
(9.40)
- средняя арифметическая скорость молекул газа и
![]() (9.41)
(9.41)
- средняя квадратическая скорость молекул газа Функция распределения молекул по энергии имеет вид
 (9.42)
(9.42)
Средняя кинетическая энергия молекулы идеального газа определяется интегралом
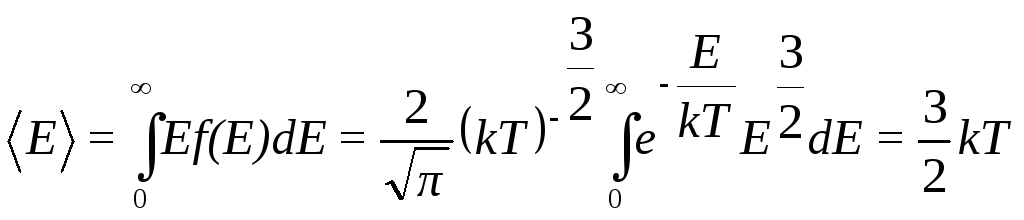 (9.43)
(9.43)

Опыт Штерна. Одним из первых экспериментов, в котором были измерены скорости движения отдельных молекул газа, был опыт, выполненный немецким физиком Отто Штерном в 1920г. В опыте использовался прибор, состоящий из двух цилиндров разного радиуса с общей осью вращения рис. По оси цилиндра была расположена платиновая проволока, покрытая серебром. В пространстве внутри цилиндров посредством непрерывной откачки воздуха поддерживалось достаточно низкое давление. При пропусканииэлектрического токачерез проволоку в результате её нагревания до температуры плавления серебра, происходило испарение атомов серебра с поверхности проволоки.Во внутреннем цилиндре была проделана узкая щель, через которую атомы могли беспрепятственно пролетать далее и оседать на внутренней стенке второго цилиндра, образуя на ней заметную полоску.
З атем
всю систему начинали вращать с некой
достаточно большой частотой ν.
При этом полоса налёта смещалась в
сторону, противоположную направлению
вращения, и теряла чёткость. Измерив
угол φ между этими двумя положениями
полоски (рис.), расстоянию ℓ=R1-R2
и частоте вращения ν
цилиндров можно было определить скорость
атомов серебра.
атем
всю систему начинали вращать с некой
достаточно большой частотой ν.
При этом полоса налёта смещалась в
сторону, противоположную направлению
вращения, и теряла чёткость. Измерив
угол φ между этими двумя положениями
полоски (рис.), расстоянию ℓ=R1-R2
и частоте вращения ν
цилиндров можно было определить скорость
атомов серебра.
![]() (9.44)
(9.44)
Найденные из таких измерений значения скорости движения атомов серебра, оказались совпадающими со значениями, полученными на основе молекулярно-кинетической теории.
Размытость полоски свидетельствовала о том, что скорости атомов серебра, испаряющиеся с проволоки различны и распределены по закону распределения Максвелла: атомы, двигавшиеся быстрее, смещались относительно полосы, полученной в состоянии покоя, на меньшие расстояния, чем те, которые двигались медленнее.
Опыт являлся одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.
