
лекции по физике_1 / Lekcija_12-2015
.pdf
Лекция 12. Теплоемкость идеального газа при изопроцессах
Адиабатический процесс, уравнение Пуассона. Политропический процесс.
Теплоемкость и работа в политропических процессах.
Газ Ван-дер-Ваальса.
Внутренняя энергия газа Ван-дер-Ваальса.
1

Мудрые люди обдумывают свои мысли, глупые провозглашают их.
Г. Гейне
Учение без размышления бесполезно, размышление без учения опасно.
Конфуций
2

Теплоѐмкость идеального газа при изопроцесах
Теплоѐмкость тела характеризуется
количеством теплоты, необходимой для нагревания этого тела на один градус
C ddQT .
Единица измерения теплоемкости: [C] = Дж/К.
Теплоѐмкость – величина неопределѐнная, поэтому используют понятия удельной и
молярной теплоѐмкости.
3
Удельная теплоѐмкость Суд или с – есть
количество теплоты, необходимое для нагревания 1кг вещества на 1 градус:
C c |
dQ |
|
|
m dT |
[Cуд] = Дж/(кг К). |
||
уд |
|||
|
|
Для газов удобно пользоваться молярной теплоемкостью Сμ количество теплоты, необходимое для нагревания 1 моля газа на 1
градус: |
dQ |
||
C |
|||
|
|
||
μ |
ν dT |
||
|
|||
Cμ Cуд μ |
[Cμ] = Дж/(моль К). |
||
|
|||
4

Изохорный процесс
Если газ нагревать при постоянном объѐме, то всѐ подводимое тепло идѐт на нагревание газа, то есть изменение его внутренней энергии.
Теплоѐмкость при постоянном объѐме СV
5
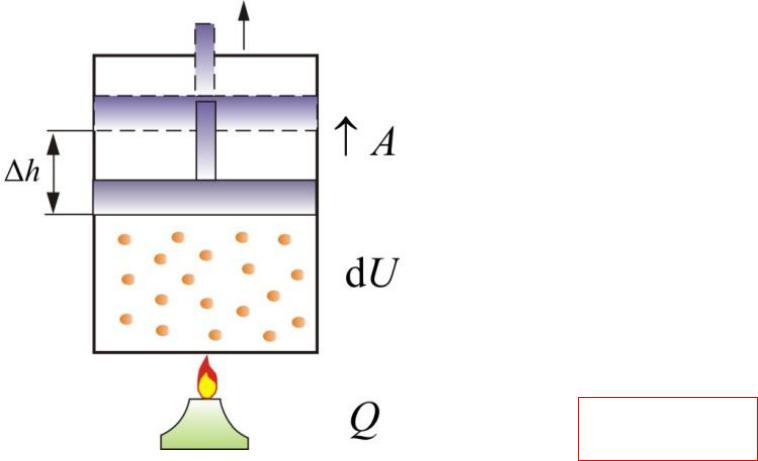
Изобарный
процесс
Проводимое тепло затрачивается и на нагревание и на совершение работы
CP CV .
СР – теплоемкость при постоянном давлении
Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу.
6

Связь между CP и CV
Пусть мы нагреваем один моль идеального газа при постоянном объѐме. Из первого начала термодинамики:
δQ dU δA.
dQ dU, т.к. dA 0
т.е. бесконечно малое приращение количества теплоты, dQ равно приращению внутренней энергии dU.
Теплоемкость при постоянном объѐме будет равна:
CV ddQT ddUTμ .
7

В общем случае |
|
U |
|
CV |
|
|
|
T |
|
|
V |
так как U может зависеть не только от температуры.
В случае идеального газа справедлива
формула
dUμ CV dT
|
|
|
|
|
T |
|
|
|
|
|
|
Из этого следует, что |
Uμ CV dT CV T |
||||
|
|
|
|
|
0 |
|
|
Uμ CV T |
|
||
|
|
|
|
||
|
|
|
|
|
|
8

Внутренняя энергия идеального газа является только функцией температуры
(и не зависит от V, Р и т.п.), поэтому
формула Uμ CV T справедлива для любого
процесса.
При изохорическом процессе для произвольной массы идеального газа:
U mμ CV T.
9

При изобарическом процессе кроме увеличения внутренней энергии происходит
совершение работы газом: |
|
|
δQ dU δA. |
||||||||||
или dQP dUμ PdVμ |
тогда: |
|
|
|
|
||||||||
Q |
|
dU |
M |
|
PdV |
|
|
|
dU |
|
|
V |
|
|
|
|
|
|
|
C |
|
|
|
|
P |
|
|
|
|
|
|
|
P |
|
|
|
|||||
dT |
|
dT |
dT |
|
|
dT |
|
T |
|||||
|
|
|
|
|
|||||||||
P
PVμ RT, V RTP
CP CV R.
|
V |
|
|
R |
|
|
|
|
|
|
|
|||
|
T |
|
|
P |
|
P |
|
Соотношение
Майера
10
