
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Применение катализа в промышленности[править | править вики-текст] Гидрирование[править | править вики-текст]
- •Гомогенный катализ[править | править вики-текст]
- •Гетерогенный катализ[править | править вики-текст]
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Сильные и слабые электролиты
- •Вопрос 25
- •10. Электропроводность растворов электролитов
- •Вопрос 26
Вопрос 23
Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества, его молярной концентрации, а также некоторыми другими способами.
Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора,т.е.

Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.

Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называетсяодномолярным (1М), если 0,1 моль вещества – децимолярным (0,1М), если 0,01 моль вещества – сантимолярным(0,01М), если 0,001 моль вещества – миллимолярным (0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
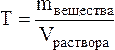
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
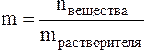
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:

Мольная доля – это безразмерная величина и измеряется в долях единицы или в %.
Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т.е.

Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалентавещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества – децинормальным (0,1н), если 0,01 моль вещества – сантинормальным (0,01н), если 0,001 моль вещества – миллинормальным (0,001н).
Коллигативные свойства растворов — это те свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара над раствором по сравнению с растворителем;
2) повышение температуры кипения и понижение температуры замерзания (кристаллизации) растворов по сравнению с раствори-телем;
3) осмотические явления.
Закон
Рауля:относительное
понижение давления насыщенного пара
растворителя над раствором равно
молярной доле растворенного вещества,
т.е. ![]() ,
где N и n – количества растворителя и
растворенного вещества соответственно.
Закон Рауля используют для определения
молярной массы вещества.
,
где N и n – количества растворителя и
растворенного вещества соответственно.
Закон Рауля используют для определения
молярной массы вещества.
Следствия из закона Рауля:
1. понижение температуры замерзания растворов.
Температура замерзания (кристаллизации) жидкости – температура, при которой давление пара над жидкостью равно давлению пара над твердой фазой. Температура замерзания раствора ниже температуры замерзания растворителя:
Тзам(р-р) = Тзам(р-ль) –ΔТ
ΔТ=К·b(Х)
![]()
![]() ,
где
,
где
ΔТзам - понижение температуры замерзания раствора (К);
b(X) – моляльная концентрация раствора (моль/кг);
К - криоскопическая константа растворителя (К·кг/моль);
m – масса растворенного вещества (г);
m1 – масса растворителя (г);
M – молярная масса растворенного вещества (г/моль).
2. Повышение температуры кипения раствора
Температура кипения жидкости – температура, при которой давление пара жидкости будет равно внешнему давлению (при 101,кПа температура кипения воды 100°С). Температура кипения раствора выше температуры кипения растворителя.
Ткип(р-р) = Ткип(р-ль) +ΔТкип
ΔТкип=Е·b(Х)
![]()
![]() ,
где
,
где
ΔТкип - повышение температуры кипения раствора (К);
b(X) – моляльная концентрация раствора (моль/кг);
Е - эбулиоскопическая постоянная растворителя (К·кг/моль)
