
03. Колігативні властивості розчинів_new хімія
.pdf
Рауль показав (другий закон), що підвищення температури кипіння
(Δtкип) або зниження температури замерзання (Δtзам) розчину прямо пропорційне моляльній концентрації розчиненої речовини, або
де Сm - моляльна концентрація розчину;
kеб і kкр - коефіцієнти пропорційності, ебуліоскопічна і кріоскопічна сталі.
Користуючись математичним записом другого закону Рауля і знаючи моляльну концентрацію розчину за відомим значенням зниження температури замерзання розчину чи підвищення температури кипіння розчину можна розрахувати молекулярну масу речовини - неелектроліта. Визначення молекулярних мас речовини за зниженням температури замерзання або підвищенням температури кипіння розчинів називається відповідно кріоскопією
(кріоскопічний метод) і ебуліоскопією (ебуліскопічний метод). Ці методи використовуються для встановлення складу сполук, визначення ступеня дисоціації електролітів, вивчення процесів полімеризації й асоціації речовин у розчинах.
Властивість розчинів замерзати при більш низькій температурі, ніж температура замерзання чистого розчинника, широко використовують для приготування різних охолодних сумішей і розчинів з низькою температурою замерзання (антифризів), які застосовують у лабораторній техніці і промисловості. Для приготування охолоджених сумішей використовують хлориди натрію, а амонію, магнію і калію, нітрати натрію й амонію та інші. Так,
суміш 100г снігу і 33г NaСl замерзає при - 21°С, а суміш 100г снігу і 125г СаС12 •
6Н2O - при - 40,3°С.
Антифризи С2Н5ОН, етиленгліколю і гліцерину залежно від масового співвідношення компонентів не замерзають від -15 до -75°С і нижче. Так,
66,7% -й водний розчин етиленгліколю замерзає при -75°С.
Визначення молекулярної маси речовини за зниженням температури замерзання або підвищенням температури кипіння розчинів називається
кріоскопією (кріоскопічний метод) та ебуліоскопією (ебуліоскопічний метод).

Визначення ізотонічного коефіцієнта розчину електроліту методом кріометрії.
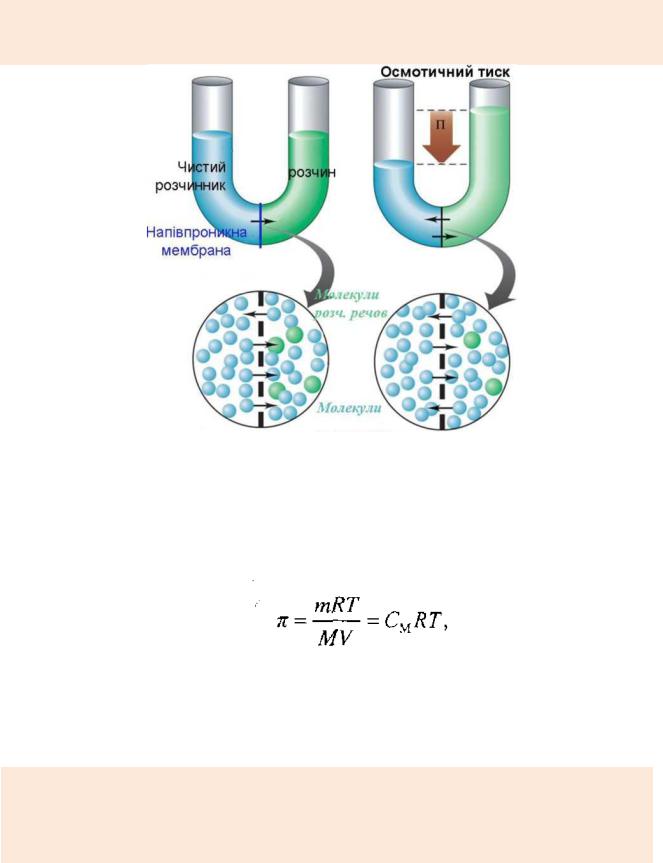
ЗАКОН ОСМОТИЧНОГО ТИСКУ
Якщо поверх концентрованого розчину якої-небудь речовини, поміщеної в циліндрову посудину, обережно налити, уникаючи перемішування, шар більш розбавленого розчину або розчинника, то через деякий час концентрації розчиненої речовини в будь-якій частині розчину зрівняються. Це пояснюється тим, що частинки, проявляючи загальну тенденцію до збільшення невпорядкованості, рухаються від місця з великою концентрацією до місця з меншою концентрацією; частинки розчиненої речовини проникають в середовище частинок розчинника, а частинки розчинника - в середовище розчиненої речовини. Це явище називається дифузією.
Дифузією називається процес мимовільного вирівнювання концентрації розчину.
Якщо розділити розчин і розчинник напівпроникною перегородкою
(мембраною), крізь яку проходять молекули розчинника і не проходять молекули розчиненої речовини, то наступить одностороння дифузія молекул розчинника через мембрану.

Процес односторонньої дифузії молекул через напівпроникну перегородку
називається осмосом, а тиск, який викликає осмос, називається осмотичним
тиском.
Розглянемо схему приладу для визначення осмотичного тиску -
осмометра.
Простий осмометр складається з скляної градуйованої трубки, розширений кінець якої щільно закритий напівпроникною перегородкою. У трубку наливають який-небудь розчин, наприклад, розчин цукру у воді.
Відзначивши рівень рідини в трубці, її занурюють в посудину з розчинником (водою) на таку глибину, щоб рівні рідин в обох посудинах співпали. Через деякий час рівень рідини в трубці підніметься і досягне деякої певної висоти (h).
Припинення підйому рідини в трубці означає, що в системі встановилася рівновага, яка характеризується однаковим числом молекул розчинника, що проникають у взаємно протилежних напрямах - від розчинника до розчину і від
розчину до розчинника.
Таким чином, розчин лише в тому разі може знаходитися в рівновазі з розчинником за наявності напівпроникної перегородки, якщо до останньої з боку розчину буде прикладений деякий надмірний тиск, званий осмотичним.
Осмотичний тиск чисельно дорівнює додатковому тиску, який
необхідний для припинення осмосу.
Вант-Гофф звернув увагу на те, що осмотичний тиск розбавлених розчинів підкоряється законам ідеальних газів. Звідки він зробив висновок, що осмотичний тиск можна розрахувати за рівнянням Менделєєва-Клапейрона.
Вант-Гофф вивів рівняння для визначення осмотичного тиску розчину:
де п- осмотичний тиск розчину, кПа або атм; См - молярна концентрація розчину, моль/л; R - універсальна газова стала (8,314 Дж/(моль-К або
0,082 л·атм/(моль · K)); Т - абсолютна температура, К.
Наведене вище рівняння є математичним виразом закону осмотичного тиску Вант-Гоффа, який формулюють так: осмотичний тиск розчину прямо пропорційний його молярній концентрації та абсолютній температурі.

Або осмотичний тиск розчину чисельно дорівнює тиску, який чинила би розчинена речовина, якби вона при тій же самій температурі знаходилася в газоподібному стані і займала об'єм, що дорівнює об'єму розчину. Це і є закон осмотичного тиску.
Як уже зазначалось, осмотичний тиск - це колігативна характеристика розчину, тобто його величина залежить від сумарного числа частинок у розчині,
інакше, осмотичної концентрації (осмоляльності):
Зрозуміло, що для розчинів не електролітів С см = См, а для електролітів Сош > См настільки, наскільки зростає число частинок у розчині внаслідок дисоціації: Сосм =/ См.
Тому для розведених розчинів електролітів враховують величину ізотонічного коефіцієнта Вант-Гоффа і осмотичний тиск обчислюють за рівнянням:
Осмотичний тиск розведених розчинів як неелектролітів, так і електролітів можна обчислити за результатами ебуліометричних або кріометричних вимірювань, визначивши осмоляльну концентрацію із другого закону Рауля:
Якщо знехтувати різницею між моляльною і молярною концентраціями для розведених розчинів, то одержимо формулу для обчислення осмотичного тиску розчинів неелектролітів і електролітів ебуліометричним або кріометричним методами:

Експериментально визначена величина зниження температури замерзання плазми крові людини дорівнює 0,56 К, кріометрична стала води дорівнює 1,86. За цими даними можна обчислити осмотичний тиск плазми крові за температури 37 °С:
Метод дослідження, який ґрунтується на вимірюванні осмотичного тиску розчинів, називають осмомєтрією. Ним переважно користуються для обчислення молярної маси речовин. Вимірявши експериментально осмотичний тиск розчину
п, за масою речовини т, що за певної температури Т міститься в 1 дм3 розчину,
можна обчислити молярну масу розчиненої речовини В:
На практиці осмометрія є одним із важливих методів визначення молярних мас високомолекулярних сполук.
Чому для розчинів електролітів для розрахунку осмотичного тиску
вводять ізотонічний коефіцієнт?
Розглянемо приклад: Приготовані два розчини з однаковою концентрацією - 1 моль/л (1 М), але в одному знаходиться електроліт NaCI, а в іншому - глюкоза -
неелектроліт.
Порівняємо осмотичні тиски в цих розчинах. Як показує дослід Росм (NaCI)>
(глюкози). Це пов'язано з тим, що NaCI - електроліт, і у водних розчинах дисоціює на іони Na+ та Сl- причому з однієї молекули має утворюватися 2 іони. Так як Рocм, р, Δtкип, tкрист залежать лише від кількості частинок, що знаходяться в розчині то зрозуміло, що в 1 М розчині електроліту частинок буде більше, отже, ці показники Росм, р, Δtкип, tкрист будуть мати більші значення.

Висновок: При однакових концентраціях розчинів електролітів і неелектролітів значення р, Δtкип, tкрист - будуть мати більші значення в
розчинах електролітів, що пов'язано з дисоціацією їх на іони.
Коефіцієнт, що пов'язує відхилення від законів Вант-Гоффа та Рауля в
розчинах електролітів називається - ізотонічний коефіцієнт і
Ізотонічний коефіцієнт - і розраховують експериментально, ЯК
|
|
|
|
Відношення дослідних даних (Росм, |
р, Δtкип, tкрист) до розрахункових: і = Р1осм: |
||
|
|
||
Росм |
= р1 : р = Δt1кип : Δtкип = t1крист : |
t |
крист |
Можна було б сподіватися що в розчинах електролітів значення Росм,  р, Δtкип, tкрист будуть збільшені в таку ж кількість разів, скільки утворюється іонів при дисоціації, наприклад, в розчині NaCI в 2 рази. Насправді збільшення відбувається, але не в 2 рази, а трохи менше. Саме тому і - ізотонічний коефіцієнт пов'язаний із ступенем дисоціації а електроліту:
р, Δtкип, tкрист будуть збільшені в таку ж кількість разів, скільки утворюється іонів при дисоціації, наприклад, в розчині NaCI в 2 рази. Насправді збільшення відбувається, але не в 2 рази, а трохи менше. Саме тому і - ізотонічний коефіцієнт пов'язаний із ступенем дисоціації а електроліту:
α= кількість молекул, що розпалися на іони до загальної кількості молекул і = 1 + α (n-1) де n - кількість іонів, що утворює одна молекула
α=( і – 1) / (n-1)
Сильні електроліти - це електроліти здатні повністю дисоціювати на іони, це означає що в таких розчинах α має сягати 100%. Але як показують досліди, навіть в розчинах сильних електролітів α не досягає 100%. При цьому вказують „уявну ступінь дисоціації”, яка менша за очікувану. В чому причина такого явища?
Причина в тому, що в розчинах сильних електролітів іони знаходяться під впливом різних взаємодій: взаємодії гідратованих іонів протилежних знаків
Na+....Сl-; взаємодії іонів з молекулами води та ін.
Все це приводить до того, що іони в розчинах не вільні, а знаходяться певною мірою частково зв'язані різними силами. Тому для сильних електролітів вводять поняття активність іонів - а - або ефективна концентрація. Активність пов'язана з концентрацією розчину за формулою:
а = См * f, де f - коефіцієнт активності іону, См - молярна концентрація іону.
Зрозуміло, що активність іонів ніколи не відповідає значенню молярної концентрації, що пов'язано з вище вказаними причинами, тому а < См, значить f
менше 1.

Від чого залежить f? Від природи іону, валентності, заряду, концентрації розчину електроліту. Наприклад: f(KCI) в 0,005 М = 0,927 f(KCI) в 1 М = 0,604.
Висновок: в сильно розведених розчинах сильних електролітів, де відстані між іонами збільшуються, а сили взаємодії зменшуються коефіцієнт активності f наближається до 1.
Але якщо взяти дуже концентрований розчин електроліту, то можна спостерігати також збільшення f, що пов’язано з недостачею молекул води для утворення гідратних оболонок, а іони без гідратних оболонок дуже рухливі і активні.
Розглянемо приклад, коли розчин електролітів містить не два, а більше іонів
(3,4...) Чи буде змінюватися активність іонів в залежності від наявності інших іонів? Зрозуміло, що додаткове введення інших іонів збільшує сили взаємодії і зменшує активність іонів.
Для того, щоб врахувати вплив всіх взаємодій на активність іонів вводять поняття - іонна сила розчину - m - дорівнює півсумі добутку кониентраиій кожного іону на квадрат його заряду
m=0.5 (c1 * z12 + c2 * z22 + …. + cn * zn2)
Чим більша іонна сила розчину, тим менша активність іону; і відповідно
менший коефіцієнт активності іону; що пов'язаний з іонною силою.
Приклад: розрахуємо іонну силу розчину 0,02 М Na2SО4 та 0,02 М КСІ:
Висновок: збільшення валентності іонів, та іх числа приводить до
збільшення т. а відповідно до зменшення f.
Для практичних цілей корисним є слідуючи наближене правило:
Коефіцієнт активності (f) для іонів однакової валентності має майже однакові
значення в розчинах, що мають однакові значення іонної сили розчину.
Так для слабкого бінарного електроліта концентрація [Kt+] = [An-] = с(Х)αі, а
концентрація недисоційованих молекул [KtAn] = с (Х) – с (Х)*αі = |
= с (Х) (1 – |
αі). |
|
Підставивши ці значення у вираз для константи дисоціації, одержимо:

Кд = с (Х)*αі*с (Х)*αі / с (Х)*(1 - αі) = αі2*с (Х)/ (1 - αі).
Це співвідношення називають законом розведення Оствальда (1888).
Для слабкого електроліту αі << 1, тоді величиною αі у знаменнику можна знехтувати і рівняння прийме вигляд:
Кд ≈ αі2*с (Х) або αі ≈ √Кд/с (Х).
Якщо замість 1/с (Х) підставити V(Х) = 1/с (Х), яке називається розведенням,
рівняння набуде вигляду
αі ≈ √КдV (Х). або
Відповідно закон Оствальда може бути сформульований так: ступінь
дисоціації слабкого електроліту зростає з розведенням розчину.
Сильні електроліти не підкоряються цьому закону.
Багатоосновні кислоти і багатокислотні основи дисоціюють ступінчасто.
Дисоціація за ступенями характеризується ступінчастими константами. На прикладі фосфорної кислоти.
Сумарне рівняння. Сумарна константа дисоціації Ксум = К1К2К3. При цьому К1 > К2 > К3. Замість константи дисоціації зручніше користуватися її десятковим логарифмом, взятим з оберненим знаком : рКд = - lg Кд. Наприклад для оцтової кислоти Кд = 1,76*10-5, і відповідно рКд = 4,76.
ОСМОТИЧНИЙ ТИСК РОЗЧИНІВ БІОПОЛІМЕРІВ
Розчини ВМС представляють собою істинні розчини, тобто гомогенні,
термодинамічно стійкі, що не потребують стабілізатора, і утворюються мимовільно системи. Однак розчини ВМС розглядають в колоїдної хімії, так як розміри їх молекул наближаються, а в деяких випадках навіть перевершують розмір колоїдних частинок. Крім того, розчини ВМС в «поганих» розчинниках містять молекули або агрегати молекул з явно вираженою міжфазною поверхнею.
У концентрованих розчинах ВМС зазвичай виникають досить великі асоціати

молекул, які можна розглядати як другу фазу. Нарешті, розчини ВМС завдяки великим розмірам їх молекул мають ряд властивостей ліозолей: схожістю оптичних властивостей, малою швидкістю дифузії, низьким осмотичним тиском.
Все це дозволяє розглядати багато проблем одночасно і для колоїдних розчинів, і
для розчинів ВМС.
На противагу золям осмотичний тиск розчинів ВМС значний і може бути виміряний з достатньою точністю, що використовується для визначення їх молекулярної маси.
З підвищенням концентрації ВМС їх осмотичний тиск перестає підкорятися закону Вант-Гоффа (Росм = СmRT) і росте швидше, причому експериментально отримана крива лежить вище теоретичної прямої.
Рис. Залежність осмотичного тиску від концентрації розчину: 1 - розчин ВМС; 2 - розчин низькомолекулярного неелектроліту
Причиною відхилення від законів Вант-Гоффа є гнучкість ланцюгів ВМС, які поводяться, як кілька коротких молекул. Для розрахунку осмотичного тиску розчинів ВМС запропоновано рівняння Галлера:
де c - концентрація розчину ВМС, г/л; М - молярна маса, г/моль; b -
коефіцієнт, що враховує гнучкість і форму молекули ВМС в розчині.
