
- •КонТрольные задания по Химии
- •Предисловие
- •Тема 1. Основные понятия и законы химии
- •Тема 2. Строение атома
- •Тема 3. Химическая связь
- •Тема 4. Периодическая система химических элементов д.И. Менделеева
- •Тема 5. Закономерности протекания химических процессов
- •Тема 6. Способы выражения состава растворов
- •Тема 7. Свойства неэлектролитов
- •Тема 8. Растворы электролитов
- •Тема 9. Гидролиз солей
- •Тема 10. Окислительно-восстановительные реакции
- •Тема 11. Гальванический элемент
- •Тема 12. Электролиз
- •Тема 13. Коррозия металлов
- •Тема 14. S-Элементы
- •Тема 15. Жесткость воды
- •Тема 16. P-Элементы
- •Тема 17. D-Элементы
- •Варианты котрольных заданий для механических специальностей
- •Список рекомендуемой литературы
- •Содержание
- •КонТрольные задания по Химии
- •650056, Г. Кемерово, б-р Строителей, 47
- •650010, Г. Кемерово, ул. Красноармейская, 52
Тема 4. Периодическая система химических элементов д.И. Менделеева
Почему в периодической системе элементы аргон, кобальт, теллур находятся соответственно перед калием, никелем, иодом, хотя имеют большую относительную атомную массу?
Как изменяются свойства элементов II периода с увеличением заряда ядра атома элемента? Почему первые (Li, Be) называются s-элементами, остальные -p-элементами?
Почему хром и сера, фосфор и ванадий, хлор и марганец расположены в одной группе периодической системы?
Почему при наличии двух электронов на внешнем энергетическом уровне у атомов кальция и цинка они не являются полными химическими аналогами?
Какие элементы называются s-, p-, d-, f-элементами? Где они расположены в периодической системе химических элементов? В чём их основные различия?
Почему Ca(OH)2является более сильным основанием, чем Mg(OH)2?
Почему реакция лития с водой происходит менее энергично, чем реакция калия с водой?
Почему реакция Sr и Ba с водой протекает энергичнее, чем Mg и Ca?
Как изменяется сродство к электрону у атомов элементов в периодах и группах? Какой элемент является самым сильным окислителем?
Что такое электроотрицательность? Какой элемент является более активным неметаллом: а) Se или Te; б) Te или I?
Как изменяются радиусы атомов элементов в группах? Как изменяется энергия связей в ряду: F2- Cl2 - Br2 - I2?
Что называют сродством к электрону? Для каких элементов эта величина имеет наибольшее положительное значение и для каких - наибольшее отрицательное? Приведите примеры.
Почему сродство к электрону увеличивается в ряду: N, O, F и внезапно уменьшается у Ne?
Как изменяются металлические и неметаллические свойства элементов с увеличением порядкового номера в малых и больших периодах?
Какой из элементов: а) литий или калий; б) магний или стронций; в) германий или свинец обладают более выраженными металлическими свойствами?
Как изменяются основные и кислотные свойства оксидов и гидроксидов элементов в периодах в зависимости от увеличения порядкового номера элемента?
Какой из гидроксидов является более сильным основанием: а) Sr(OH)2или Mg(OH)2; б) LiOH или KOH; в) Ca(OH)2или Ba(OH)2?
Какие оксиды и гидроксиды образуют азот и висмут? Какими свойствами они обладают? Докажите соответствующими уравнениями реакций.
Почему медь имеет меньший радиус, чем калий, хотя они находятся в одной группе и одном периоде? Какой из них более металличен?
Какие химические свойства проявляют оксиды марганца: MnO, Mn2O3, MnO2, MnO3, Mn2O7и соответствующие им гидроксиды?
Тема 5. Закономерности протекания химических процессов
Исходя из значений стандартных энтальпий образования H0f,298 и абсолютных энтропий веществ S0298, вычислите свободную энергию Гиббса G0f,298 реакции 2Н2О(ж) + 2Cl2(г) = 4HCl(Г) + O2(г) и определите направление процесса при стандартных условиях.
|
|
______
* См. условие задачи № 81.
Напишите выражение константы равновесия для системы:
PCl5(г)
![]() PCl3(г)
+ Cl2(г)
,
PCl3(г)
+ Cl2(г)
,
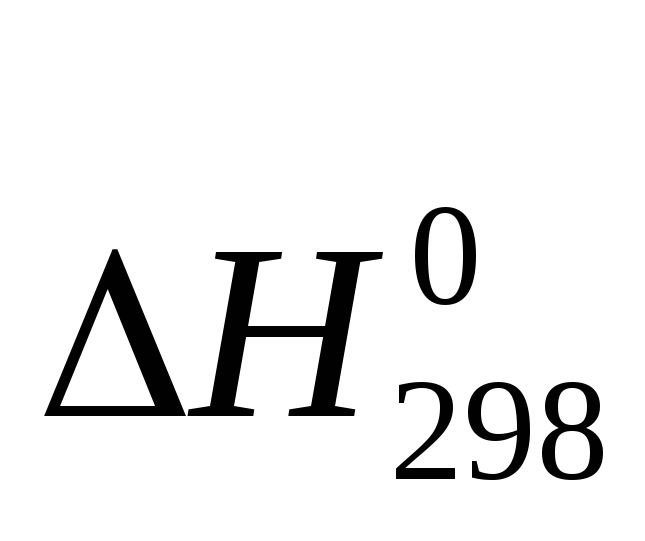 = 92,6 кДж.
= 92,6 кДж.
Как изменить: а) температуру; б) давление; в) концентрацию исходных веществ, чтобы сместить равновесие в сторону образования продуктов?
|
№ задач |
Система |
|
|
102.* |
N2(г)
+ O2(г)
|
+180,7 |
|
103.* |
CO(г)
+ H2O(г)
|
-41,2 |
|
104.* |
2NO(г)
+ O2(г)
|
-113,0 |
|
105.* |
2H2O(г)
|
+483,7 |
|
106.* |
PCl3
(г) +
Cl2(г)
|
-92,6 |
|
107.* |
4HCl(г)
+ O2(г)
|
-114,5 |
|
108.* |
COCl2(г)
|
+112,5 |
|
109.* |
CO
(г)
+ 2H2(г)
|
+193.3 |
|
110.* |
CO2(г)
+ H2(г)
|
+41,2 |
|
111.* |
2HBr(г)
|
+72,5 |
|
112.* |
2NO(г)
|
-180,7 |
|
113.* |
CH4
(г)
+ CO2
(г)
|
+247,4 |
|
114.* |
2H2
(г)
+ O2
(г)
|
-483,7 |
|
115.* |
2HCl(г)
|
+184,5 |
|
116.* |
H2
(г)
+ J2
(г)
|
+51,9 |
|
117.* |
N2
(г)
+ 3H2
(г)
|
-92,4 |
|
118.* |
2NOCl(г)
|
+73,6 |
|
119.* |
2H2O(г)
+ 2Cl2(г)
|
+114,5 |
|
120.* |
2SO2(г)
+ O2
(г)
|
-196,6 |
______
* См. условие задачи № 101.

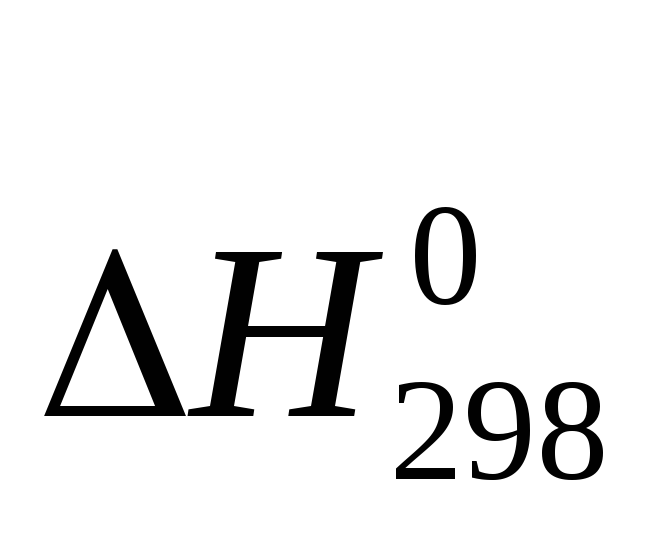 (кДж)
(кДж)